干贝多糖的蛋白质脱除方式对抗氧化活性的影响
2021-09-04王思婷李欣怡赵前程李智博
王思婷,薛 蕊,李欣怡,赵前程,2,3,李智博*,2,3
(1.大连海洋大学 食品科学与工程学院,辽宁 大连 116023;2.辽宁省水产品分析检验及加工技术科技服务中心,辽宁 大连 116023;3.辽宁省水产品加工及综合利用重点实验室,辽宁 大连 116023)
海湾扇贝(Argopecten irradians)是一种重要的经济类海洋贝类。海湾扇贝柱富含多种营养成分,蛋白质、脂肪、糖类质量分数分别占14.03%,1.20%和3.07%,其中的总糖质量分数显著高于岩扇贝(1.9%)、虾夷扇贝(1.79%)及栉孔扇贝(0.45%)[1],极具开发价值。据报道,扇贝多糖具有抗肿瘤、提高免疫力、抗氧化和抗凝血等活性[2-4],已经成为重要的功能食品资源。
由于扇贝不易贮藏,干制成为扇贝储藏的主要手段。由于多糖与蛋白质相连,而海洋贝类普遍具有高蛋白质的特性[5],热加工干制过程会加速两者的结合,提取的多糖成分通常会含有蛋白质杂质。为减轻蛋白质对多糖结构和生物活性研究的干扰,脱蛋白质具有重要的意义。目前较普遍的蛋白质脱除 方 法 如:TCA法、Seveage法、酶 法 等,其 中,Seveage法不适合食品加工行业。现阶段对于扇贝多糖脱蛋白质的研究多集中于多糖得率和蛋白脱除率上,如李雪梅等[2]采用乙醇沉淀法结合TCA法脱除海湾扇贝多糖的蛋白质,脱除率达90%以上;刘禹等[6]的研究表明,一种新兴的D-葡萄糖酸-δ-内酯(GDL)蛋白质脱除法,对虾夷扇贝多糖的蛋白质脱除率可达99%,效果优于TCA法。
蛋白质脱除方法在不同程度上都会影响到多糖的含量、得率或者活性,目前,关于蛋白质脱除方式对多糖结构、活性的影响鲜有报道。作者对干贝多糖进行不同方式的脱蛋白质处理,并比较了蛋白质脱除方式对干贝多糖结构和抗氧化活性的影响,以期找出干贝多糖的最佳脱蛋白质方法,为研究干燥过程对干贝多糖的影响提供参考。
1 材料与方法
1.1 材料与试剂
实验原料为海湾鲜扇贝,由大连玉洋集团有限公司提供,鲜贝柱于50℃下烘干,自制为干贝柱,粉碎备用。
木瓜蛋白酶(1×105u/g)、碱性蛋白酶(2×105u/g):上海瑞永生物科技有限公司产品;氢氧化钠(分析纯):沈阳市联邦试剂厂产品;三氯乙酸(TCA):天津市科密欧化学试剂有限公司产品;浓硫酸(分析纯):国药集团化学试剂有限公司产品;D-葡萄糖酸-δ-内酯(GDL):阿拉丁试剂(上海)有限公司产品;过氧化氢(分析纯)、水杨酸(分析纯):北京化学试剂有限公司生产产品;FeSO4·7H2O(分析纯):天津市大茂化学试剂厂产品;苯酚、无水乙醇(分析纯):新光化工试剂厂产品;二苯基苦味肼基自由基(DPPH):梯希爱(上海)化成工业发展有限公司产品。
1.2 仪器与设备
PAL-1便携式折光仪:日本ATAGO公司产品;XH-C漩涡混匀仪:常州越新仪器制造有限公司产品;SYNERGY HI酶标仪:美国伯腾仪器有限公司产品;UDK152全自动凯氏定氮仪:意大利VELP公司产品;DY-200-BZ空气浴振荡摇床:厦门德仪设备有限公司产品;高效液相色谱仪:安捷伦科技有限公司产品;L-8900型氨基酸自动分析仪:日本HITACHI公司产品;GI21M湘仪离心机:上海医疗器械有限公司手术器械厂产品;FD-1型冷冻干燥机:北京博医康实验仪器有限公司产品;Lambda 25紫外-可见分光光度计:美国PerkinElmer公司产品;Sigma300扫描电子显微镜:卡尔蔡司(上海)管理有限公司产品。
1.3 方法
1.3.1 干贝粗多糖的提取精确称取适量干贝柱粉,以液料体积质量比为40 mL∶1 g加入去离子水,在80℃下热水浸提4 h后超声9 min。过滤滤渣,调整浸提液固形物质量分数至10%,添加质量分数2%的木瓜蛋白酶进行酶解,酶解时间3 h、温度57.8℃、pH 7.1。离心取上清液,加入体积分数95%乙醇至乙醇最终体积分数为75%,4℃静置12 h后,离心取沉淀,挥醇后冻干,得干贝粗多糖(DAMP)。将DAMP配制成质量浓度为50 mg/mL的粗多糖溶液备用。
1.3.2 碱酶法蛋白质脱除参照韩莹等的方法[7]并略做改进。将粗多糖溶液pH值调至10,加入碱性蛋白酶使酶质量分数为2%,于50℃酶解3 h,沸水浴10 min灭酶,4 000 r/min离心10 min,收集上清液,醇沉后冷冻干燥。
1.3.3 稀碱法蛋白质脱除参照陈利华等的方法[8]并略做改进。60℃下用0.1 moL/L的NaOH溶液提取3 h,4 000 r/min离心10 min,收集上清液,醇沉后冷冻干燥。
1.3.4 TCA法蛋白质脱除参照李雪梅等的方法[2]并略做改进。将质量分数2%的TCA溶液与一定体积的粗多糖溶液等体积混合,震荡反应3 h,4 000 r/min离心10 min,收集上清液,醇沉后冷冻干燥。
1.3.5 GDL法蛋白质脱除参照刘瑀等的方法[6]并略做改进。向粗多糖溶液中加质量分数2%的GDL溶液,使GDL的终质量分数达到0.3%~0.5%。置于45℃的恒温水浴锅中反应3 h,4 000 r/min离心10 min,收集上清液,醇沉后冷冻干燥。
1.3.6 蛋白质脱除率及多糖损失率的计算采用苯酚-硫酸法[9]测定多糖,采用凯氏定氮法[10]测定蛋白质质量分数,测定3组平行取平均值。蛋白质脱除率及多糖损失率的计算公式如下:
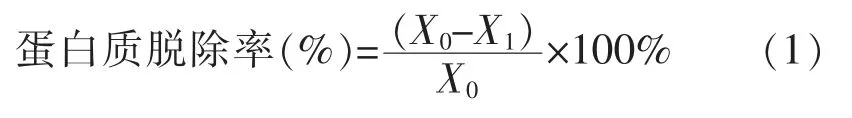
式中:X0为脱蛋白质前样品中蛋白质量分数;X1为脱蛋白质后样品中蛋白质量分数。
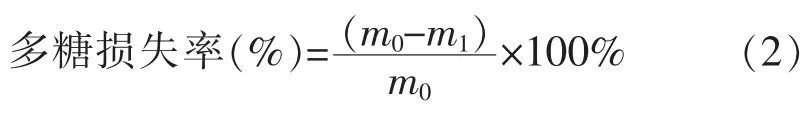
式中:m0为脱蛋白质前样品提取物质量;m1为脱蛋白质后样品提取物质量。
1.3.7 单糖组成分析采用PMP柱前衍生高效液相色谱法测定脱蛋白质纯化后多糖的单糖组成,具体操作参考文献[11]。
1.3.8 氨基酸组成分析使用氨基酸自动分析仪测定氨基酸种类与含量,氨基酸质量分数以mg/g表示。具体操作参考文献[12]。
1.3.9 刚果红试验参照陈杨扬等的方法[13]并略做改进。称取多糖样品各1 mg,加入1 mL蒸馏水和80μmol/L刚果红溶液2 mL,充分混匀后加入NaOH,使各组NaOH终浓度分别为0、0.1、0.2、0.3、0.4、0.5 mol/L,并用紫外全波段扫描,记录不同NaOH浓度下的最大吸收波长。
1.3.10 扫描电镜分析参照Wang等的方法[14]并略做改进。取适量经蛋白脱除的多糖样品,镀上导电金粉后将其放置于扫描电镜下观察。工作条件:加速电压15 kV,观测倍数分别选用200、1 000、10 000倍。
1.3.11 DPPH自由基清除能力的测定参照Odeleye等的方法[15]并略做改进。将待测样品配制为30 mg/mL的样液,用无水甲醇依次稀释成2、4、6、8、10 mg/mL梯度。将2 mL样液与2 mL 0.16 mmol/L DPPH-甲醇溶液(6.31 mg/dL)混合均匀。以VC作阳性对照,室温下避光静置30 min后于517 nm下用酶标仪测定吸光值。每个浓度梯度进行3组平行试验。DPPH清除率计算方式为:
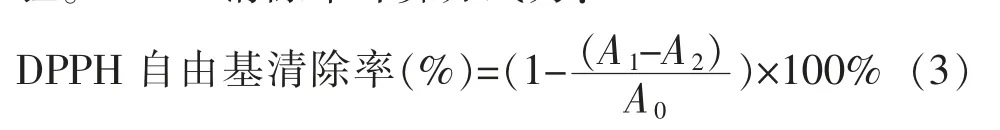
式中:A0为无水甲醇代替样品的测得吸光度值;A1为样品溶液的测得吸光度值;A2为无水甲醇代替DPPH测得的吸光度值。
1.3.12 羟基自由基清除能力的测定参照Liu等的方法[16]并略做改进。将待测样品配制为30 mg/mL的原液,依次稀释成2、4、6、8、10 mg/mL的溶液。将1 mL样液与1 mL 9 mmol/L FeSO4溶液、1 mL 9 mmol/L的水杨酸-乙醇溶液和1 mL 8.8 mmol/L的H2O2溶液混合均匀,37℃水浴30 min,以VC作阳性对照于510 nm下测吸光值,清除率按下式计算:

式中:A3为去离子水代替样品的测得吸光度值;A4为样品溶液的测得吸光度值;A5为去离子水代替H2O2溶液测得的吸光度值。
1.3.13 数据处理实验结果以(平均值±标准偏差)表示,实验数据采用SPSS Statistics 17.0软件进行单因素ANOVA分析,显著性水平设定为0.05。
2 结果与分析
2.1 干贝多糖蛋白质脱除的结果
本实验中,在多糖提取物不被显著降解的条件下去除结合的蛋白质,以提高多糖的质量分数是十分必要的。1.3.1中得到的DAMP的多糖质量分数为(53±0.58)%,蛋白质质量分数为(39.09±0.88)%。经4种蛋白质脱除方式处理后,多糖质量分数、蛋白质脱除率和多糖损失率见表1。多糖质量分数由高到低分别为:TCA法>稀碱法>碱酶酶解法>GDL法。其中,TCA组多糖质量分数显著高于其他3组。蛋白质脱除率及多糖损失率由高至低依次为:TCA法>稀碱法>碱酶法>GDL法。结合多糖质量分数、蛋白脱除率与多糖损失率分析可得,TCA法脱蛋白质最有效,但多糖损失严重;DAMP经稀碱法与酶解法处理后,多糖质量分数无显著差别,但稀碱组蛋白质脱除率及多糖损失率显著高于酶解组;经GDL法处理后,多糖质量分数及蛋白质脱除率均显著低于其他方式,多糖损失率也最少。
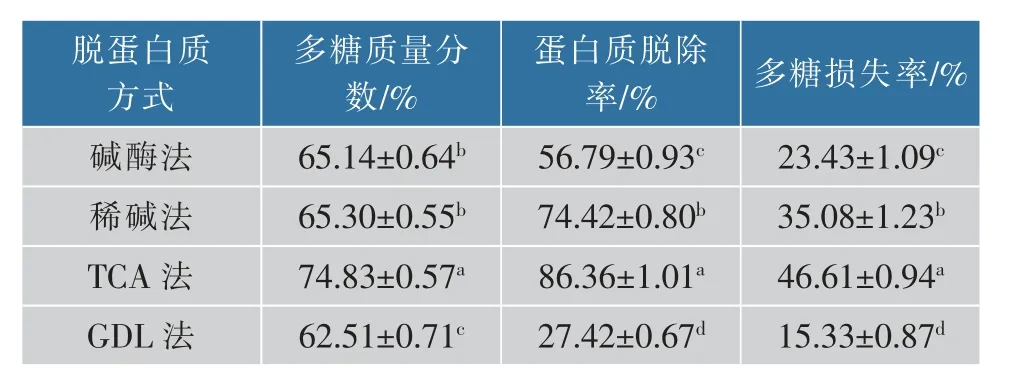
表1 蛋白质脱除方式对干贝多糖质量分数、蛋白质脱除率及多糖损失率的影响Table 1 Effects of deproteinization methods on polysaccharides content,protein removal rate and polysaccharide loss rate from dried adductor muscle
2.2 单糖组成分析
由表2可知,碱酶组多糖含有Man、GlcN、GalUA、Glc、Gal、Arb;稀碱组多糖含有GlcN、Glc、Gal;TCA组 多 糖 含 有GlcN、GalUA、Glc;GDL组 多糖含有Man、GlcN、Rha、GalUA、Glc。不同蛋白质脱除方式所得多糖的单糖组成略有差别,稀碱组和碱酶组多糖中的半乳糖醛酸在碱性环境中生成半乳糖,而TCA法和GDL法多糖中检测到半乳糖醛酸,未检测到半乳糖。各组数据中,葡萄糖质量分数均最高。据报道,海湾扇贝多糖组分为中性多糖和酸性多糖[2],与本实验结果一致。

表2 干贝多糖各组单糖质量分数Table 2 Monosaccharide contents of polysaccharides removed from dried adductor muscle%
2.3 氨基酸组成分析
为了明确不同脱除方式处理的扇贝多糖中残留蛋白质的情况,以及这些蛋白质与抗氧化活性之间的关系,对4种方式脱蛋白后的干贝多糖进行了氨基酸组成分析,结果显示:干贝多糖中的总氨基酸质量分数为15~160 mg/g,碱酶组和稀碱组均检测出16种氨基酸,TCA组和GDL组均检测出14种氨基酸,可见氨基酸种类齐全。由表4可知,碱酶组的亲水氨基酸及极性氨基酸质量分数较高,非极性氨基酸及必需氨基酸质量分数较低,疏水性氨基酸质量分数最低;稀碱组的疏水氨基酸质量分数较低,其他4种氨基酸质量分数均最低;TCA组的疏水性氨基酸、非极性氨基酸与必需氨基酸质量分数最高,亲水性氨基酸与极性氨基酸质量分数较低;GDL组的亲水性氨基酸和极性氨基酸质量分数最高,疏水性氨基酸、非极性氨基和必需氨基酸质量分数较高。
2.4 刚果红试验分析
由图1可知,在氢氧化钠的浓度为0~0.1 mol/L时,对照组(刚果红)的最大吸收波长逐渐减小,GDL组和碱酶组多糖与刚果红结合生成的络合物的最大吸收波长随NaOH浓度的增大红移明显发生,表明GDL组和碱酶组多糖存在三螺旋结构;TCA组和稀碱组多糖不具有三螺旋结构[13],可能是DAMP在碱液、酸液处理过程中,维持稳定三螺旋结构作用的分子内、分子间氢键受到破坏,导致三螺旋结构变性[17]。
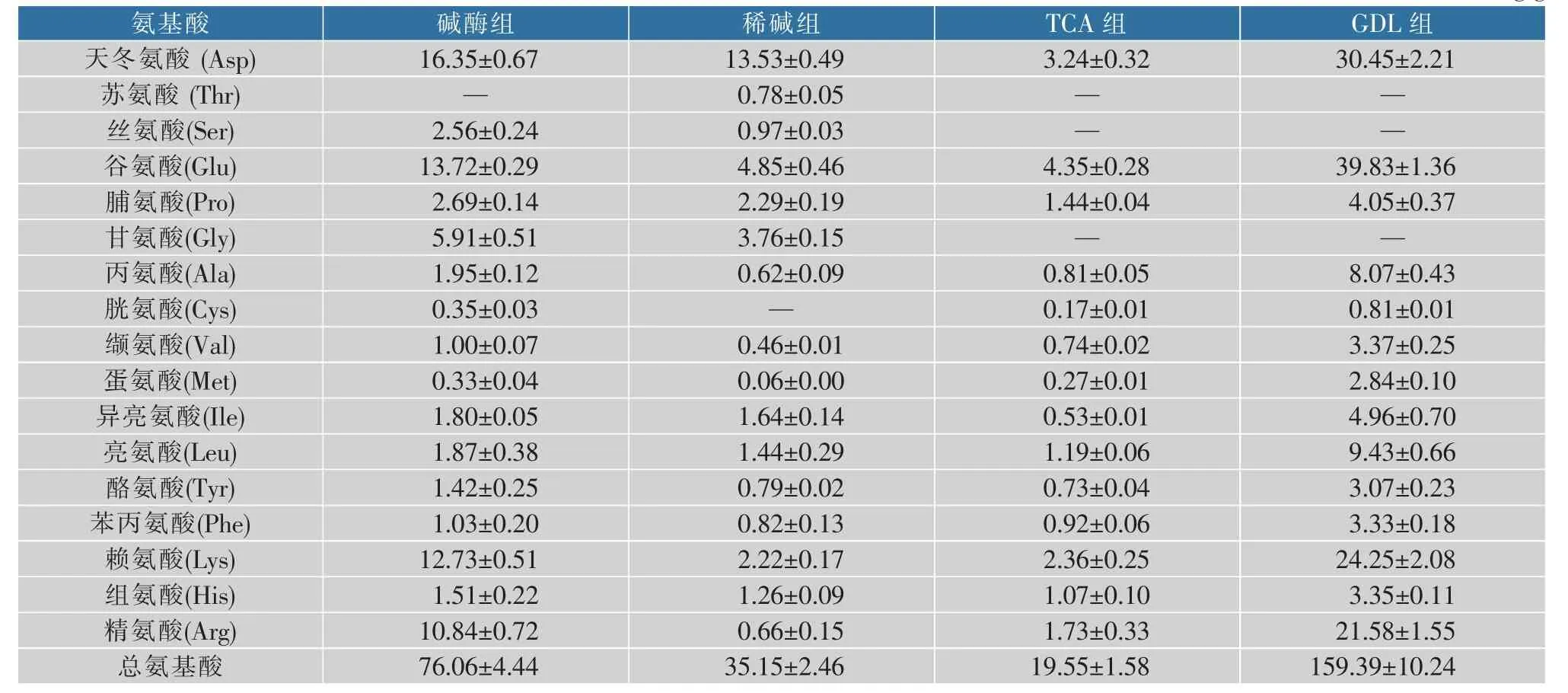
表3 干贝多糖的氨基酸组成Table 3 Amino acid composition of polysaccharides removed from dried adductor muscle mg/g

表4 不同蛋白质脱除方式的多糖中氨基酸分类与质量分数Table 4 Classification and content of amino acids in the components of polysaccharide prepared by different deproteinization%
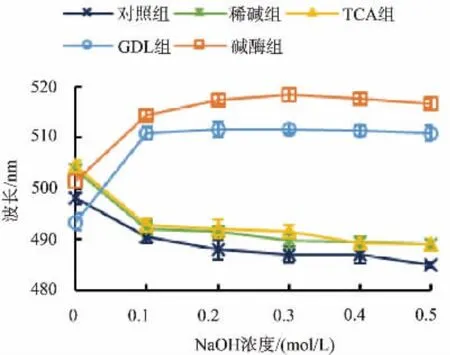
图1 4种蛋白质脱除方式的多糖-刚果红络合物在不同碱浓度中的最大吸收波长Fig.1 Maximum absorption wavelength of polysaccharide-Congo red complex extracted by four deproteinization methods under various concentration of NaOH
2.5 扫描电镜分析
如图2所示,碱酶组多糖放大200倍时,呈不规则块状,且有碎屑状粗多糖散落,疏松多孔;放大粗糙面至1 000倍时,表面凹凸不平,散布致密圆形孔径;10 000倍下,多糖表面略粗糙,有裂纹。稀碱组多糖放大至200倍时,呈大小不一的不规则片状,表面光滑;1 000倍下,多糖切面平整;10 000倍时,多糖表面稍有圆形凸起和凹陷,棱角清晰。TCA组多糖放大至200倍,呈大小、形状不一的块状;1 000倍条件下,多糖碎片上有条形沟纹和孔洞;放大至10 000倍时,观察到孔洞深浅不一,比较光滑,并呈直线排列于沟纹凹陷中。GDL组多糖在200倍条件下,呈不规则片状;放大粗糙面至1 000倍下,多糖表面有裂纹,不平整,有大小不一的圆孔;10 000倍条件下,观察到圆孔内粗糙不平整,有疏散的细孔。由图2可知,稀碱组多糖较光滑致密,分子排列较整齐,说明稀碱组多糖分子间相互作用较强[18],其余3组多糖较疏松,多孔。所有多糖分子间隙均较大,可能是干贝柱多糖分子间的斥力导致分子之间有一定的距离。

图2 不同蛋白质脱除方式的粗多糖表面结构Fig.2 Surface structures of crude polysaccharides purified by different deproteinization methods
2.6 体外抗氧化能力分析
如图3所示,未脱蛋白的DAMP与4种蛋白质脱除方式得到的干贝多糖均有一定清除DPPH自由基的能力,但除了GDL组多糖,其他组多糖的DPPH自由基清除能力都不及VC。经GDL法纯化的多糖显示出明显的DPPH自由基清除能力,并呈剂量依赖关系。当多糖质量浓度为10 mg/mL时,GDL组多糖的DPPH自由基清除率为80.56%。不同蛋白脱除方式对干贝多糖清除羟基自由基能力的影响见图4,稀碱组多糖显示出明显的羟基自由基清除能力,并呈剂量依赖关系。当多糖质量浓度为10 mg/mL时,稀碱组多糖的羟基自由基清除率为93.64%,比较接近VC的清除能力(10 mg/mL,99.73%)。碱酶组及GDL组多糖的羟基自由基清除能力优于TCA组多糖,可见,干贝多糖的抗氧化活性与多糖含量并不相关,而是与单糖组成、空间构象等诸多因素有关[19]。

图3 不同蛋白质脱除方式对干贝多糖清除DPPH自由基的影响Fig.3 Effects of different deproteinization methods on the scavenging activities of polysaccharides from dried adductor muscle on DPPH radicals
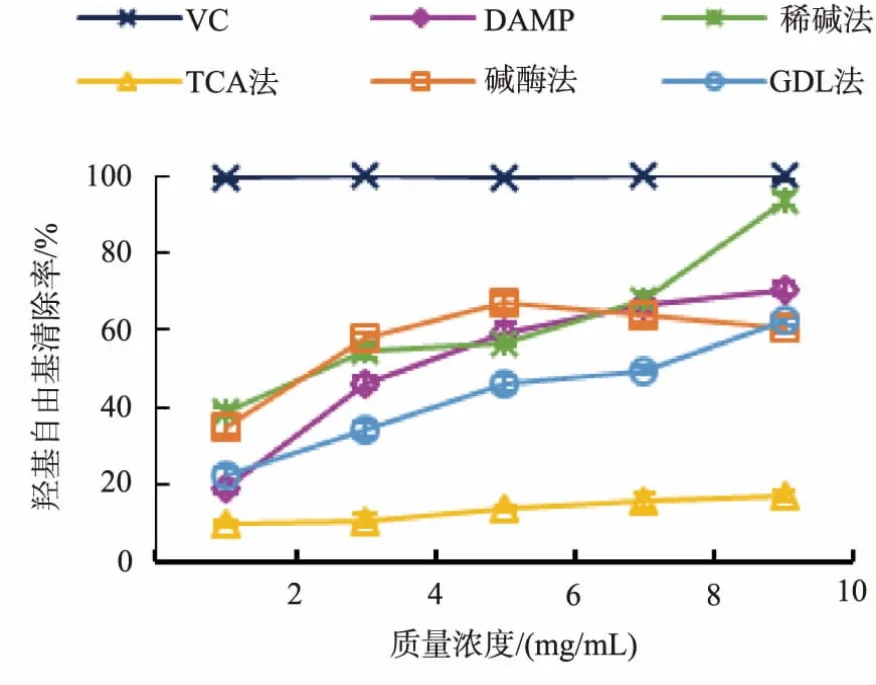
图4 不同蛋白质脱除方式对干贝多糖清除羟基自由基的影响Fig.4 Effects of different deproteinization methods on the scavenging activities of polysaccharides from dried adductor muscle on hydroxyl radicals
DAMP的抗氧化活性不高,可能是贝柱干燥过程中,水分的蒸发使水分子与贝柱多糖中的分子间氢键断裂,引起多糖空间结构的破坏,进而影响抗氧化活性[20]。TCA组多糖对DPPH自由基及羟基自由基的清除能力均不理想,可能在TCA法脱蛋白质过程中,糖苷键在酸性条件下断裂,造成多糖含量检测偏高但活性较低。丰富的氨基酸与生理活性有紧密的联系,总氨基酸含量与抗氧化活性呈正相关[21],TCA组多糖总氨基酸含量不高,这与体外抗氧化试验结果一致。稀碱组多糖表现出良好的羟基自由基清除能力,但DPPH自由基清除能力最弱,可见不同抗氧化活性与干贝多糖结构关系的联系不尽相同。可能由于稀碱组多糖中的基团容易提供质子氢与羟基自由基反应[22]。稀碱组多糖含有较多的Asp和Glu,Asp和Glu具有抗氧化能力,因此推测稀碱组多糖较强的羟基自由基清除能力可能也与其含有的氨基酸有关[23]。GDL组多糖中,疏水性氨基酸、极性氨基酸与非极性氨基酸含量较高,葛晓鸣等[24]研究发现,疏水性氨基酸在DPPH自由基的清除中起到决定性的作用,而极性氨基酸和非极性氨基酸可通过协同作用促进DPPH自由基的清除,因此GDL组多糖表现出良好的自由基清除活性。聚糖链的构象与其生物活性密切相关[25],GDL组及碱酶组多糖的抗氧化活性较好,也可能是其含有的三螺旋结构对多糖活性产生影响。有研究表明,分子间氢键作用是三螺旋结构刚性的主要动力[26]。据报道,刚性三螺旋结构具有抗肿瘤活性及免疫活性[27],三螺旋葡聚糖与其他生物活性间的关系还待进一步研究。
3 结语
不同蛋白质脱除方式的多糖组分、结构和抗氧化活性不同。TCA法脱蛋白效果最显著,脱蛋白质后多糖质量分数提高至(74.83±0.27)%,蛋白质脱除率为(86.36±1.01)%,但多糖抗氧化活性和总氨基酸含量最低,单糖组成简单,不具有三螺旋结构,适用于以干贝多糖结构研究为目的的纯化。GDL法脱蛋白质的效果次于其他3种方式,脱蛋白质后多糖质量分数提高至(62.51±0.71)%,蛋白质脱除率为(27.42±0.67)%,但综合来看多糖抗氧化活性高于其他组多糖,总氨基酸质量分数最高,单糖组成丰富,具有三螺旋结构,该方法比较适合于获取具有较好抗氧化活性的干贝多糖研究。碱酶法脱蛋白效果与稀碱法无显著差别,但其总氨基酸含量高于稀碱组,单糖组成较稀碱组丰富,且具有三螺旋结构,多糖活性高于稀碱组多糖,稍次于GDL组多糖。作者希望获得高含量高活性的多糖组分,故选择碱酶法脱蛋白质。
