艾纳香内生真菌抗细菌和炭疽菌的活性研究
2021-09-03舒雪纯张影波谢小丽徐子琪
元 超,舒雪纯,张影波,王 凯,谢小丽,徐子琪,袁 媛
(1中国热带农业科学院热带作物品种资源研究所/海南省艾纳香工程技术研究中心,海南儋州 571737;2海南大学林学院,海口 570228;3山东第一医科大学第一附属医院,济南 250014;4广东药科大学生命科学与生物制药学院,广州 510006)
0 引言
艾纳香(Blumea balsamifera(L.)DC.)为菊科艾纳香属植物,又名大风艾,冰片艾,作为传统抗菌黎药有着悠久的用药历史[1]。海南民间百姓将其用于刀枪伤口以及妇女的产后沐浴[2],具有杀菌消炎功效。现代药理学研究亦表明其具有较好的抗菌活性,邹婧等[3]研究表明,艾纳香提取物能够很好的抑制白色念珠菌,金黄色葡萄球菌,大肠埃希菌等口腔细菌;Wang等[4]对艾纳香精油抗菌活性进行研究,结果显示艾纳香精油对红毛癣菌具有较强的抑制作用。
植物内生真菌是指生活在健康植物体内,且不引起明显植物病理症状的一大类微生物[5-6],药用植物内生真菌一直是农用和药用先导化合物发现的重要宝库[7-8]。目前有关黎药植物艾纳香内生真菌的研究较少,仅唐青等[9]2017年对贵州产艾纳香内生真菌多样性进行了研究,共获得152株内生真菌,分属于11个属,其中Fusarium,Aspergillus,Trichoderma和Curvularia为其优势菌属,且不同采集时期和不同采集地的艾纳香内生真菌种类均具有一定差异。有关艾纳香内生真菌次生代谢产物方面,元超[10]等对分离自海南艾纳香植物中的一株Corynespora cassiicolaJ9内生真菌进行次生代谢产物的研究,分离得到一个新的缩酚酸环醚类化合物,此类化合物多具有较强的抗菌活性;从艾纳香内生真菌Diaporthesp.中获得dicerandrol类化合物,其对多种病原菌表现出非常好的广谱抑菌性[11];Yuan等[12]对一株艾纳香内生真菌Hypoxylon investiensJ2进行研究获得了4个结构新颖的α-吡喃酮类化合物,表明艾纳香内生真菌具有很好的开发潜力。
炭疽病菌是引发包括艾纳香在内的多种植物炭疽病害的重要病原菌。目前炭疽病害的防控以化学农药为主,为寻找好的生防菌株,进一步开发为微生物源农药,用于艾纳香炭疽病害的生物防控,以及应对日益严重的细菌抗生素耐药性,对采自海南传统抗菌黎药植物艾纳香进行内生菌分离,鉴定,并对内生真菌的抗病原菌活性进行筛选。
1 材料与方法
1.1 材料
1.1.1 供试植物 艾纳香植株采自农业农村部儋州药用植物种质资源圃,经中国热带农业科学院热带作物品种资源研究所王祝年研究员鉴定为菊科艾纳香属植物艾纳香Blumea balsamifera(L.)DC.。
1.1.2 供试菌株 4株供试炭疽菌菌株:Colletotrichum musae、C.coccodes、C.gloeosporioides、C.fioriniae。
4株供试细菌菌株:大肠埃希菌(Escherichia coliATCC 25922)、金黄色葡萄球菌(Staphylococcus aureusATCC 6538)、枯草芽孢杆菌(Bacillus subtilisATCC 9372)、铜绿假单胞菌(Pseudomonas aeruginosaATCC 27853)。
所有供试菌中,C.gloeosporioides为本实验室分离自艾纳香叶片组织,并通过回接实验,证明其具有叶片致病性。其余菌株均由青岛大学药学院李刚老师赠送。
1.1.3 培养基 添加链霉素的水琼脂培养基(琼脂15 g,链霉素100 mg,水1000 mL),PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂15 g,水1000 mL),大米培养基(大米60 g,水80 mL,500 mL三角瓶)MHA培养基(Muellerhinton agar)购自青岛海博生物科技有限公司。
1.2 方法
1.2.1 植物内生真菌分离方法 艾纳香内生真菌的分离采用文献报道的水琼脂法[13],将采集的新鲜组织用自来水冲洗干净,无菌剪刀剪成0.5x1.0 cm的组织段,超净台上用70%乙醇消毒1 min,放入1.3 mol/L的次氯酸钠溶液中3 min,然后用70%乙醇浸泡30 s,无菌水冲洗干净,接种至水琼脂培养基中,2周后,挑取组织边缘长出的新鲜菌丝,接种至PDA平板上进一步纯化、培养,获得的纯化菌株保存于-80℃冰箱。
1.2.2 菌株的分子鉴定 艾纳香内生真菌分别培养3~5天的菌落经液氮研磨后采用CTAB法[14]提取基因组DNA,再将提取出来的基因组DNA在PCR仪上进行ITS-rDNA扩增,扩增所用引物为 ITS1(5′-TCCGTAGGTGAACCTGCGG-3′ ) 和 ITS4(5′-TCCTCCGCTTATTGATATGC-3′)。PCR扩增反应体系为30 μL,扩增的条件为95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸1 min,进行35个循环;72℃最后延伸10 min,12℃保存。将PCR产物送武汉华大基因进行ITS-rDNA测序。返回后,先采用MEGA X[15]软件去除重复测序序列和杂合序列,将均匀整齐的序列提交至真菌分子鉴定的数据库UNITE(https://unite.ut.ee),以E值≤E-10和Bits-score≥1000为鉴定指标以确定真菌的种属地位。构建系统进化树,确定真菌种属地位。
1.2.3 粗提物的制备 将菌株接种于PDA平板培养基上,25°C培养10天,无菌条件下将带菌培养基切块,接种于制备好的大米培养基中,共3瓶,室温下静置培养40天后,加入乙酸乙酯终止发酵,40 KHz超声提取3次,每次30 min,合并滤液,减压浓缩至干,获得粗提物。
1.2.4 炭疽菌抑制试验 采用平板对峙法[16]测定艾纳香内生真菌对4种植物病原炭疽菌的抑制作用。首先将活化好的艾纳香内生真菌菌株采用点培养法接种于PDA培养基皿对称位置(距培养皿边缘约1.5 cm),然后将炭疽菌点接于PDA培养皿的中央,同时以只接炭疽菌的PDA平皿为对照,28℃静置培养,4~7天后观察并记录菌落的生长及抑菌情况,每个处理重复3次,计算抑菌率,见公式(1)。

1.2.5 细菌抑菌活性试验 采用滤纸片法[17]评价了艾纳香内生真菌发酵粗提物的抗细菌活性。将供试细菌分别用LB培养基37℃震荡培养过夜,取200 μL加入到无菌MHA平板培养基上,用涂抹棒均匀涂抹,获得带菌培养基。将待测提取物分别用甲醇溶解,配置成3 μg/μL的浓度,各取20 μL滴加到直径6 mm的无菌滤纸片上,挥干溶剂,平贴于带菌平板培养基表面,37℃培养24 h,观察并记录抑菌圈直径,硫酸链霉素(1 μg/片)为阳性对照,甲醇为阴性对照,所有实验重复3次。
2 结果与分析
2.1 艾纳香内生真菌的分离
采用水琼脂培养基从海南产艾纳香不同组织部位中共分离获得内生真菌191株,经鉴定归属于27个属,45个种,其中相对多度大于9的菌属主要有3个,分别为Diaporthe,Colletotrichum和Fusarium,其在根茎叶3个组织部位中均有分布。Trichoderma,Inaequalispora,Clonostachys,Penicillium仅从根中分离得到,Acrocalymma,Alternaria,Boeremia,Corynespora,Periconia,Pleosporales,Diutina,Pestalotiopsis和Muscodor仅分布于叶片组织中,表明部分属的菌种的分布具有一定的组织偏好或组织特异性(表1)。

表1 艾纳香内生真菌各属的菌株数量和相对多度
2.2 艾纳香内生真菌对植物病原炭疽菌抑制活性
内生真菌与炭疽病菌的平板对峙实验结果显示,供试内生真菌中的14株对炭疽菌具有不同程度抑制作用(表2)。抗炭疽菌活性较好的艾纳香内生真菌有Clonostachys rosea、Corynespora cassiicola、Penicilliumsp.、Fusarium equiseti、Ectophoma pomi和Talaromyces pinophilus。进一步比较发现Talaromyces、Ectophoma和Penicillium属内生真菌抗炭疽菌活性最为突出(图1)。
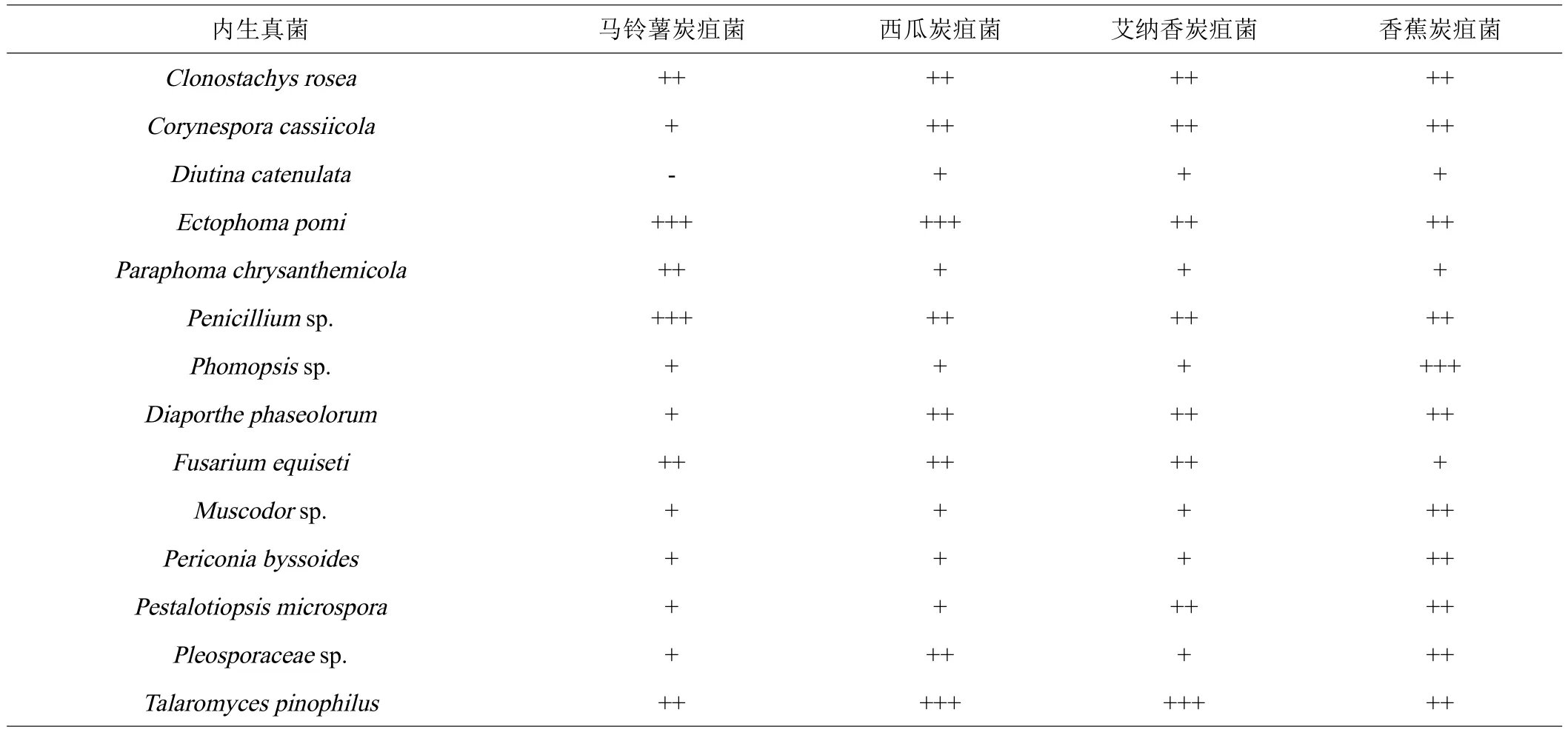
表2 部分内生真菌对4株炭疽菌的抑制活性
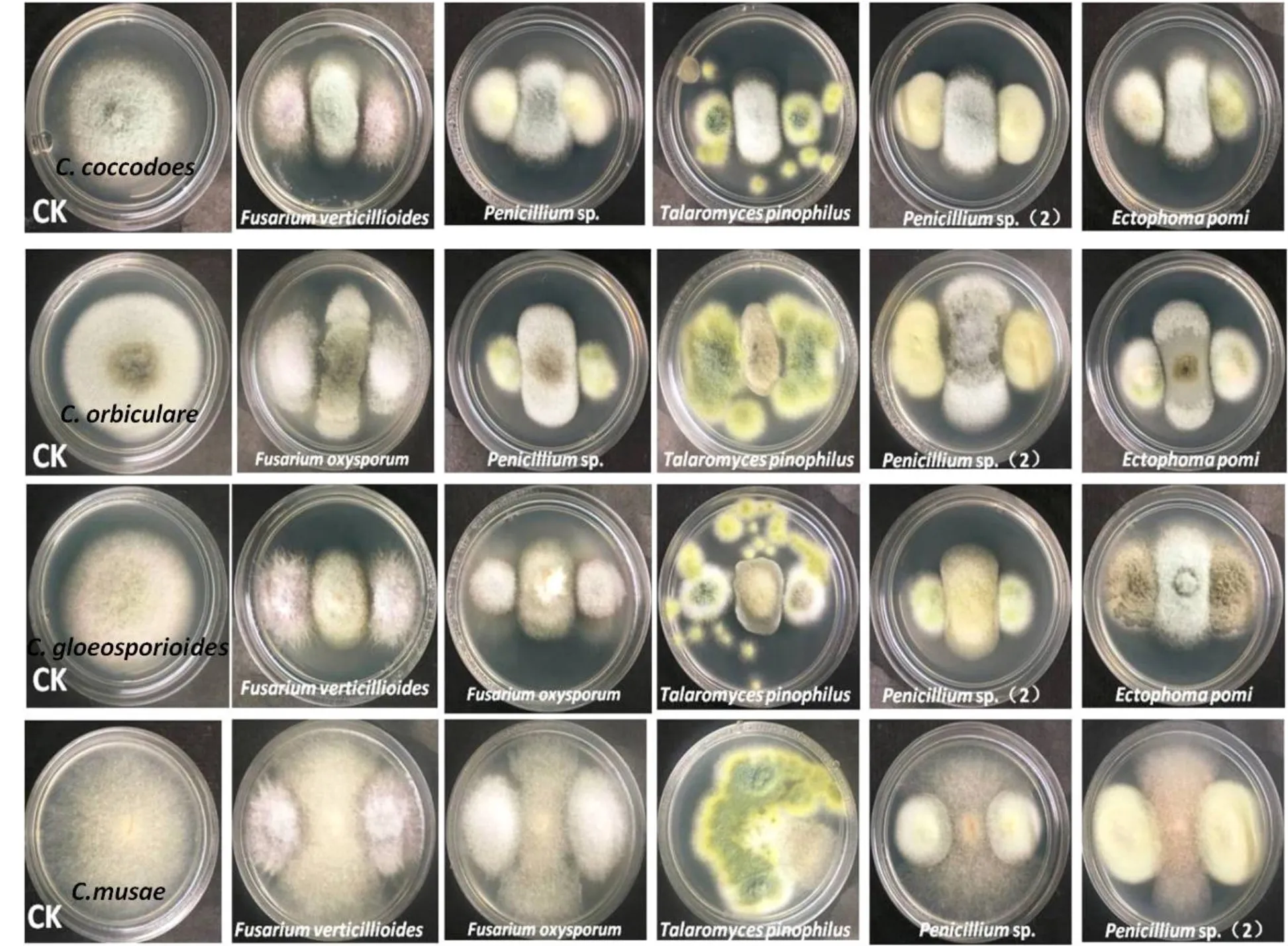
图1 部分植物内生真菌与炭疽菌的平板对峙实验结果
2.3 艾纳香内生真菌次生代谢产物抗细菌活性
抗细菌活性显示,艾纳香内生真菌中的16株发酵产物对4种细菌具有不同程度抑制作用(表3),其中Diaporthe、Fusarium、Penicillium、Phomopsis、Clonostachys、Trichoderma和Inaequalispora属的内生真菌活性较为显著。进一步分析发现,艾纳香的内生真菌Diaporthe phaseolorum和Fusarium equiseti活性尤为突出,其粗提物在浓度为60 μg/片时对金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌的抑菌圈直径均显著大于阳性对照链霉素(浓度:1 μg/片)(图2)。然而,所有供试内生真菌对大肠埃希菌的抑制活性均不强。
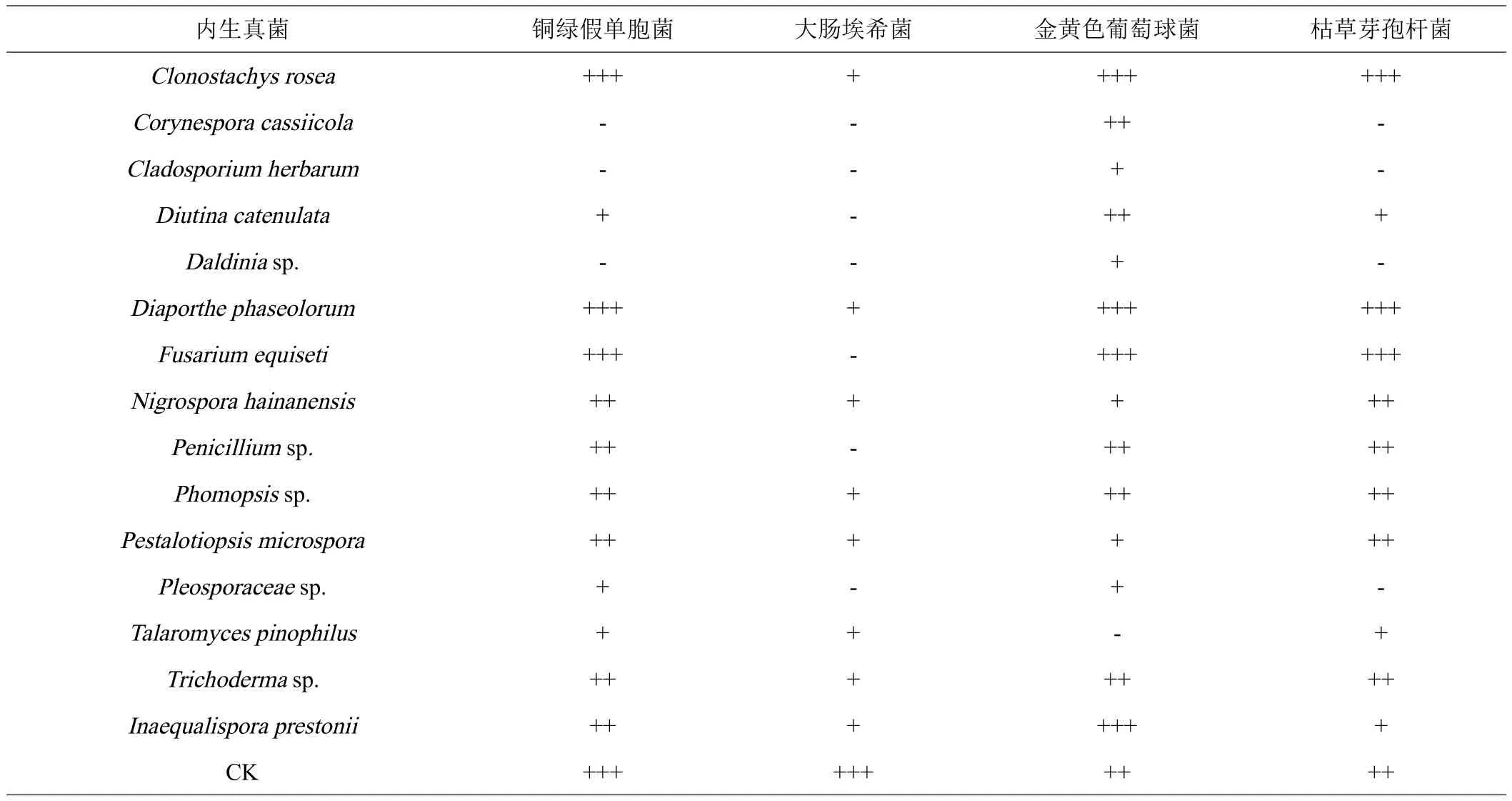
表3 部分艾纳香内生真菌发酵产物对4株细菌的抑制作用
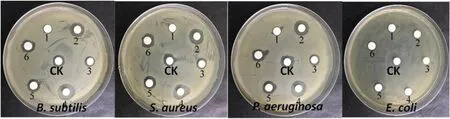
图2 部分植物内生真菌粗提物抗4株细菌试验结果
3 结论与讨论
唐青等[9]2017年报道的贵州艾纳香内生真菌的优势菌属Fusarium、Aspergillus、Trichoderma和Curvularia,与本研究的结果有较大差异,推测不同采集地点以及不同的分离方法可能是导致内生真菌种类不同的重要原因。本研究采用的内生真菌分离方法为水琼脂法,而唐青等采用的组织切片培养法,组织切片培养法选用的是富营养培养基,分离周期短,优势菌丝生长快,容易盖住生长缓慢的内生真菌[18];水琼脂法由于选用的是寡营养的水琼脂培养基,且添加了可以很好抑制细菌和放线菌生长的链霉素,真菌菌丝生长缓慢,培养周期长,很多非优势菌株也可以生长出来,有利于获得更多种类的内生真菌,更适合植物内生真菌的分离。本研究发现,尽管来源于同一种植物,然而两种采集地的艾纳香内生真菌种类却有很大差异,由于植物内生真菌主要是植物在长期进化中,环境微生物通过土壤,昆虫取食,病原菌侵染等途径进入植物体内,并长期定殖下来形成的微生物群落,因此,植物内生真菌种类的不同也间接反映了植物所处环境微生物群落的差异。
随着分子生物学技术的不断发展,高通量测序已经广泛的用于评价植物内生菌丰度。传统培养法由于培养基的组成以及培养条件、环境的限制,会有偏好的选择样本中的一些物种,导致一些物种不能生长[22];其次,在内生真菌生长过程中一些生长快的菌株会掩盖一些生长慢的菌株[23];另外,部分菌种本身具有体外不可培养性,以上原因均导致对内生真菌多样性评价不够全面。相比于传统培养法,高通量测序技术具有快速、准确、信息量大等特点,极大地推动了人们对微生物生态学的认识[24]。张爱梅等[25]2019年对中国沙棘根瘤内生细菌进行多样性分析,结果共检测到167科215属,然而实验室条件下只分离得到8科8属共17株内生细菌,说明实验室条件下单一分离方法获取菌株对内生真菌多样性的系统评价存在一定局限性。然而单纯的高通量测序无法解决内生真菌的资源利用方面的实际问题,因此,后续工作需将不断完善分离培养方法和技术与高通量测序技术相结合,深入挖掘内生真菌资源。
本研究采用水琼脂法分离获得了大量艾纳香内生真菌,并通过ITS序列分析和比对技术进行了菌株鉴定,结果共分离并鉴定191株内生真菌,分属于27属,45种,其中优势菌属为Diaporthe,Paraphoma,Ectophoma,Penicillium,Talaromyces,Hypoxylon,Phomopsis,Colletotrichum和Fusarium。通过滤纸片法和平板对峙培养法评价了内生真菌的抗细菌和抗炭疽菌活性,结果显示,Clonostachys,Fusarium和Diapothe属抗细菌活性较强,Talaromyces、Ectophoma和Penicillium属内生真菌抗炭疽病菌活性较强。植物炭疽病原菌可危害多种植物,引发叶片的病斑进而影响光合作用,目前植物炭疽病的防治仍然以化学防治为主,主要有咪鲜胺,丙环唑,三唑酮等,然而化学农药对环境造成一系列问题,微生物防治具有环境友好、安全等特点受到广泛关注。抗菌黎药植物艾纳香内生真菌目前研究相对较少,现有研究显示其在农用或药用抗菌先导化合物的发现方面具有较好的前景[10-12]。本研究的相关结果不仅可帮助人们了解海南艾纳香内生真菌种类情况,而且有助于对活性艾纳香内生真菌进行次生代谢产物研究,获得先导化合物,服务于农用病害防治。
