深挖实验教学功能 培养证据推理能力——以“盐类的水解原理”为例
2021-09-03广东省中山市第二中学528429林增辉
广东省中山市第二中学(528429) 林增辉
对于发展学生“证据推理”的学科核心素养,课程标准明确提出:具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设,通过分析推理加以证实或证伪;建立观点、结论和证据之间的逻辑关系。在课程标准引领下,部分教师开展了深入的研究:认为化学教学中的证据推理是指根据化学概念、理论和事实性知识,通过比较分析、抽象概括和归纳演绎等推理形式,进行证实和证伪的求证方式,获取新知识、解决新问题的高级思维过程;认为证据推理是获得科学知识的必经方法,需让学生亲历与体验,在教师的引导和帮助下,学会收集证据,进行推理学习。教师们的教学研究成果,开拓了我们的视野,深化了我们对“证据推理”内涵的认识,有效地指导了我们的教学。基于对课程标准的学习和理解,借鉴同行的先进经验,笔者对如何在化学课堂中培养学生证据推理能力,也产生了以下几点思考。首先,教师应明确教学目标,明确什么内容是要得到的“结论”,明确哪些内容能作为“证据”,并且能启发学生及时抓住“证据”;其次,教师应了解学生的知识和能力水平,了解学生在根据“证据”推导出“结论”的过程中,可能要用到的必备知识,可能会碰到的认知障碍,做好充分准备,才能及时启发学生,帮助学生顺利到达成功的彼岸;此外,课堂虽然是可以预设的,但教师也应该尊重学生,充分发挥学生的想象力和创造力,为各种思想的碰撞做好准备。下面,笔者以“盐类的水解原理”为例,阐释基于“证据推理”视角的教学设计过程。
1 教学内容分析
“盐类的水解”是人教版化学选修4第3章第3节的内容,该节包含盐类的水解原理和盐类水解的应用两部分内容,按课时计划,分两个课时完成。笔者选取“盐类的水解原理”作为研究对象。从内容层次来看,需要学生在弱电解质的电离平衡和水的电离平衡的基础上,理解水解的本质是因为弱酸的酸式酸根(或弱碱阳离子)通过结合水电离的氢离子(或氢氧根),从而促进了水的电离,使水溶液呈现出酸碱性。从能力的层次来看,则需要学生能立足于已有的知识,运用已有的化学理论知识(如电解质的电离、离子反应、水的电离平衡等),推断分析盐类的水解微观过程,建立起认知模型,提炼水解反应的一般规律,为下节课学习水解原理应用垫定基础。从价值层面来看,盐类的水解体系是一个多种平衡体系相互影响、相互制约的复杂平衡体系,深入理解这种多平衡体系,对开阔学生的思路,形成自然界中物质密切联系、相互依存的世界观,具有一定的促进作用。
2 学情分析
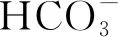
3 教学目标的确定
根据教学内容和学生知识水平的分析情况,从宏观证据、微观证据、定量证据和模型证据四个维度,确定本节课的教学目标。
(1)通过观察、分析盐类水解的宏观现象,认识水解反应的宏观性质,如盐溶液呈现酸碱性的本质原因。
(2)通过讨论、分析微观粒子的相互作用的方式,探求水解的原理,推理水解酸碱性与盐类组成关系的模型。
(3)收集、分析盐类水解实验呈现的数据,从定量角度探求盐类水解反应的特点。
(4)比较、探讨中和反应和盐类水解反应的能量变化,推断水解反应的能量变化规律。
4 教学环节设计
4.1 环节一:实验探究,推导原理
实验并投影:用pH试纸测以下溶液(均约为1 mol/L)的pH值:①NaCl溶液、②CH3COONa溶液、③NaHCO3溶液、④Na2CO3溶液、⑤NH4Cl溶液、⑥(NH4)2SO4溶液、⑦Na2SO4溶液。
设计说明:在学生的认知中,酸溶液呈酸性,碱溶液呈碱性,盐溶液则是中性的。虽然在必修1中学过纯碱和碳酸氢钠两种溶于水呈碱性的盐,但学生还是很难打破思维的惯性,甚至常常将纯碱当作碱对待。上课之前,布置学生先预习。以实验的形式引入新课,选择不同类型的盐,呈现不同的pH值,让学生能通过宏观的物质性质了解盐类水解的现象。
微观探析:为什么盐溶液会呈现不同的酸碱性呢?以NaCl溶液和CH3COONa溶液为例:①在NaCl溶液中,NaCl完全电离成Na+和Cl-,而水也会部分电离出H+和OH-,离子之间不会发生离子反应(简单复习离子反应的条件),水的电离平衡没有移动,溶液的pH没有发生变化;②在CH3COONa溶液中,CH3COONa完全电离成Na+和CH3COO-,而水也会部分电离成H+和OH-,CH3COO-和H+可生成CH3COOH(简单复习弱电解质电离平衡),c(H+)降低,促进水的电离,c(H+)小于c(OH-),溶液呈碱性。
证据推理一:结合另外5种盐溶液,可知弱碱阳离子或弱酸酸根离子能促进水的电离,发生水解反应。得出结论一:有弱才水解。
4.2 环节二:宏观辨识,推导规律
教学活动:引导学生分析上述实验中7种溶液的酸碱性与盐类型的关系。
设计说明:学生通过实验结果,了解盐类水解可呈现不同pH值的现象,通过对水电离平衡移动的分析,认识水解反应的本质,此时对盐的组成结构进行分类,进一步深化学生对“结构-性质”关系的认识,建立水解的认知模型。
证据推理二:强酸弱碱盐显酸性,强碱弱酸盐显碱性。得出结论二:谁强显谁性。
证据推理三:电解质的“强”与“弱”本质上是指电解质的电离程度,可用什么数据来衡量呢(提示:电离常数)?结合NaCl溶液和Na2SO4溶液,推测CH3COONH4溶液应该显什么性质呢(醋酸和一水合氨的电离常数均为1.8×10-5)?经讨论,可得出结论三:同强显中性。
4.3 环节三:引入数据,定量推理
教学活动:和学生一起利用比色卡,读取各种溶液的pH数值(按上述序号,颜色有争议时,取大概范围):①6~7、②8~9、③10、④11~12、⑤5~6、⑥5~6、⑦7。
设计说明:从酸碱性的定性认识,进一步从定量的角度认识盐类的水解,发展学生的定量思维。
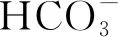

证据推理四:基于CH3COONa溶液、NaHCO3溶液、Na2CO3溶液的碱性依次增强的本质,得出结论四:越弱越水解。
4.4 环节四:符号表征,推导模型
教学活动:和学生一起书写CH3COONa溶液中产生OH-的离子方程式(水解方程式)。
设计说明:基于宏观和微观的认知,引入符号表征水解过程。预习发现,学生会写成CH3COO-与H+反应,借此重温了离子方程式的书写要点——弱电解质不能拆写。
证据推理五:结合水解方程式,讨论下列问题:①在约为1 mol/L的CH3COONa溶液中,c(OH-)约为多少?根据上面的数据算出约为1×10-5mol/L。②根据上面的实验数据,哪种物质的水解程度最大?可算出是碳酸钠,约为1%。
根据上面的讨论,可得出结论五:水解程度一般都比较小。该结论可为后续学习判断溶液中离子浓度大小作铺垫。
证据推理六:结合水解方程式,讨论下列问题:①从左边往右看,是水解反应,但如果从右边往左边看,是什么反应呢(可得出是中和反应);②中和反应是放热反应,那么其逆反应——盐类的水解反应呢?
通过上述问题的讨论,可得出结论六:水解反应是中和反应的逆反应,是吸热反应。
5 结语
随着化学知识的积累和能力的提升,学生思考问题的视角越来越广,而对化学实验来说,能挖掘的教学功能也越来越多。学生学习了化学反应原理之后,能从定性到定量、从宏观到微观、从物质到能量等多个角度认识物质的变化,因此应该养成深挖化学实验功能的习惯,用多元化的视角认识化学现象,更深刻地认识自然界的复杂性和整体性。本节课是以演示实验展开教学,虽然有利于笔者控制课堂的节奏,也有利于证据推理过程的进行。但笔者认为,如果学生能养成良好的实验探究习惯,应该多动手实验,减少演示实验,让学生亲自探索化学世界。
从证据推理的角度来看,限于学生知识与能力的水平,对于一些假设学生并不能自主地完成推理过程,这时就要发挥教师的作用,要适当给学生提供知识的支撑,帮助学生构建完善的知识体系,让学生能顺着知识的阶梯一步一步往上攀登。因此,引导学生进行证据推理,不是漫无目的地让学生自由讨论,也不是让学生完全独立探索,而应是有目的、有设计、有方向的活动。基于证据推理所得出的结论,是学生经过思考、辨析、论证所得到的本质规律,对学生来说,能起到化繁为简、认知本质的作用,但却不能轻易地作为结论传授给其他未经历推理过程的学生,因为只知道结论,则为“知其然,不知所以然”。
化学是一门不断发展的自然科学,化学实验技术也在与时俱进。在本节课中,因限于实验的条件,在定量测溶液的pH值时,依然用pH试纸进行测定。但由于pH试纸的测定,准确性比较低,而且读数的时候,也有一定的难度,像本节课中有些溶液的读数只是取大概读数范围,如果能用pH计进行测量,则可大大提高准确性。在进行定量分析时,也更有说服力,能更好地发挥数据的“证据”作用。同时,也能让学生感受到化学技术在定量测量中所起的重要作用,激发学生学习化学的兴趣。
