碧螺春多糖的超声辅助酶提取工艺优化、分离纯化及性质分析
2021-09-02陈香玉李旭娇寇宇星张俊爱
刘 鑫,陈香玉,郭 锐,李旭娇,寇宇星,张俊爱,吴 艳,
(1.上海交通大学农业与生物学院,上海食品安全工程技术研究中心,上海 200240;2.北京市农林科学院农业信息与经济研究所,北京 100097)
茶叶起源于中国,是世界上消费量第二的饮料,主要分为绿茶、红茶、乌龙茶、黑茶和白茶等[1]。碧螺春是绿茶的一种,历史悠久,主要产于江苏、浙江等地,按采摘时间可分为明前碧螺春和明后碧螺春。明前碧螺春芽叶幼嫩、清香袭人、口味凉甜,销往全国可以带来极好的经济效益,而明后碧螺春受温度影响茶叶变老、口味苦涩,经济效益不佳且仍需一定人工采摘成本[2],更适合副产品加工和功能成分的研究。
茶多糖因具有降血糖血脂、抗肿瘤、抗氧化、增强免疫、调节肠道菌群等生物活性而备受研究者关注[3−5]。茶多糖的提取方法主要包括热水提取、超声提取、微波提取、酶法提取等,而不同提取方法不仅影响多糖得率,也会通过影响多糖的单糖组成、糖醛酸含量及相对分子质量大小等影响多糖生物活性的表现[6−8]。已有研究表明清明后绿茶中多糖含量更高[9],Liao等[10]通过研究比较了热水提取、超声提取和酶法提取生姜多糖的结构差异,发现超声提取和酶法提取的生姜多糖相对分子质量更低,而且在多糖链组成中比热水提取多一种单糖(1,6-β-半乳糖),这些结构差异可能带来更好抗肿瘤活性等。Wei等[11]发现酶法提取的茶多糖蛋白质或核酸的含量低,吡喃糖含量较高。Chen等[12]比较了热水提取、酶法提取、超声提取和超声-酶法提取的共聚草多糖,发现超声-酶法提取共聚草多糖得率最高,且化学组成中糖醛酸含量最高,相对分子质量最小,抗氧化活性最佳。
目前对茶多糖研究报道中,在绿茶中对龙井、毛尖等品种研究较多,而针对碧螺春多糖(BTP)的提取、纯化及结构研究等尚缺少系统研究。酶法能有效破除细胞壁,超声辅助酶法提取能有效提高茶多糖浸出率,且所得多糖可能具有低相对分子质量、高糖醛酸含量等生物活性较高的多糖结构。本文主要研究超声辅助酶法提取的最优工艺参数和分离纯化方法,对碧螺春多糖进行化学组成、紫外光谱、红外光谱、相对分子质量等分析,为其进一步研究开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
碧螺春 上海满堂春茶叶市场,产地江苏苏州;纤维素酶(50 U/mg)、果胶酶(500 U/mg) 上海源叶生物科技有限公司;DEAE-Sepharose、Sepharose CL-6B GE公司;乙醇、浓硫酸、葡萄糖、苯酚、间羟基联苯等 分析纯,国药集团化学试剂有限公司。
FE20型p H计 梅特勒-托利多仪器(上海)有限公司;R206B型旋转蒸发仪 上海申生科技有限公司;TD5A-WS型台式低速离心机 湖南湘仪实验室仪器开发有限公司;U1810型紫外可见分光光度计 北京普析通用仪器有限责任公司;Nicolet6700型傅里叶红外光谱仪 苏州佐藤精密仪器有限公司;THC型数控超声波提取机 济宁天华超声电子仪器有限公司;VFD-2000型真空冷冻干燥机 上海比朗仪器有限公司;HWS24型电热恒温水浴锅 上海恒科学仪器有限公司;BSZ-100型自动收集器 上海沪西仪器分析厂;BT100FC型蠕动泵 保定创锐泵业;TH500型梯度混合仪 上海沪西仪器分析厂。
1.2 实验方法
1.2.1 碧螺春茶多糖的提取工艺
1.2.1.1 碧螺春茶叶的预处理 取碧螺春茶叶,粉碎过筛,加入8~10倍体积(v/v)石油醚,浸泡并搅拌,脱去脂肪类杂质,12 h更换石油醚1次,24 h后倒掉石油醚,加入8~10倍体积(v/v)95%乙醇溶液,浸泡并搅拌,充分除去小分子物质、色素及低聚糖等物质,每6 h更换一次乙醇,浸泡3~4 d,直到乙醇基本无色,抽滤、50℃烘干,得到预处理的碧螺春茶叶粉末。
1.2.1.2 多糖的制备 酶解处理条件参考酶法提取绿茶多糖的优化工艺[13],称取5 g预处理后的碧螺春茶叶粉末,按液料比30 mL/g加入去离子水,0.2 mol/L磷酸缓冲液调节p H至4.8,加入2.4%复合酶(纤维素酶:果胶酶=1:1),45℃酶解2 h,3800 r/min离心10 min,滤渣加入去离子水依照不同的超声功率、超声温度、液料比与超声时间进行超声波二次提取,3800 r/min离心10 min,弃去滤渣,合并两次的上清液,旋转蒸发浓缩至原体积的1/5,浓缩液加4倍体积(v/v)的95%(v/v)乙醇溶液,4℃静置12 h,多糖沉淀析出,离心,沉淀分别利用丙酮、无水乙醇冲洗三次,挥干有机试剂后,加水复溶,9000 r/min离心30 min,取上清液,等电点法除蛋白,14 kDa透析袋透析除去小分子杂质,冷冻干燥得到碧螺春多糖粉末,命名为BTP。
1.2.2 单因素实验 本文研究超声波功率、超声温度、液料比以及超声时间对酶法联合超声提取BTP得率的影响。固定实验参数超声功率200 W,超声温度45℃,液料比40 mL/g,超声时间35 min,分别考察超声功率(160、200、240、280、320 W),温度(35、45、55、65、75℃),超声时间(15、25、35、45、55 min),液料比(20:1、30:1、40:1、50:1、60:1 mL/g)对酶法联合超声提取碧螺春茶多糖得率的影响。
1.2.3 碧螺春多糖的响应面试验设计 基于单因素实验结果,设定自变量为超声功率(A,W)、超声温度(B,℃)、液料比(C,mL/g)与超声时间(D,min),响应值为BTP得率(%,w/w),利用Design expert 8软件设定4因素3水平BBD响应面组合实验,以此优化BTP的超声波辅助提取工艺参数。具体实验因素水平如表1所示。

表1 响应面试验因素与水平设计Table 1 Factors and levels in RSM experiment
1.2.4 碧螺春茶多糖得率计算 采用苯酚-硫酸法[14]测定BTP中的总糖含量,即以葡萄糖标准溶液绘制标准曲线,再计算BTP提取液中的总糖含量,从而按照以下公式计算BTP得率:

式中:C为多糖浓度(mg/mL);V为提取液体积(mL);n为提取液稀释倍数;m为称取的碧螺春茶叶粉末质量(g)。
1.2.5 DEAE-Sepharose阴离子交换柱层析 BTP溶液(10 mg/mL,100 mg)经DEAE-Sepharose (D2.6 cm×30 cm)阴离子交换柱层析,依次采用去离子水、0~1.4 mol/L NaCl溶液洗脱,洗脱速度为2 mL/min,每管收集6 mL,隔管测定中性糖含量(苯酚-硫酸法A490nm),糖醛酸含量(间羟基联苯法A525nm)和蛋白质含量(紫外扫描法A280nm)[15]。分别收集获得组分BTPN、BTPA1和BTPA2,透析3 d,冷冻干燥。
1.2.6 Sepharose CL-6B凝胶柱层析BTPA1溶液(20 mg/mL,100 mg)经Sepharose CL-6B(D1.6 cm×100 cm)凝胶柱层析,采用0.15 mol/L NaCl溶液洗脱,洗脱速度为0.2 mL/min,每管收集2 mL,隔管测定中性糖含量(苯酚硫酸法A490nm)蛋白质含量(紫外扫描法A280nm)[15]。分别收集获得组分BTPA11和BTPA12,透析2 d,冷冻干燥。
1.2.7 基本化学组成测定 以葡萄糖为标准品,采用苯酚-硫酸法[14]测定中性糖含量,以半乳糖醛酸为标准品,采用间羟基联苯法[16]测定酸性糖含量,间羟基联苯法在测定中受中性糖影响较低[17];在以牛血清蛋白为标准品,采用考马斯亮蓝法[18]测定可溶性蛋白质含量。
1.2.8 紫外光谱测定 分别取BTP、BTPA1、BTPA11和BTPA 12,配制浓度为0.2 mg/mL的多糖溶液,进行紫外光谱扫描,波长范围为:190~400 nm。
1.2.9 红外光谱测定 分别取BTP、BTPA1、BTPA11及BTPA12粉末各2 mg,进行ATR红外光谱分析,将样品直接置于水平ATR仪锗晶体表面上,盖住锗晶体(直径2 mm),压平,设置扫描范围4000~400 cm−1,扫描时间为1 min。
1.2.10 相对分子质量测定 采用高效体积排阻色谱法(HPSEC),分别取5 mg BTP、BTPA1、BTPA11及BTPA 12样品,加入1 mL流动相(0.15 mol/L NaNO3+0.05 mol/L NaH2PO4·2H2O,pH=7),并充分溶解,用0.45μm水相微孔膜过滤后上样[19]。
HPSEC测定条件[19]:检测器采用多角度激光光散射检测器(光源波长选用623.8 nm)、示差折光检测器串联使用,多糖在溶液中的折光指数增量(dn/dc)按照0.146 mL/g 计算。色谱柱为TSK PWXL6000和TSK PWXL3000凝胶色谱柱串联;流速:0.5 mL/min,柱温35℃;60 min洗脱时间;数据采集及分析软件为ASTRA 7.1.3。
1.3 数据处理
实验均重复三次,响应面实验数据由Designexpert8处理,相对分子质量、多分散系数和构型斜率由ASTRA 7.1.3计算,其余数据均由Origin 2017处理。
2 结果与分析
2.1 单因素实验
由图1-a可知,当超声功率在160~200 W时,碧螺春多糖的得率随超声功率增加而增加,功率为200 W时碧螺春多糖得率达到最大值26.84%。这可能是因为超声振动产生的能量破坏了细胞壁并加强了分子间的运动[20],促进多糖溶于溶剂中,从而提高碧螺春多糖得率。超过200 W时碧螺春多糖得率开始下降,这可能是超声波的气穴效应和热效应导致多糖结构破坏[21]。由图1-b可知,当超声功率在35~45℃时,碧螺春多糖得率随超声温度增加而增加,温度为45℃时得率达到最大值26.18%,这可能由于温度升高提高了多糖的溶解度,这将有利于多糖不断溶出。超过45℃时,碧螺春多糖得率开始下降,这可能是因为温度升高导致超声的空化效应减弱。随着温度升高,溶液的黏度下降,超声波空化效应产生的微射流与溶液之间压力减小,导致超声效应减弱[22]。由图1-c可知,超声时间在15~35 min时,碧螺春多糖得率随超声时间增加而明显提高,这可能是因为超声能破坏细胞壁促进多糖溶出,随着时间的增加细胞壁逐渐分解,多糖充分溶出,超声时间为35 min时碧螺春多糖得率达到最大值24.78%,但超声时间超过35 min后,碧螺春多糖得率开始下降,这可能是因为长时间萃取导致多糖降解[23]。由图1-d可知,液料比在20:1~60:1 mL/g时,碧螺春多糖得率随料液比增加而增加,这可能是因为增加溶剂能够促进多糖释放和溶解,液料比超过40:1 mL/g后得率增加缓慢,大部分多糖已溶出,液料比为40:1、50:1、60:1 mL/g时,碧螺春多糖得率分别为27.79%、28.45%和28.67%,但溶剂体积越大,浓缩成本越高。故选择响应面试验中心点参数为200 W、45℃、35 min和40:1 mL/g。

图1 单因素对BTP得率的影响Fig.1 Single factor influence on BTP yield
2.2 响应面试验
根据响应面设计试验,得到各因素各水平下BTP得率,如表2所示。整个响应面设计由29个试验组组成,在设计的中心进行了5次重复,以估计纯误差平方和[24]。试验以随机的方式进行,使响应面设计中未预测到的变量对试验产生的影响最小[25]。

表2 超声辅助酶提BTP得率的响应面设计与结果Table 2 Response surface design and results of ultrasound assisted enzyme extraction of BTPyield
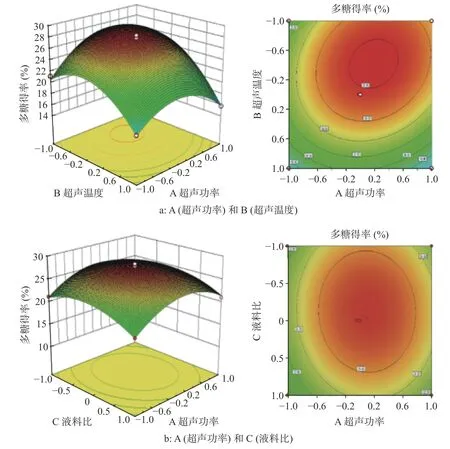
通过Design-Expert 8.0数据处理,碧螺春多糖得率与4个变量的多元回归方程如下:Y=27.68+0.86A+3.23B+0.67C+2.56D+1.41AB−0.19AC−0.94AD+0.42BC+2.12BD+1.32CD−3.90A2−4.15B2−2.67C2−5.83D2。由表3可知,模型F值较高(F=108.95),P值极低(P<0.01),表明此模型极为显著。且A、B、C、D各因素与响应值之间有着极为显著的相关性(P<0.01)。AB、AD、BD和CD的P值小于0.01,表明此四项交互项对得率有极显著的影响。根据F值判断,4项因素对BTP得率的影响程度从大到小排序为:B(超声温度)>D(超声时间)>A(超声功率)>C(液料比)。失拟项的P值为0.2444,失拟项不显著,故回归模型可用于碧螺春多糖提取工艺的预测。

表3 响应面方差分析Table 3 ANOVA for response surface quadratic model
响应面等高线图可直观表征各因素对响应值的影响,并确定最优参数及各因素之间的相互作用,其中最小椭圆中心点即为响应面的最高点。此外,等高线形状的椭圆化程度与两因素交互作用的显著程度呈正相关[16]。若3D响应曲面的坡度越陡、等高线越密且椭圆形程度越高,则说明两因素交互作用对结果的影响越显著;若坡度越缓、等高线越稀疏且圆形程度越高,则说明两因素交互作用对结果的影响越小。从图2中可看出,AB、AD、BD和CD四组3D响应曲面图表现为曲线较陡,即超声功率与温度、超声功率与时间、超声温度与时间、液料比与时间的相互作用对碧螺春多糖提取得率的影响最为显著。

图2 两因素交互作用影响BTP得率的响应面及等高线图Fig.2 Response surfaceand contour map of the interaction between two factorsaffecting BTPyield
2.3 最佳提取工艺参数确认与验证
根据多元回归方程,利用模型预测酶法联合超声提取BTP最优参数为:超声功率206.28 W,超声温度47.56℃,料液比41.21:1 mL/g,超声时间38.27 min,由此参数得到的BTP得率的理论值为28.32%。考虑到实际可操作性,最终选取的最优提取参数为:超声功率200 W,超声温度45℃,料液比40:1 mL/g,超声时间35 min,在此优化条件下,经3次平行实验得到的BTP得率为26.74%±1.83%。这表明此回归方程能准确反映以上4项因素对BTP提取得率的影响,同时经响应面法优化的超声辅助酶法提取参数具有实际应用价值,可用于碧螺春茶多糖的实际提取。
2.4 DEAE-Sepharose阴离子交换柱层析
由于中性糖和酸性糖所带电荷基团性质的不同,在阴离子交换柱层析中被不同洗脱液分离。如图3所示,BTP经DEAE-Sepharose阴离子柱层析分离获得由去离子水洗脱的中性糖组分BTPN,得率为3.98%;由0~1.4 mol/L NaCl溶液洗脱收集获得BTPA 1和BTPA2,得率为61.91%和5.71%,三个组分总得率为71.60%。BTP中的主要成分为酸性多糖BTPA 1,故对BTPA1进行下一步分离纯化。Cai等[1]在绿茶多糖的DEAE-Sepharose纯化中分离得到4个组分,包括3个酸性多糖成分,Wang等[26]在绿茶茶籽多糖纯化中含量最高为中性多糖,表明茶多糖的组分与不同的纯化条件以及茶叶部位等有关。

图3 BTP的DEAE-Sepharose柱层析洗脱曲线Fig.3 DEAE-Sepharose column chromatography elution curve of BTP
2.5 Sepharose CL-6B凝胶柱层析
多糖根据相对分子质量大小不同经Sepharose CL-6B洗脱分离可得到不同组分,如图4所示,BTPA 1经Sepharose CL-6B分离获得BTPA11和BTPA 12,得率为28.36%和42.29%,表明BTPA1由两个不同分子质量的组分组成,且两者含量接近,故对BTPA 11和BTPA 12同时进行研究。
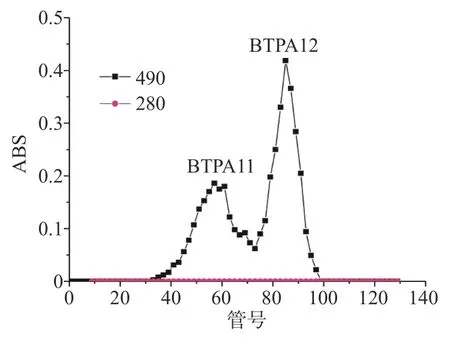
图4 BTPA1的Sepharose CL-6B柱层析洗脱曲线Fig.4 Sepharose CL-6B column chromatography elution curveof BTPA1
2.6 基本化学组成
如表4所示,BTP、BTPA 1、BTPA 11和BTPA 12中性糖的含量分别为59.39%、66.86%、77.43%和62.61%,与Wang等[26]测得绿茶粗多糖含量为41.08%~41.72%相比,表明纯化方法有效提高了BTPA 1、BTPA11及BTPA12纯度。另外,BTP、BTPA 1、BTPA 11和BTPA12中糖醛酸含量分别为51.06%、53.53%、54.45%和65.39%,而Chen等[27]测得3种热水提取酸性绿茶多糖的糖醛酸含量在30%~51.8%,糖醛酸含量的差别可能与提取工艺有关。与热水提取相比,超声辅助酶法提取多糖的酸性多糖含量将会更高[28]。在BTPA 1和BTPA 12中未检出蛋白质,而BTPA11蛋白质为3.65%,表明BTPA11组分的多糖结构含有少量结合蛋白质。
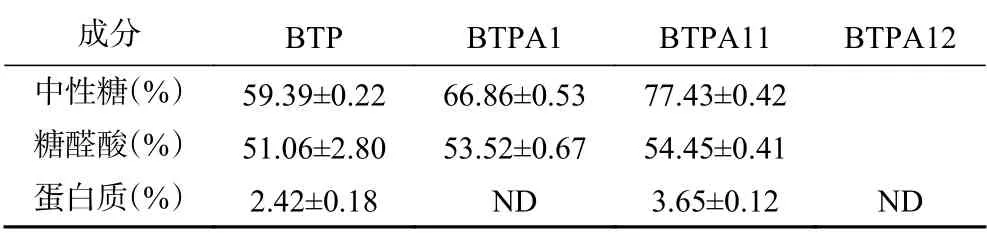
表4 BTP、BTPA1、BTPA11和BTPA12的化学成分Table 4 Chemical composition of BTP、BTPA1、BTPA11 and BTPA12
2.7 紫外光谱分析
由图5可知,BTP、BTPA 1、BTPA 11和BTPA 12均在190~200 nm左右处有多糖的吸收特征峰[29],BTPA 12在260 nm处有肩峰,表明BTPA12中含有极少量核酸物质,BTP和BTPA 1在280 nm均出现微弱吸收峰,表明BTP和BTPA1中含量少量蛋白质,BTPA11中既无核酸也无蛋白质。Cai等[1]由0.5 mol/L NaCl溶液在阴离子柱层析中分离的酸性绿茶多糖TPS-4中也含有核酸物质,表明绿茶酸性多糖中可能会含有少量聚合核酸或结合蛋白。
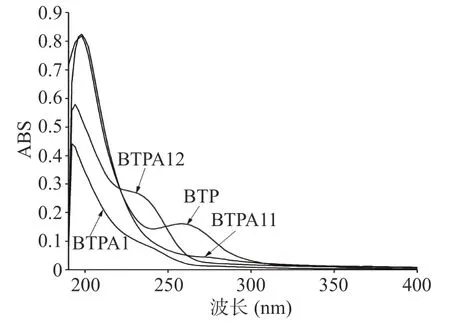
图5 BTP、BTPA1、BTPA11和BTPA12的紫外吸收光谱Fig.5 UV spectra of BTP、BTPA1、BTPA11 and BTPA12
2.8 红外光谱分析
根据图6红外光谱分析,BTP、BTPA1、BTPA 11和BTPA 12出峰位置基本一致,键的强弱稍有差别。在3360 cm−1处均有较宽的O-H键的拉伸振动吸收峰,在2942 cm−1处均有较弱的C-H键吸收峰(包括CH、CH2和CH3,主要为饱和碳)[1],表明BTP、BTPA1、BTPA 11和BTPA12均含有多糖的特征峰。1742 cm−1和1600 cm−1处为C=O键的拉伸振动的吸收特征峰[5,30],这表明四种碧螺春多糖组分均含有糖醛酸的羧基结构,这与化学成分测定结果一致。红外吸收光谱在在1000~1200 cm−1的区域产生强烈的波段,该区域通常被认为是分子的指纹,因为它可以识别多糖中的主要化学基团[31]。1097 cm−1和1016 cm−1处代表C-OH侧基和C-O-C糖苷键拉伸振动,代表BTP、BTPA 1、BTPA11和BTPA 12中均含有吡喃糖[32]。
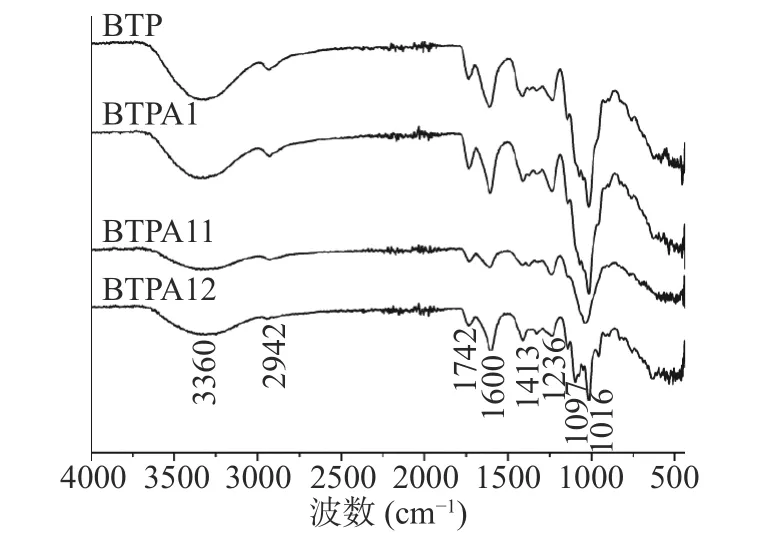
图6 BTP、BTPA1、BTPA11和BTPA12的红外吸收光谱Fig.6 Infrared absorption spectrum of BTP、BTPA1、BTPA11 and BTPA12
2.9 相对分子质量测定
由图7可得,BTP和BTPA 1包含两个组分。纯化后的BTPA11和BTPA12只有单一对称峰,表明BTPA 11和BTPA 12为相对分子质量分布均一多糖,且相对分子质量分布较窄,其重均分子量Mw分别为1604.2和353.7 kDa,PDI分别为1.6和1.8(表5),说明相对分子质量分布比较集中,纯度较高,这将有利于对碧螺春多糖展开精细结构研究。
表5 BTP、BTPA1、BTPA11和BTPA12的相对分子质量Table 5 Relative molecular mass of BTP、BTPA1、BTPA11 and BTPA12

图7 BTP、BTPA1、BTPA11和BTPA12的HPSEC谱图Fig.7 HPSEC spectra of BTP、BTPA1、BTPA11 and BTPA12
构型斜率,也叫均方根旋转半径对摩尔质量斜率,是均方根半径的对数对摩尔质量拟合的直线求斜率所得。当斜率为1时,表示高分子在溶液中是棒状排列,当斜率为0.4~0.6时则表示高分子在溶液中呈线性无规则线团,斜率小于0.33时则表示为球状形态。由图8可知,BTPA11的构型斜率为0.12,均方根半径的对数对摩尔质量曲线呈U型,直线拟合度较差,推测BTPA11可能为高支化的球形构象,因为对于相同相对分子质量的多糖线形与支化分子,支化分子的旋转半径要更大,从而造成曲线弯折成U型,这是高支化结构聚合物在高流速洗脱时的典型特征[33−34]。由图9可知,BTPA 12的构型斜率为0.15,直线拟合度较好,BTA 12可能趋向于球形结构。Lin等[35]测定了绿茶酸性多糖是一种具有极紧凑链构象的超支化多糖,多糖的超支化结构特点可以与淀粉竞争结合位点,达到抑制α-淀粉酶作用,BTPA 11、BTPA 12可能具有超支化多糖的功能特性。

图8 BTPA11旋转半径分布图Fig.8 BTPA11 rotation radius distribution map
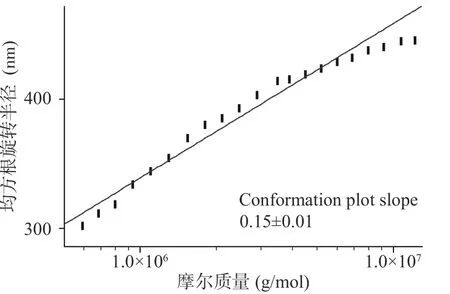
图9 BTPA12旋转半径分布图Fig.9 BTPA12 rotation radius distribution map
3 结论
本研究以碧螺春粗老茶叶为研究对象,采取超声辅助酶法提取粗多糖BTP,在最优条件下得率为26.74%。研究发现,碧螺春茶多糖酸性糖成分含量明显高于中性糖,并分离到两种酸性多糖组分BTPA 11和BTPA12。BTPA11和BTPA12相对分子质量分布较窄,均一性良好,其相对分子质量分别为1604.2和353.7 kDa,可以用于碧螺春多糖的精细结构研究;构型斜率分别为0.12和0.15,二者均可能是紧凑卷曲的高支化球形结构,可能具有支化多糖的功能特性。这为进一步研究碧螺春多糖结构及功能特性提供了重要参考,有利于碧螺春粗老茶的综合开发应用。
