SPME-GC-MS与电子鼻结合分析不同酵母混菌发酵猕猴桃酒的挥发性香气物质
2021-09-02王铁儒王冰宜魏新元樊明涛
王铁儒,郭 丽,马 曼,王冰宜,魏新元,樊明涛
(西北农林科技大学食品科学与工程学院,陕西杨凌 712100)
猕猴桃富含VC、VB、VE等维生素和精氨酸、谷氨酸等氨基酸[1],具有很高的营养价值。中国猕猴桃资源丰富,种植广泛、产量大。陕西省是我国猕猴桃生产第一大省,猕猴桃也是陕西省的优势农业产业[2]。猕猴桃鲜果上市时间集中,贮藏成本高,易腐烂[3],因此加快加强其深加工产品研发有重要意义。猕猴桃酒的附加值高[4],开展猕猴桃酒的研发可以解决一定范围内猕猴桃的滞销腐败问题,对产业发展具有极大的推动作用。
猕猴桃酒营养丰富,有较强抗氧化功能,但仍存在挥发性香气含量不足、特征不典型的问题[4]。酵母的选择对酒体风味物质有重要影响,而目前应用于猕猴桃酒生产的酵母菌株多为葡萄酒酿酒酵母[5],因此仍需不断探索猕猴桃酒酿造专用酵母。研究发现,相比酿酒酵母,非酿酒酵母可产生丰富的利于水解香气前体物质的糖苷酶[6],同时,非酿酒酵母的某些代谢产物(如甘油、酯类等)能增加果酒独特风味[7−8],对其感官品质有积极的影响。研究发现,不同酵母混合发酵的葡萄酒香气成分组成及含量不同[9],例如,戴尔有孢圆酵母与酿酒酵母混合发酵葡萄酒,提升了酒体酯类的含量,增强了果香风味[10];与单一酿酒酵母发酵相比,异常毕赤酵母与酿酒酵母混合发酵显著提高了葡萄酒中乙酸酯类的含量[11];毕赤克鲁维酵母混合发酵酒样中挥发酸含量降低,高级醇和酯类物质含量显著提高[12]。目前,混菌发酵多应用于葡萄酒中,关于不同非酿酒酵母与酿酒酵母混菌酿造猕猴桃酒中的香气成分差异相关的研究鲜有报道。
香气特征是评价猕猴桃果实及其果酒品质的重要指标之一,其影响着猕猴桃果酒的品质和市场接受度[13]。固相微萃取-气相色谱-质谱联用(solid phase microextraction-gas chromatography-mass spectrometry,SPME-GC-MS)是研究果酒中挥发性香气成分的主要方法。GC用于含复杂挥发性成分物质的分离和分析,适用于定量分析;MS灵敏性高、定性强,适用于定性分析[14]。电子鼻也是一种常用的香气检测技术,它由特异性电子化学传感器组成[15]。与其他技术相比,电子鼻无损、简单、快速,并能提供足够的数据来建立模式识别系统,应用于食品的鉴定和分析[16]。在香气检测研究方面,电子鼻可提供被测样品的整体气味信息,而GC-MS提供了样品具体香气化学成分。
因此,本研究利用三种不同非酿酒酵母(戴尔有孢圆酵母、耐热克鲁维酵母、发酵毕赤酵母)分别与酿酒酵母混合发酵猕猴桃酒,以这四种菌的单菌种发酵作为对照组,采用SPME-GC-MS和电子鼻技术结合的方法检测其挥发性香气物质,并进行香气感官评定。通过主成分分析(principal component analysis,PCA)探索不同非酿酒酵母酿造猕猴桃酒香气特征的差异,利用偏最小二乘回归分析(partial least square,PLS)探究GC-MS与电子鼻结合分析的拟合模型的准确性,旨在为适宜混菌酿造猕猴桃酒的非酿酒酵母菌株的选择、酒体香气的改善及快速检测提供一定的参考依据。
1 材料与方法
1.1 材料与仪器
徐香猕猴桃 陕西省杨凌农贸市场;酿酒酵母(Saccharomyces cerevisiae,S.cerevisiae)菌 株WLP775西北农林科技大学食品学院;戴尔有孢圆酵母(Torulaspora delbrueckii,T. delbrueckii)菌株A25、耐热克鲁维酵母(Kluyveromyces thermotolerans,K.thermotolerans)菌株R69、发酵毕赤酵母(Pichia fermentans,P. fermentans)菌株Z9Y-3西北农林科技大学葡萄酒学院;YEPD培养基:葡萄糖、酵母浸出粉、蛋白胨、琼脂粉、果胶酶(Macerozyme R-10)北京索莱宝科技有限公司; 2-辛醇(纯度≥98%)上海麦克林生化科技有限公司。
DH-600电热恒温培养箱 北京科伟永兴仪器有限公司;HC-3018R高速冷冻离心机 安徽中科中佳科学仪器有限公司;ZHWY-2102恒温振荡器 上海智诚分析仪器制造有限公司;2000JP离心果汁机南通金橙机械有限公司;GCMS-QP2010 Ultra气相色谱质谱联用仪 日本岛津公司;手动固相微萃取(50/30μm DVB/CAR/SPME)进样器 美国Supelco公司;DB-17MS毛细管柱(60 m×250μm,0.25μm)美国Agilent公司;PEN3型便携式电子鼻 德国Airsense公司。
1.2 实验方法
1.2.1 菌种活化与培养 酵母菌株在YEPD固体培养基28℃培养48 h进行活化。挑取单菌落接种至YEPD液态培养基,28℃、180 r/min振荡培养18 h制成种子液。
1.2.2 猕猴桃酒酿造工艺流程 猕猴桃→分选清洗→破碎榨汁→装罐(60 mg/L SO2、50 mg/L果胶酶)→接入酵母→酒精发酵→倒罐→自然陈酿→澄清过滤→成品酒
1.2.3 操作要点
1.2.3.1 猕猴桃果实原料处理 选择成熟度较好(软硬适中),无腐烂发霉的猕猴桃,利用榨汁机带皮打浆,打浆后的果汁中加入60 mg/L SO2和50 mg/L果胶酶,处理24 h后接入活化后的酵母进行酒精发酵。
1.2.3.2 酒精发酵 酵母接种方式分为:单一接种和混合接种,具体接种量、方式及样品编号如下。
单一接种发酵的接种量为2×106CFU/mL,分别为编号WLP:只接种酿酒酵母WLP775;编号A25:只接种戴尔有孢圆酵母A25;编号R69:只接种耐热克鲁维酵母R69;编号Z9Y:只接种发酵毕赤酵母Z9Y-3。
混合接种发酵:先以1×106CFU/mL的接种量加入非酿酒酵母,发酵48 h后再接种1×106CFU/mL酿酒酵母WLP775,分别为编号A25D2:先接种戴尔有孢圆酵母A25发酵48 h后,再接种酿酒酵母WLP775;编号R69D2:先接种耐热克鲁维酵母R69发酵48 h后,再接种酿酒酵母WLP775;编号Z9YD2:先接种发酵毕赤酵母Z9Y-3发酵48 h后,再接种酿酒酵母WLP775。每种处理设置3个平行。猕猴桃汁分装于2.5 L玻璃发酵罐中,发酵温度18~20℃,静置发酵7~9 d,待酒样可溶性固形物含量连续3 d不变、还原糖含量降至6 g/L以下后结束主发酵。
1.2.3.3 陈酿 酒精发酵结束后,取出部分酒样进行香气检测。进行倒罐澄清并陈酿,倒罐时添加SO2以抑制发酵。
1.2.4 SPME-GC-MC测定香气成分 SPME条件:添加1 g NaCl于15 mL的固相微萃取专用萃取瓶中,准确吸取各酒样5 mL,添加6μL 2-辛醇(质量浓度为0.45 mg/mL)作为内标,密封后于40℃下平衡15 min,插入已老化的萃取头萃取30 min,搅拌速率300 r/min。萃取结束后将进样器插入顶空瓶中(深度22 mm),在40℃下放置10 min,收集挥发物进行GC-MS分析。
GC-MS条件[17]:进样口温度250℃;离子源温度230℃;连杆温度230℃。升温程序:40℃,保持3 min;以4℃/min升至120℃;以6℃/min升至240℃;保持12 min。分流方式:不分流;载气为氦气(He),体积流量为1.0 mL/min。电子电离(electronic ionization,EI)源,电离电压70 eV,质荷比(m/z)扫描范围35~500 amu。
1.2.5 香气物质的定性定量方法 定性定量:检测出的未知化合物与NIST(national institute of standards and technology)质谱库和Wiley Library相匹配,选择匹配度高的物质作为有效香气成分对比定性。使用内标法进行半定量分析[13],以2-辛醇为内标物,通过比较待测组分与内标物峰面积的比值,校正后计算出待测组分的质量浓度。通过气味活性值(odor active value,OAV)评价挥发性物质对酒的香气感官贡献率,OAV=某香气物质浓度/该物质感觉阈值。
1.2.6 电子鼻检测 PEN3型电子鼻10个金属氧化物传感器的性能描述见表1。样品稀释50倍,量取5 mL置于30 mL专用进样瓶瓶中,加盖密封,室温富集6 min后进行测试。电子鼻检测时间60 s,预进样5 s,清洗时间300 s,进样流量300 mL/min,载气流速300 mL/min[18]。

表1 PEN3电子鼻传感器阵列及其性能描述Table 1 Sensors used in PEN3 electronic nose and their properties
1.2.7 香气特征的感官分析 采用定量描述分析(quantitative descriptive analysis,QDA)方法,具体参照文献方法[19]。由年龄在24~35岁之间的20名经过培训的酿酒专业人员(男女各半)对猕猴桃酒的香气特征进行评价。每一供试酒样重复分析2次。感官实验中,样品被随机编码并随机分配。评价猕猴桃酒香气的5个香气感官属性的描述定义为:花香(玫瑰,紫罗兰,百合等),甜果(桃子,李子,杏等),酸果(苹果,梨等),生青味(草,青豆味),脂肪(奶酪味)。品评员对香气特征强度进行打分:0=无香气特征,1=非常弱,2=弱,3=中等,4=强,5=非常强。
1.3 数据处理
实验均重复3次,数据以平均数±标准差表示。使用SPSS 22.0进行方差分析(analysis of variance,ANOVA),P<0.05表示差异显著。使用GraphPad Prism 6.0软件绘图。使用Minitab 18.0对数据进行主成分分析(principal component analysis,PCA)和偏最小二乘(partial least square,PLS)回归分析,使用逐一剔除法对回归模型进行交叉验证。
2 结果与分析
2.1 SPME-GC-MS测定不同猕猴桃酒中挥发性香气物质
如表2所示,7种猕猴桃酒中共检测出65种挥发性香气物质,包括2种C6化合物、10种高级醇、3种苯乙基类化合物、5种乙酸酯、2种短链脂肪酸乙酯、6种中链脂肪酸乙酯、17种其他酯类、7种脂肪酸、3种萜烯类、1种呋喃物质、2种酚类物质、7种醛酮类物质。其中,9种香气成分的浓度与其嗅觉阈值的比值(OAV)大于1,13种香气成分的OAV为0.1~1。7种猕猴桃酒中含量较高的前三类挥发性香气物质为:高级醇、中链脂肪酸酯、乙酸酯。因此,酯类物质和醇类物质对猕猴桃酒的整体香气贡献较大。

表2 猕猴桃酒中挥发性香气成分测定结果Table 2 Determination results of volatile aroma components in kiwi wines

续表2
WLP酒样检测出52种香气物质,总质量浓度为9618.52μg/L;A25、R69、Z9Y酒样分别检测出56、61、61种,总质量浓度分别为8671.81、8295.67、6967.79μg/L;混菌发酵组A 25D2、R69D2、Z9YD2分别测出57、60、58种,总质量浓度分别为9152.64、9687.96和8583.11μg/L(表3);7种猕猴桃酒检测出47种共有香气物质。不同非酿酒酵母的混合发酵酒样中香气化合物的种类、数量及含量不同,其中,R69D2香气物质含量最高。相比于WLP酒样,非酿酒酵母及其混合发酵组的挥发性物质种类、数量较丰富,包括正丁醇、正戊醇、乙酸异丁酯、丙酸乙酯、乳酸乙酯等。此外,相比于非酿酒酵母单一接种发酵,混合发酵均提高了酒体中香气物质的质量浓度。
2.1.1 猕猴桃酒中醇类物质分析 醇类是发酵酒风味物质的主要来源,多为糖类或氨基酸经酵母代谢产生,在适宜浓度下可以衬托酯香,促进香气协调性[20]。本试验将检测到的醇类物质具体分为高级醇、C6化合物、苯乙基类物质,其中高级醇在各猕猴桃酒中种类最多、含量最高,质量浓度在2676.45~4805.58 μg/L间(表3)。

表3 不同猕猴桃酒挥发性香气成分的种类及含量Table 3 Types and contents of volatile aroma components in different kiwi wines
高级醇是果酒中重要的香气物质,在总量低于300 mg/L时能增加香气的复杂性,赋予酒醇厚感。本研究中7种猕猴桃酒的高级醇含量均在300 mg/L以下。非酿酒酵母单菌发酵酒样的高级醇含量低于酿酒酵母单一发酵,但在混合发酵后均有不同程度的提高,这与王媛等[21]的研究结果一致。与WLP相比,R69D2发酵酒的高级醇含量显著提高(P<0.05),增强了酒体醇厚感。各酒样中含量最高的高级醇为异戊醇,其具有苹果白兰地香气[22],是杂醇油的主要成分。A 25、A 25D2与WLP酒中3-甲硫基丙醇含量高(OAV>0.1),其被报道存在于水果、果酒、白酒中。Gil等[23]研究发现混合发酵酒中3-甲硫基丙醇的含量提高,赋予葡萄酒更强烈的果香。
C6化合物与萜烯类化合物均属于品种香气,其成分主要来源于果皮中香气糖苷前体物质的水解,对果酒的区域典型性起决定性作用[9]。猕猴桃酒中检测到两种C6化合物,分别为正己醇和反-3-己烯-1-醇。R69、R69D2发酵的猕猴桃酒中C6化合物含量显著高于A25、A25D2(P<0.05),说明耐热克鲁维酵母和戴尔有孢圆酵母与酿酒酵母混菌发酵对品种香气的影响有显著差异,这与菌体代谢不同有一定关系。研究表明,发酵毕赤酵母与酿酒酵母混合发酵可提高己醇和(Z)-3-己烯-1-醇等C6化合物的含量[24],本研究同样证实了发酵毕赤酵母在混菌发酵中具有提高己醇含量的作用。
苯乙基类物质赋予果酒花香和果香。猕猴桃酒中的苯乙基类物质主要为苯乙醇,它是莽草酸衍生物,有玫瑰花香和蔷薇香。多项研究表明,混合发酵对苯乙醇的形成有积极影响[19]。本研究发现,不同非酿酒酵母混合发酵对猕猴桃酒中苯乙醇影响不同。其中,A25和A25D2酒样苯乙醇含量显著高于WLP和其他处理组(P<0.05),这可能是戴尔有孢圆酵母的β-葡萄糖苷酶与L-苯丙氨酸的代谢共同作用的结果[25],且不同酵母产生的糖苷酶存在差异。
2.1.2 猕猴桃酒中酯类物质分析 大多数酯类化合物具有水果和甜香味,对果酒香气有积极的影响[26]。本研究7种处理酒样中共检测到乙酸酯、短链脂肪酸乙酯、中链脂肪酸乙酯及其他酯类等共30种酯类物质。其中WLP、A 25、R69、Z9Y分别检出27、27、28、28种酯类化合物,A25D2、R69D2、Z9YD2分别检出26、29、26种。除A25D2酒样外,辛酸乙酯是酯类中浓度最高的物质,其在WLP、R69D2、Z9YD2中分别占香气化合物总量的18.00%、8.83%、10.54%。如表3所示,A 25D2酒样中乙酸酯含量最高,Z9YD2的短链脂肪酸乙酯含量显著高于其他处理组(P<0.05),而WLP酒样中的中链脂肪酸乙酯和其他酯类物质含量较高。因此,不同酵母因其特异的生理活性和代谢过程,对酯类化合物影响不同。
乙酸酯具有草莓味、香蕉味、梨等果香和甜花香味。不同非酿酒酵母混菌发酵对酒样中乙酸酯的生成影响不同。A 25D2酒中乙酸酯质量浓度(2226.0 μg/L)最高,其中乙酸乙酯、乙酸异戊酯、乙酸己酯的含量均显著高于R69D2与Z9YD2(P<0.05),说明三种非酿酒酵母中,戴尔有孢圆酵母在猕猴桃酒中产乙酸酯的能力较强,这可能与酯酶活性有关。2-甲基丁基乙酸酯具有最高的OAV(45.10~120.08),可以为猕猴桃酒带来浓郁的苹果、香蕉香气。此外,部分研究发现发酵毕赤酵母与酿酒酵母混合发酵能提高果酒中乙酸酯的含量[24]。而本研究中发酵毕赤酵母对乙酸酯的提高作用不显著,这可能因为猕猴桃酒发酵体系与葡萄酒差异较大,且混合发酵中所用酿酒酵母也会对非酿酒酵母产生一定抑制作用。猕猴桃酒中所检测到的短链脂肪酸乙酯主要为丁酸乙酯(OAV>1),其具有淡淡的果香(菠萝和香蕉)。Z9YD2中的短链脂肪酸乙酯质量浓度显著高于WLP对照组和其他混菌发酵组(P<0.05)。检测到中链脂肪酸乙酯含量丰富,感觉阈值较低,香气OAV>1,如己酸乙酯、庚酸乙酯、辛酸乙酯、癸酸乙酯赋予了猕猴桃酒水果香、青苹果香、橙子香、玫瑰花香、甜香。酿酒酵母单接种发酵酒的中链脂肪酸乙酯和其他酯类含量显著高于其他处理组(P<0.05),其中4种物质OAV远高于其他处理酒样。这与Lee等[27]研究结果类似,证实了非酿酒菌株能高效生产乙酸酯,而酿酒酵母单菌发酵产生的乙基酯类和杂酯类含量较高。
2.1.3 猕猴桃酒中酸类物质分析 脂肪酸浓度较低时呈奶油和奶酪香,可与醇类物质反应形成酯类,协调、平衡酒体香气[28]。Z9YD2酒样中脂肪酸含量(484.68μg/L)显著高于WLP和其他混菌发酵酒样(P<0.05),说明其具有更浓郁的奶酪香。所有处理酒样中脂肪酸的质量浓度均低于1 mg/L,且含量最高的脂肪酸均为辛酸,其次为己酸、癸酸、异丁酸。辛酸常呈油性霉味和腐臭味,但当其浓度较低时,具有令人愉悦的奶酪香和水果香。癸酸具有愉快脂肪气味,三个混菌发酵组中,A25D2酒样癸酸质量浓度最高(65.05μg/L),其次是Z9YD2(54.98μg/L)。整体来说,戴尔有孢圆酵母和发酵毕赤酵母与酿酒酵母混菌发酵有利于提高猕猴桃酒脂肪酸含量。
2.1.4 猕猴桃酒中萜烯类物质分析 萜烯类化合物由萜烯类香气糖苷在酒精发酵过程中酶解释放。本研究7种猕猴桃酒均检出3种萜烯类物质,具体为桉叶油醇、苏合香烯、香茅醇,其中桉叶油醇含量在各处理组中均最高且其OAV>1。桉叶油醇赋予猕猴桃酒薄荷香气和热带水果的甜香,香茅醇具有柠檬味、青草味、浓郁的蔷薇香。赵宁等[20]研究表明,三种猕猴桃酒(徐香酒、海沃德酒、黄金果酒)中苏合香烯仅存在于徐香酒中。王倩倩等[9]研究发现混合发酵显著增强了葡萄酒的果香与花香,而且发酵毕赤酵母的接种比例升高有利于增加萜烯类化合物的含量。Z9YD2酒中萜烯类物质总量最高,说明发酵毕赤酵母混菌发酵对猕猴桃酒萜烯类物质具有积极的贡献,这可能由于菌体产生了含量较高的糖苷酶,从而促进萜烯类糖苷前体酶解。相比于A 25,A25D2酒样萜烯类化合物增加,提高了酒体的香气复杂性和层次感,与祝霞等[29]研究结果一致。这可能因为不同的酵母混合后,混菌间互利作用,使酶系比例协调,产酶能力高于单一菌株。
2.1.5 猕猴桃酒中醛酮类、酚类和呋喃类物质分析7种酒中共有醛酮化合物为乙醛,其可赋予猕猴桃酒果香味。WLP酒中检测出乙醛和2-辛酮2种物质,A 25、A25D2均检出4种醛酮类物质,R69、R69D2分别检出6种、4种,Z9Y、Z9YD2分别检出6种、4种。非酿酒酵母单菌种发酵酒中醛酮类化合物含量高于酿酒酵母。相比于酿酒酵母单菌发酵,混菌发酵在一定程度上提高了酒中醛酮类物质的种类和含量。猕猴桃酒中检测到对乙烯基愈疮木酚和3,5-二叔丁基苯酚两种酚类物质,较高浓度苯酚类化合物具有类似药的香气[30]。对乙烯基愈疮木酚具有香辛料香。此外,仅检出2,3-二氢苯并呋喃一种呋喃类物质,且其在A25和Z9Y酒样中的含量显著高于WLP(P<0.05)。
2.1.6 猕猴桃酒特征香气分析 气味活性值(odor activity value,OAV)是评价挥发性物质对酒的香气感官贡献率的方法,当OAV>0.1时能够一定程度增加酒体的香气及协调性,当OAV>1时,说明该物质可能对酒体香气有直接影响,被确定为特征香气物质[31]。如表4所示,利用已报道的感觉阈值和香气描述计算[12,20,24,32−35],本实验发酵猕猴桃酒共得到9种特征香气物质,分别为乙酸异戊酯、乙酸己酯、2-甲基丁基乙酸酯、丁酸乙酯、正己酸乙酯、庚酸乙酯、辛酸乙酯、癸酸乙酯、桉叶油醇。这些物质多为乙酸酯、短链脂肪酸乙酯和中链脂肪酸乙酯,具有花香和果香特征,与Zhao等[13]研究结果一致,证明果香、花香和甜味是猕猴桃酒的特征香气。A 25和A25D2中乙酸异戊酯、乙酸己酯的OAV>1,且远高于WLP,赋予了猕猴桃酒更浓郁的苹果、草莓、梨等果香。2-甲基丁基乙酸酯、己酸乙酯、辛酸乙酯的OAV在WLP中相对较高,赋予酒体更强烈的玫瑰花香和果香。丁酸乙酯和桉叶油醇在Z9YD2中的OAV较高,赋予猕猴桃酒浓郁的薄荷香和果香。
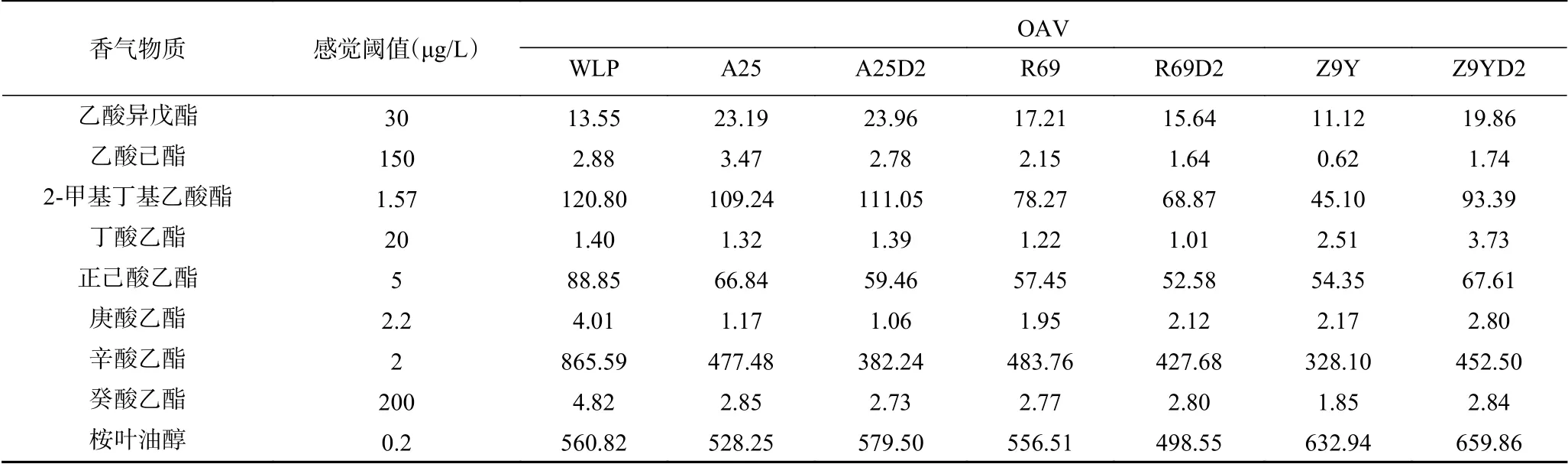
表4 不同猕猴桃酒特征香气成分OAV分析Table 4 OAV analysisof aroma characteristicsof kiwifruit wines
2.2 猕猴桃酒挥发性成分的主成分分析
为进一步分析不同酵母发酵的猕猴桃酒中香气化合物的差异,对7种猕猴桃酒的不同类型香气化合物进行PCA分析。PCA累计贡献率越大,越能反映样品的信息,样品间坐标上距离越大,则差异越大[17]。由图1可知,前两个主成分累积贡献率为63.2%(PC1占32.2%,PC2占31.0%),且不同处理酒样能被很好地区分开。WLP与中链脂肪酸及其他酯类物质相关,这与上述结论一致。PC1很好地将A25、A 25D2与R69、R69D2区分开,即A25和A 25D2分布在PC1的正向端,与苯乙基类化合物、乙酸酯、酸类、萜烯类物质相关性高;R69与R69D2分布在PC1的负向端,与C6化合物及高级醇含量相关,同时,由图可知,它们分离程度不高,说明耐热克鲁维酵母单一菌种发酵与混菌发酵的酒样香气差异不显著,可能是由于耐热克鲁维酵母对酿酒酵母的某些代谢产物如乙醇等不耐受,导致菌体糖苷酶含量下降。Z9Y及Z9YD2分布于PC2负向端,与短链脂肪酸、萜烯类、呋喃及醛酮类物质相关。

图1 猕猴桃酒挥发性物质的主成分分析Fig.1 Principal component analysisof volatile compoundsin kiwi wine
2.3 电子鼻传感器响应值的主成分分析
对7种猕猴桃酒的电子鼻检测结果进行PCA分析,如图2A所示,PC1与PC2的贡献率分别是54.8%、24.4%,前两个主成分的总贡献率为79.2%,表明这两个主成分可代表酒样挥发性风味的主要特征。各酒样在坐标系上分离程度大,说明不同处理之间的差异较大。样品的重复组存在小范围波动,但整体重复效果好,每组样品的数据均能独立聚集成团。分值图(图2A)可体现不同酵母发酵猕猴桃酒间的差异,PC1上Z9Y、Z9YD2、R69D2位于正向端,WLP、R69、A 25、A25D2位于负向端;PC2上R69、Z9Y、A 25D2位于正向端,R69D2、Z9YD2、A 25位于负向端。结果表明,PCA方法可将电子鼻测得的风味物质区分,不同非酿酒酵母发酵的酒样风味差别明显,混菌发酵与单一菌种发酵的风味物质可明显区分开。
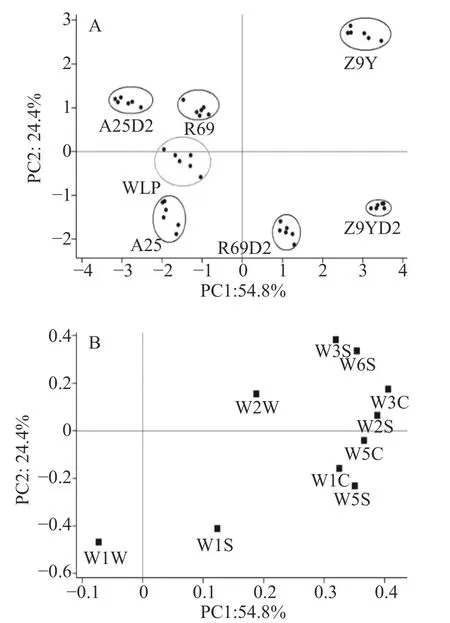
图2 猕猴桃酒的电子鼻主成分分析分值图(A)和载荷图(B)Fig.2 Principal component analysis scorediagram (A)and load diagram (B)of electronic nose of kiwiwine
由图2B与表1可知,Z9Y、Z9YD2香气特性和其他酒样的差异主要体现在烷烃、氢类和芳香型化合物上,R69、R69D2与其他酒样的差异主要体现在甲基类物质上,A 25、A25D2则主要体现在无机硫化物和萜烯类物质上。结果表明不同非酿酒酵母所酿造猕猴桃酒的挥发性香气特征差异明显。因此,电子鼻可作为果酒香气物质的快速分析工具,可通过测定挥发性化合物的浓度来区分不同样品,且与GCMS分析结果基本一致,证实了电子鼻作为猕猴桃酒挥发性物质鉴定工具的有效性。
2.4 PLS回归模型分析电子鼻预测猕猴桃酒挥发性成分的能力
如图3所示,为进一步探究GC-MS与电子鼻所测定挥发性成分间的联系,采用偏最小二乘回归分析方法分析了电子鼻预测6类主要香气物质(高级醇、乙酸酯、短链脂肪酸酯、中链脂肪酸酯、脂肪酸及苯乙基类化合物)的能力。以挥发性物质真实浓度为横坐标,电子鼻响应值为纵坐标,根据电子鼻响应数据计算的PLS模型,得到6类香气化合物的真实浓度与估计浓度之间的关系。响应图中包含了真实值、验证点、线性拟合方程与交叉验证方程。据文献报道,如果R2>0.7,校正模型可认为是稳健模型[36]。6个PLS模型的R2均大于80%,因此,利用电子鼻数据计算的6类香气物质模型是可靠的。其中,乙酸酯(R2=94.1%)、短链脂肪酸酯(R2=94.8%)、中链脂肪酸酯(R2=88.4%)模型的R2val较高。结果表明,电子鼻对猕猴桃酒中挥发性成分尤其是酯类物质浓度有良好的预测作用。

图3 基于电子鼻数据模拟的PLS模型中6种主要挥发性成分的真实浓度与拟合浓度之间的关系Fig.3 Relationship between observed concentrationsand concentrationsestimated based on the PLS modelscalculated from e-nosedata
2.5 猕猴桃酒的香气感官分析
如图4所示,QDA结果进一步揭示了猕猴桃酒挥发性香气成分与感官品质的关系。花香和果香(酸果和甜果)特征中,A 25D2酒样评分最高,其次是Z9YD2,这可能与酯类物质(乙酸酯、短链脂肪酸乙酯)和苯乙基类化合物的增加有关。此外,相较于单一菌种发酵,混合发酵酒样增强了猕猴桃酒的花香和果香特征。研究证实,花香和果香有利于提高果酒香气复杂性[37]。C6化合物是果酒生青味的主要来源,R69和R69D2酒中C6化合物含量较高,而引入了不良的生青味。Z9YD2脂肪香气特征评分高,与较高的脂肪酸含量浓度一致。因此,香气感官差异可以归因于猕猴桃酒中的某些芳香族化合物的种类和含量差异。

图4 不同猕猴桃酒的感官QDAFig.4 QDA analysis of sensory profiles of different kiwi wines
3 结论
本文主要研究不同非酿酒酵母与酿酒酵母混菌发酵对猕猴桃酒中挥发性成分的影响。总体来看,猕猴桃酒挥发性香气物质中高级醇、乙酸酯、中链脂肪酸乙酯占比较高,混菌发酵进一步增强了酒体的醇香、酯香特征。在香气物质的数量上,非酿酒酵母的接种有利于酒体更多香气化合物的生成;在香气物质的含量上,混菌发酵对不同种类挥发性成分的增强作用不同,其中,R69D2酒样中香气化合物总量最高(9687.96μg/L)。
不同酵母对猕猴桃酒挥发性成分影响差异较大。A25和A25D2酒中苯乙醇、乙酸酯含量高,对酒中花香、果香有重要贡献;R69D2酒样高级醇、C6化合物含量显著提高,增强了酒体醇厚感;Z9Y、Z9YD2酒样短链脂肪酸乙酯、萜烯类、呋喃类、酚类物质、脂肪酸含量高,增加了酒体香气复杂性和层次感;WLP酒样中链脂肪酸乙酯和其他酯类含量高。这种酒体香气特征差异性可能与酵母代谢有关,需进一步研究菌体特性。感官分析表明混合发酵增强了猕猴桃酒的花香和果香特征,提高了香气复杂性。
主成分分析方法能很好地将不同酵母发酵的猕猴桃酒区分开。基于SPME-GC-MS及电子鼻的PLS回归模型表明两种检测方法结合能够更加快速、准确地评价猕猴桃酒的风味,这将为猕猴桃酒酿造酵母的选择、挥发性香气品质的提升及检测提供理论依据。
