基于表型性状构建传统菊花核心种质
2021-09-02李嘉伟苏江硕张飞房伟民管志勇陈素梅陈发棣
李嘉伟,苏江硕,张飞,房伟民,管志勇,陈素梅,陈发棣
基于表型性状构建传统菊花核心种质
李嘉伟,苏江硕,张飞,房伟民,管志勇,陈素梅,陈发棣
南京农业大学园艺学院/作物遗传与种质创新国家重点实验室/农业农村部景观农业重点实验室,南京 210095
【】探讨构建传统菊花品种核心种质的最优取样方法并构建核心种质,以便于传统菊花种质资源的收集与保存。以《中国菊花》专著中记载的2 249份传统菊花品种为材料,依据舌状花花色分为8组,采用逐步聚类法基于4种总体取样规模(5%、10%、15%、20%)和4种组内取样比例方法(简单比例、对数比例、平方根比例、多样性比例)构建了传统菊花备选核心种质16个,探讨最优的取样策略。筛选出最优取样策略后进一步比较2种组内取样方法(随机和聚类)的构建效果。对最优方法下建立的核心种质代表性进行检验,利用多个特征值(最小值、最大值、均值、标准差、变异系数、Shannon-Weaver遗传多样性指数)和评价参数(均值差异百分率(MD)、方差差异百分率(VD)、极差符合率(CR)、变异系数变化率(VR)和表型保留比例(RPR))综合地评价核心种质。传统菊花按照花色进行分组,各组品种呈现正态分布,能够确保取样的均匀性;对数比例法和多样性比例法都能够使每组的取样份数更加均衡,起到良好的修正作用,对数比例法下构建的核心种质各项参数值达到最大,是最优取样比例法;随着总体取样规模的增加,遗传多样性指数呈现先增大再减小的趋势,变异系数变化率不断减小,极差符合率和表型保留比例不断增大;当取样规模大于10%时,遗传多样性指数和变异系数变化率减小,而极差符合率和表型保留比例的升幅并不大,因此,构建传统菊花核心种质最适宜的总体取样规模为10%;聚类取样构建的备选核心种质各项参数值均大于随机取样构建的对应备选核心种质的参数值,以聚类取样方法构建的核心种质变异的丰富性和均匀程度更好。核心种质各特征值与原始种质表现一致,多个评价参数值表明核心种质的均度和丰度较好,充分体现了表型的遗传多样性。通过补充聚类丢失的“追抱”1个花抱性状和对花序高度、外层瓣长2个性状的完善,最终构建得到228个传统菊花品种的核心种质,占原始材料的10.14%。本研究基于2 249份传统菊花品种材料的15个表型性状,系统地比较了多种总体取样规模、组内取样比例方法、组内取样方法构建的备选核心种质后,确定了最佳的核心种质构建方法,并对核心种质的代表性进行了分析和验证,各特征值和评价参数表明本研究构建的核心种质是有效的,核心种质充分地代表了传统菊花原始种质的遗传多样性。
传统菊花;表型性状;核心种质;取样策略;评价参数
0 引言
【研究意义】菊花()在我国具有悠久的栽培历史,为我国十大传统名花之一,具有丰富的花型花色,是菊花品种选育的优异亲本来源。菊花起源于中国,在中国分布广泛,种质资源极为丰富。南京农业大学李鸿渐教授花费数十年精力收集了6 000余份菊花品种材料,从中整理出了3 000多个品种,并于1993年出版了《中国菊花》专著,其中详细记载2 302个品种的性状[1],为菊花种质资源的研究提供了宝贵的资料文献。在前人工作的基础上,充分挖掘利用资源优势,保障品种资源工作的延续性并推动育种创新,是种质资源研究的重点。传统菊花品种的栽培难度较切花菊、园林小菊品种大,这就给传统菊花品种资源的收集和保存带来难度。因此,构建传统菊花品种资源的核心种质,不仅有利于种质资源的保存,且对了解现有种质资源多样性的组成特点、促进传统菊花品种资源的利用与改良具有重要意义。【前人研究进展】自1984年FRANKEL[2]提出核心种质(core collection)的概念以来,国内外已成功构建了水稻[3]、小麦[4]、黄麻[5]、黍稷[6]、苹果[7]、甜瓜[8]、大白菜[9]等100多种农作物以及经济作物的核心种质,梅花[10]、腊梅[11]、紫薇[12]、山茶[13]、中原牡丹[14]、芍药[15]、荷花[16]、建兰[17]等一批传统名花也相继开展了核心种质的构建研究。【本研究切入点】相对木本观赏植物及宿根花卉,菊花栽培由于具有明显的连作障碍及自毒效应[18],其资源保存工作的投入更大,因此,核心种质的构建对于菊花资源的收集保护利用有着更现实的需求。菊花核心种质的构建已有少量的报道[19-20],但不论是从涉及的种质资源总体规模还是从构建方法的系统性上,都有必要在前人的工作基础上通过对多种取样策略的比较,优化传统菊花品种核心种质构建的方法。【拟解决的关键问题】基于15个表型性状,从4种总体取样规模、4种组内取样比例和2种组内取样方法3方面探讨构建传统菊花核心种质的最佳取样策略,并对所构建的核心种质的代表性进行分析检验,得出基于表型性状构建传统菊花核心种质的最佳方法并构建传统菊花核心种质,为菊花种质库中种质的高效保存与利用提供理论依据。
1 材料与方法
试验于2019年在南京农业大学进行。
1.1 试验材料
本研究的种质资源全体为《中国菊花》专著中记载的2 302个品种,剔除登记性状有缺失的53个品种,共计2 249个传统菊花品种。来源于20个不同地区,其中江苏605份、上海526份、北京497份、河南138份、山东128份、浙江89份、辽宁46份、福建39份、湖南37份、陕西36份、广东34份、湖北27份、安徽14份、四川12份、贵州7份、天津5份、重庆5份、云南2份、广西1份、江西1份。
1.2 方法
1.2.1 数据的整理 研究的15个性状中,有5个质量性状,即瓣型、舌状花色、花抱、叶型、花期;10个数量性状,即植株高度、花序直径、花序高度、舌状花瓣数、外层瓣长、外层瓣宽、花心直径、管状花瓣数、叶长、叶宽。质量性状主要依据《植物新品种特异性、一致性和稳定性测试指南—菊花》(2012)[21]进行赋值(表1)。数量性状进行10级分类,1级<X-2δ,10级≥X+2δ,每级间相差0.5δ,X为性状平均值,δ为标准差。
计算Shannon-Weaver遗传多样性指数:
-
式中,代表某一性状的遗传多样性指数;代表某一性状第个代码的频率。
1.2.2 数据分组和聚类分析 本研究基于菊花舌状花花色的不同,将2 249个传统菊花品种分为8组(表1)。以组为单位聚类分析,对15个性状标准化后的数据结合欧氏距离和离差平方和法逐步聚类。从聚类树状图遗传距离最小的一组中,选择具有特殊表型性状的材料1份归入下一轮聚类,剔除其余的材料,入选的材料再次进行聚类,直到所剩材料达到需要的取样数目[17,22-23]。聚类分析由SPSS 20.0软件完成。
1.2.3 取样策略在分组和逐步聚类的基础上,比较4种组内取样比例方法下构建的菊花品种核心种质:简单比例法、平方根比例法、对数比例法和多样性比例法。总体取样规模设定为5%、10%、15%和20%,一共形成16种取样策略(表3)。经过比较变异系数变化率、极差符合率、表型保留比例和Shannon-Weaver多样性指数4个指标,筛选出最优取样策略。
(1)简单比例法:每组材料份数占总资源份数的比例为该组取样比例。
(2)平方根比例法:每组材料份数的平方根值占各组平方根值之和的比例为该组取样比例。
(3)对数比例法:每组材料份数的对数值占各组对数值之和的比例为该组取样比例。
(4)多样性比例法:每组材料的遗传多样性指数占各组遗传多样性指数之和的比例为该组取样比例。
1.2.4 核心种质评价 对最佳取样策略下建成的核心种质的有效性进行检验
(1)各特征值比较
利用全部种质和核心种质15个性状的最小值、最大值、均值、标准差、变异系数、Shannon-Weaver多样性指数6个特征值检验建立的初选核心种质的均匀程度和变异范围。
(2)各评价参数比较
借鉴前人经验[7,24-27],挑选5个评价参数,用于综合评价核心种质的代表性,分别是:均值差异百分率(MD)、方差差异百分率(VD)、极差符合率(CR)、变异系数变化率(VR)和表型保留比例(RPR)。各评价参数的选择以及公式参考刘遵春等[7]、张洪亮等[27]的报道。
(3)检验和F检验
为了评价和验证初选核心种质对全部原始种质的代表性,对15个性状分别进行检验和F检验。
2 结果
2.1 总体取样规模和组内取样比例的确定
将2 249个传统菊花品种依据舌状花花色的分类方法分为黄、白、粉、红、紫、橙、绿、双色8组。在总体取样规模为5%、10%、15%和20%下,分别以简单比例、平方根比例、对数比例和多样性比例来计算每组的取样份数(表2)。绿色传统菊花在原始材料中数量最少,简单比例法绿色传统菊花取样率仅为1.82%,其余3种方法都有所增加,其中对数比例法和多样性比例法绿色传统菊花取样率最大,均为8.71%。紫色传统菊花在原始材料中数量最多,简单比例法取样率达20.90%,其余3种方法都有所减少,其中多样性比例法紫色传统菊花取样率仅为13.35%,对数比例法紫色传统菊花取样率为14.36%。可以看出,对数比例法和多样性比例法能够增加稀有花色的取样数量,起到良好的修正作用,使每组的取样份数更加均衡。
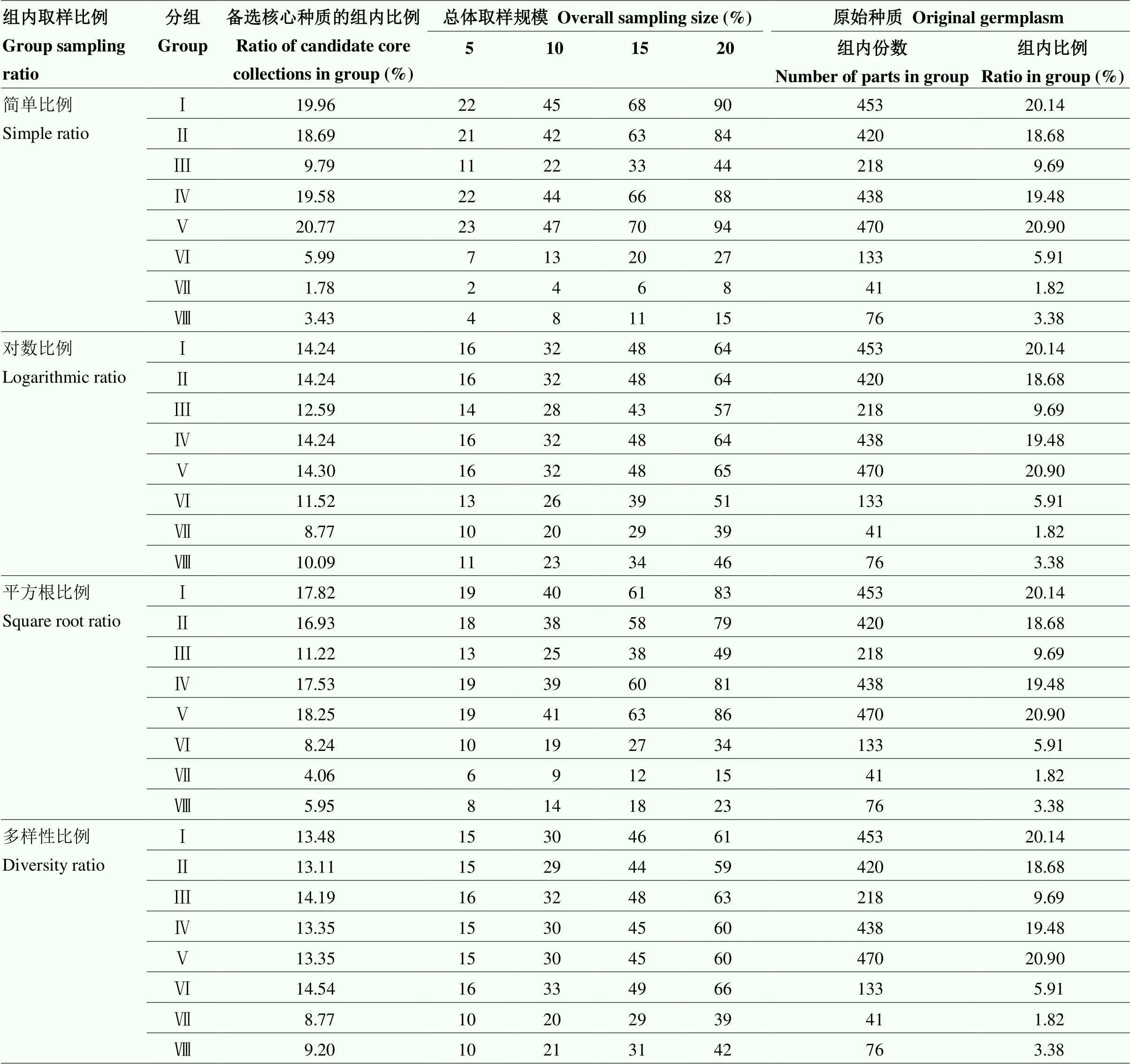
表2 不同取样规模下的组内取样方案
Ⅰ:黄色;Ⅱ:白色;Ⅲ:粉色;Ⅳ:红色;Ⅴ:紫色;Ⅵ:橙色;Ⅶ:绿色;Ⅷ:双色
Ⅰ: Yellow; Ⅱ: White; Ⅲ: Pink; Ⅳ: Red; Ⅴ: Purple; Ⅵ: Orange; Ⅶ: Green; Ⅷ: Two colors
4种组内取样方法中只有对数比例法的VR值均大于100%,表明对数比例法能较好地去除冗余的性状,保留原始种质的遗传多样性。16份备选核心种质中,CR值随着取样数的增加而递增。对数比例的CR值在5%的总体取样规模下就达到80%,在10%下高达88.11%。简单比例和多样性比例在10%下达到80%,平方根比例在15%的取样规模下才达到80%(表3)。因此,对数比例法为最优的取样比例法。
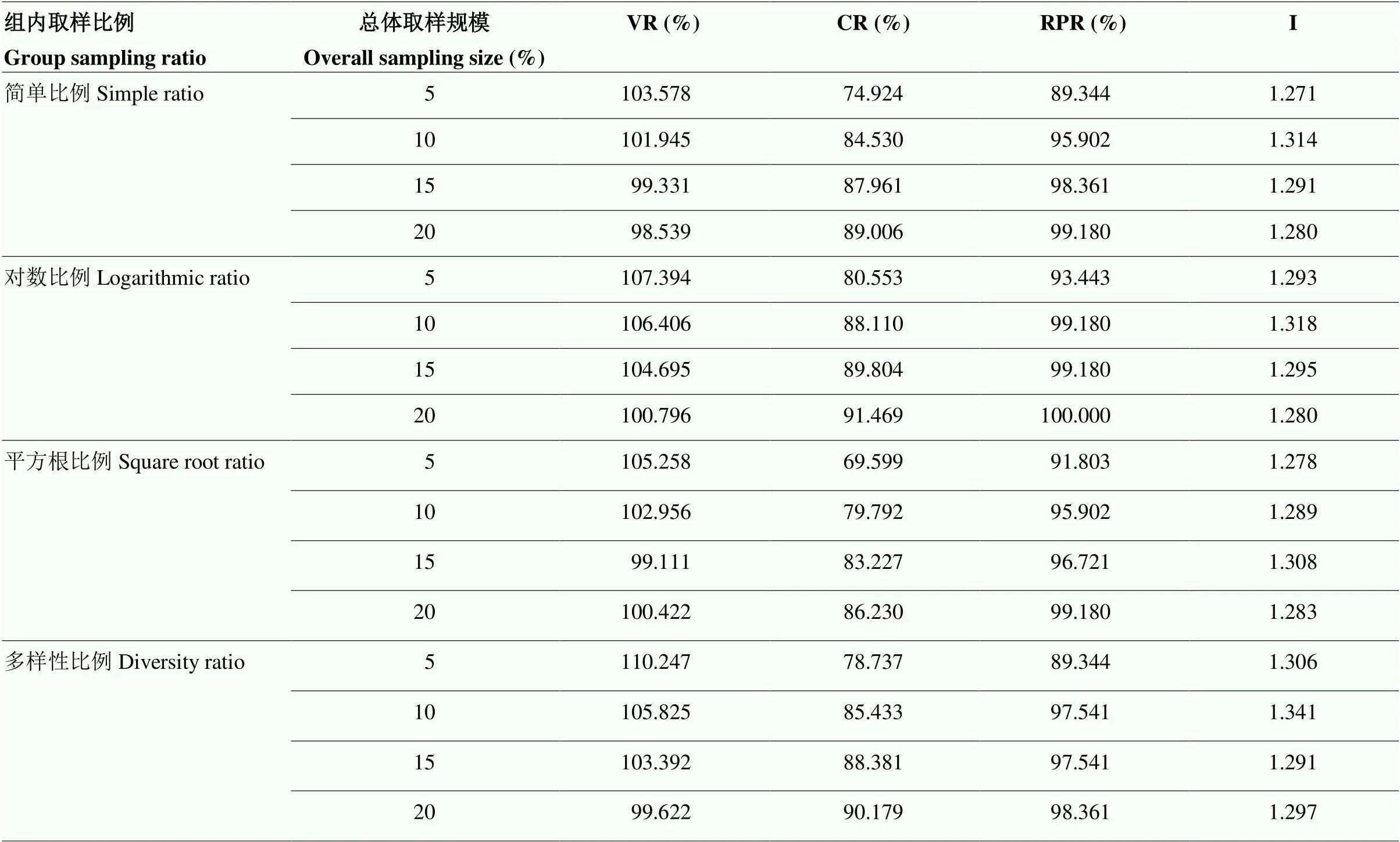
表3 备选核心种质评价参数
VR:变异系数变化率;CR:极差符合率;RPR:表型保留比例;I:Shannon-Weaver遗传多样性指数。下同
VR: The variable rate of coefficient of variation; CR: Range coincidence rate; RPR: Phenotype retention ratio; I: Shannon-Weaver genetic diversity index. The same as below
随着取样规模的增加,I值呈现先增大再减少的趋势,简单比例、对数比例和多样性比例均在10%的取样规模下达到最大,而平方根比例在15%下达到最大。RPR值随着总体取样规模的增加而增加,与CR值变化一致,当取样规模大于10%时,RPR值的升幅并不大。可以看出,增加核心种质规模将增加冗余,影响表型性状分布均度,从而减小多样性指数。因此,10%的总体取样规模最为合适。
2.2 组内取样方法的确定
分别按总体规模为10%、15%和组内对数比例法的策略下,进一步比较聚类和随机两种取样方法构建的备选核心种质(表4)。结果表明,聚类取样构建的备选核心种质的变异系数变化率、极差符合率、表型保留比例和Shannon-Weaver遗传多样性指数均较随机取样建立的对应备选核心种质的参数值大。表明核心种质变异的丰富性和均匀程度均以聚类取样法好。
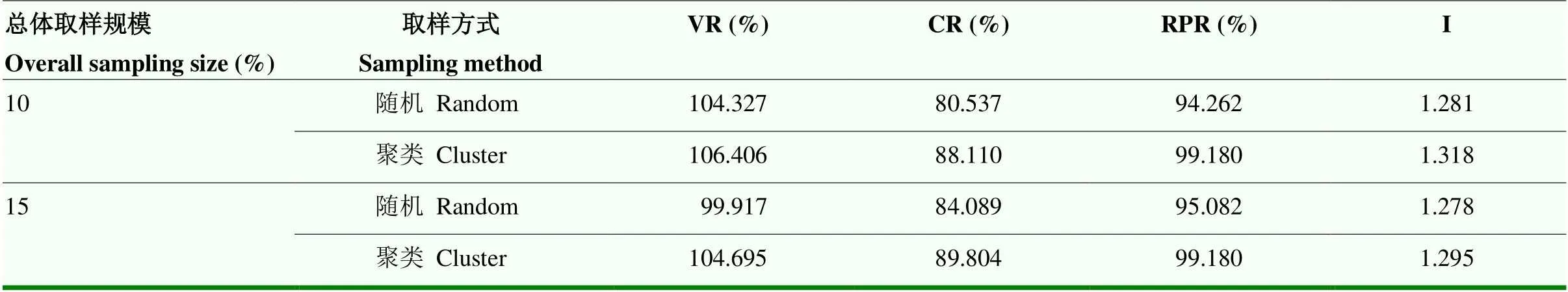
表4 组内不同取样方法的比较
2.3 核心种质的评价
2.3.1 核心种质与原始种质各性状特征值的比较 核心种质与原始种质15个性状的最大值、最小值、平均值、标准差、变异系数和多样性指数一致性好,具有较好的均度和丰度(表5)。因此,原始材料中各性状的遗传变异在核心种质中均存在,本研究建立的核心种质达到了良好的构建效果,能很好地代表全部种质。
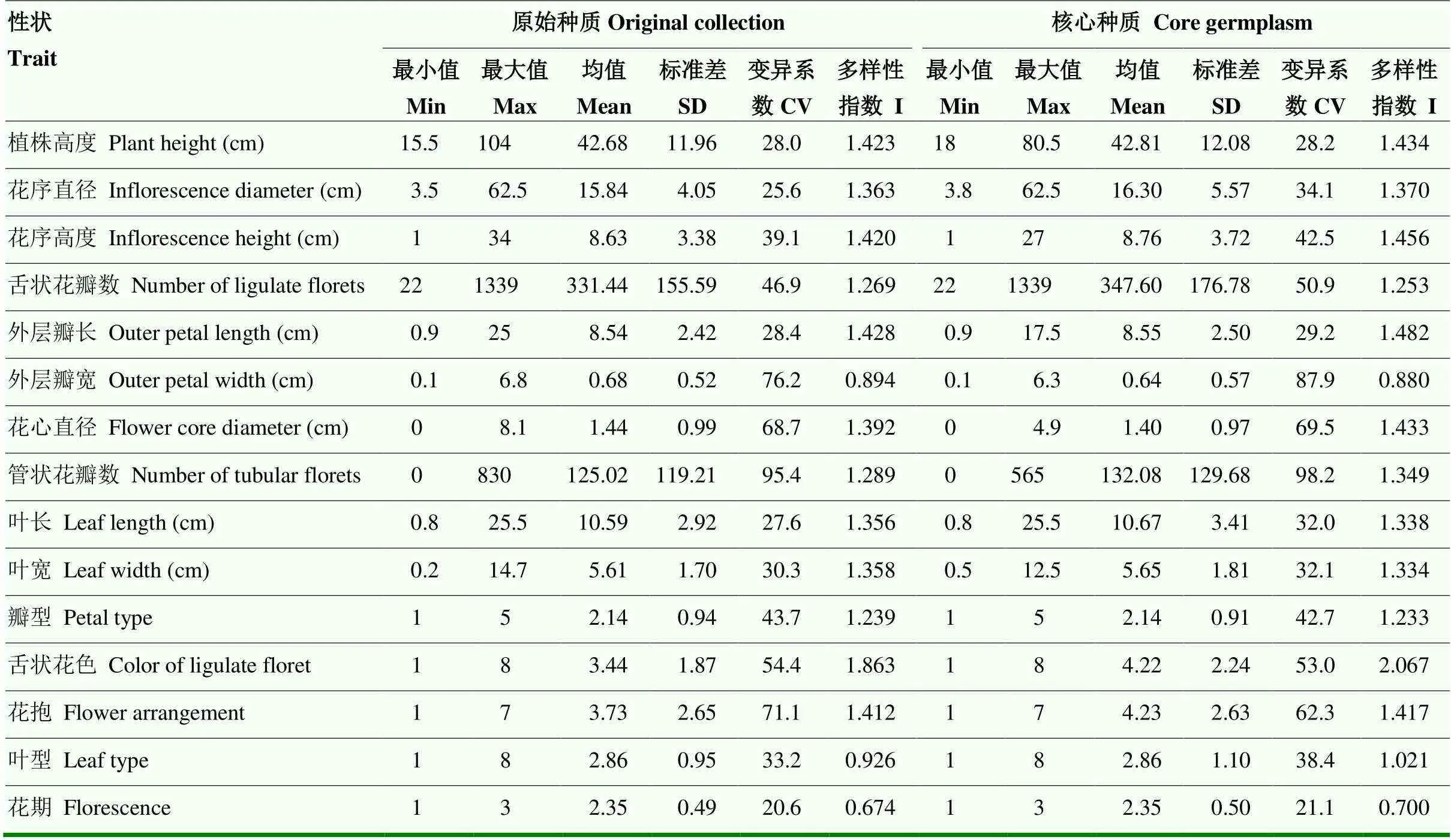
表5 中国传统菊花原始种质与核心种质性状特征值比较
2.3.2 核心种质与原始种质各评价参数比较 由表6可知,5个评价参数的值分别为:CR=88.110%,VR=106.406%,RPR=99.180%,MD=13.3%,VD= 26.7%。当均值差异百分率小于20%且极差符合率大于80%的条件下,认为所构建的核心种质具有代表性。本研究构建的核心种质完全符合标准,并且变异系数变化率、方差差异百分率和表型保留比例均较大。
2.3.3 各性状均值的检验和方差的F检验检验结果表明:15个性状均值仅花色和花抱两个性状具有显著性差异,均值差异百分率(MD)小于20%。这主要是由于按花色分组后对数比例法取样的修正作用,提高了稀有花色的取样数,从而使核心种质保留较高的观赏性状,因此,此方法选出的初选核心种质具有很好的代表性。方差齐性检验结果显示:花序直径、管状花瓣数、叶长和舌状花色4个性状方差具有显著差异性,表明核心种质这4个性状保留了更多的变异并且分布均匀,遗传冗余度小,可以更多地保存原始资源的遗传多样性(表6)。
2.3.4 核心种质的补充和完善 经过多个参数的代表性检验,核心种质较好地代表了原种质资源表型的多样性,但在聚类取样中存在一定程度的丢失,因此,用人工定向添加的方式对核心种质做最后的补充和完善。表型保留比例除花抱值为85.71%外,其余均为100%(表6)。表明15个性状都获得了很好的保留,仅丢失“追抱”1个花抱性状。在保留种质中,品种‘一品黄’的花抱性状是“追抱”,因此,将该种质补充到初级核心种质中。花序的形态是重要的特征性状,决定了传统菊花的观赏特性。如表6所示,花序高度(CR=78.788%)和外层瓣长(CR=68.880%)两个关键性状还没有达到预期;保留种质中,‘紫莲’(花序高度:34cm)和‘礼花’(外层瓣长:25cm)两个品种很好地满足了要求,因此直接加入初级核心种质。通过对核心种质的补充和完善,最终基于表型性状构建了包含228个传统菊花品种的核心种质,占原始种质的10.14%,表型保留比例达到100%(表7)。
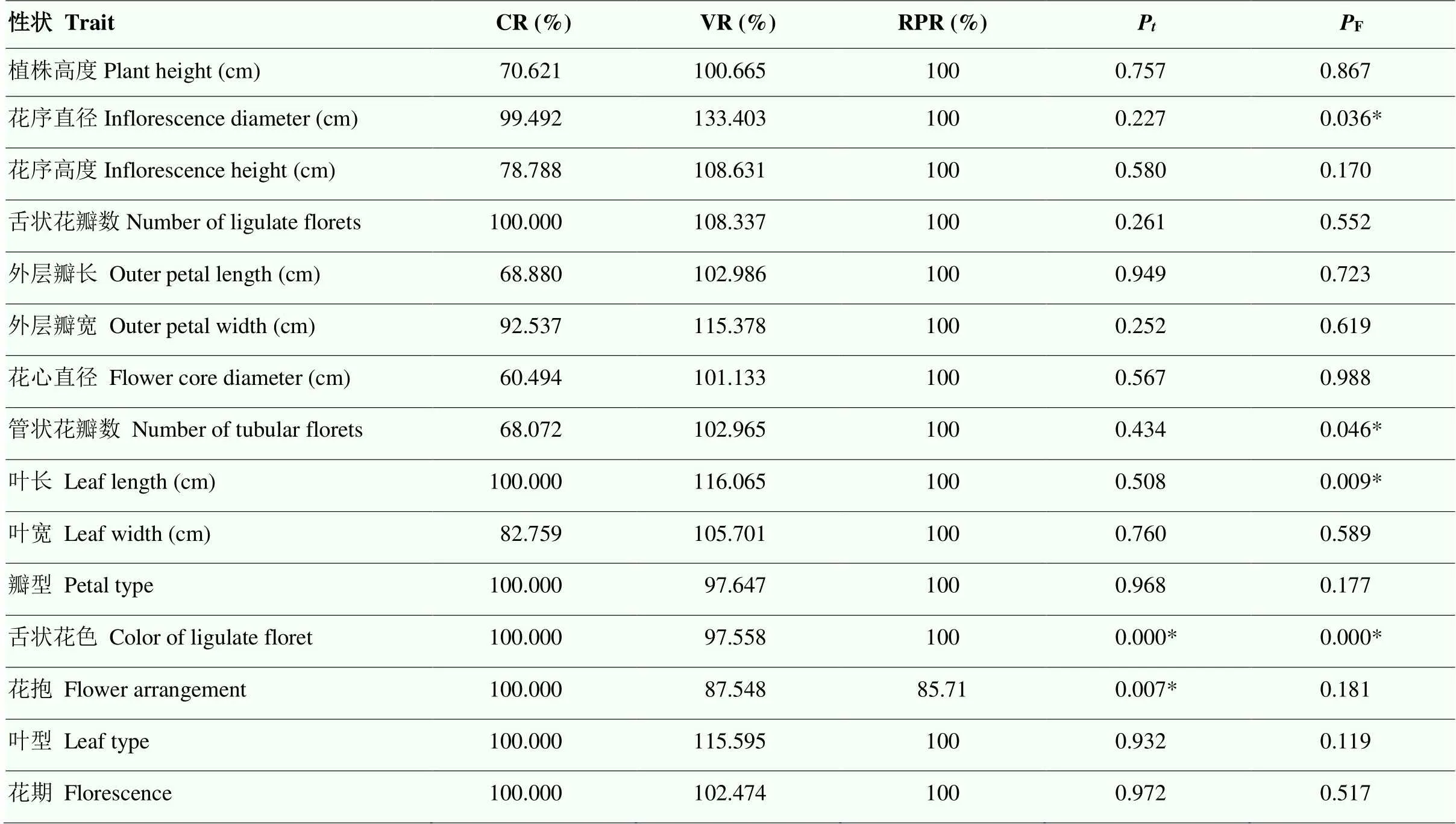
表6 核心种质与原始种质各性状评价参数和t检验、F检验
P<0.05表示在检测时得到的数值在0.05水平差异显著;F<0.05表示在F检测时得到的数值在0.05水平差异显著
P<0.05 indicates that the values obtained attest are significantly different from each other at the level of 0.05,F<0.05 indicates that the variance of the square difference obtained at the time of F detection is significant at the level of 0.05
3 讨论
观赏植物种类众多、遗传复杂,而核心种质针对性强、利用效率高,从中挖掘和利用优异基因并进行遗传改良是构建核心种质的重要目标之一。中国是世界菊花的起源中心,品种繁多,遗传多样性十分丰富,核心种质的构建在菊花资源研究利用中起着基础性的作用。目前构建核心种质的数据来源主要有表型性状和分子标记两类,在原始种质数量较大的情况下,资源群体具有良好的遗传变异范围和多样性分布,应优先使用表型性状构建初级核心种质。表型性状变异的丰富性和均匀程度是遗传多样性的直接体现,利用表型性状的差异来检测种群的遗传多样性简便易行[28]。观赏植物应重点收集花色、花型、花期等方面的观赏性状[29]。

表7 基于表型性状构建的传统菊花品种核心种质

续表7 Continued table 7
种质分组和取样策略直接影响核心种质的代表性,是研究核心种质构建方法的关键。分组首先是为了能够反映不同条件下的代表性和遗传多样性,其次是为了尽可能消除环境因素的影响。常见的分组依据有地理来源、农艺性状、育种体系和遗传标记,不同作物应根据所收集资源的特征进行分组。如甘蔗[30]、陆地棉[31]按照地理来源分组,建兰[17]、辣椒[32]则是分别按照瓣型和果型分组。李自超等[33]在研究云南稻种初级核心种质时提出按两种分类体系进行分组,其效果都优于按来源地分组。刘长友等[34]在构建绿豆的核心种质时得出性状分组优于省份分组的结论。舌状花花色是菊花重要的观赏性状,本研究基于舌状花花色将2 249个传统菊花品种分为8大类。经过计算发现,按照地理来源或者瓣型分组时,各组间数量差异太大,而依据花色进行分组,各组品种呈现出正态分布的趋势,能够增加稀有花色的取样数,确保取样的均匀性。
在分组的基础上,应根据各组的遗传特点确定适合的组内取样比例方法。雷刚等[32]经过对4种组内取样比例方法建立的核心种质对比分析,表明以对数或多样性比例在组内聚类取样的方法明显优于完全随机取样,该取样法构建的核心种质能够保证遗传的代表性。李慧峰等[35]比较了不同取样比例法构建的甘薯核心种质,发现对数比例法构建的核心种质代表性最好,简单比例法次之,平方根比例法最差。艾叶等[17]以226个建兰品种为材料,结果发现总体取样规模为25%,同时采用对数比例法取样时,各项参数值都达到最大。本研究结果表明,对数比例法具有很好的修正能力,能够对表型性状较好地保留并且降低遗传冗余度。
目前核心种质总体取样规模的大小没有固定的标准。一般而言,取样比例为原始材料的5%—30%。李自超等[3]认为,总体取样规模应根据原始种质的大小来决定,原始种质数量大的作物,其核心种质所占的比例可相对小一些;原始种质数量小的作物,其核心种质所占比例可大一些。由于保存的种质规模远不及农作物,园艺作物核心种质的取样比例往往大一些,为10%—30%[36]。BROWN[37]使用中性理论模型推导,认为占原材料5%—10%的核心样品就能够保留总体资源70%以上的遗传变异。李国强等[9]在构建大白菜核心种质时发现,取样规模为15%时,Shannon-Weaver遗传多样性指数达到最大,表型保留比例也达到98%;而取样规模增大到20%时,虽然表型保留比例接近100%,但是遗传多样性指数迅速下降。由于本研究种质全体的数量较大,为了确保核心种质取样的合理性和系统性,设定5%为总体取样规模的最低值。在对5%、10%、15%和20% 4种总体取样规模的比较后发现:在10%的取样规模下,核心种质的遗传多样性指数达到最大,4种组内取样比例方法的表型保留比例均达到95%以上,对数比例法的表型保留比例达到99%,充分代表了原始种质的遗传变异特征和多样性,这与李国强等[9]的研究结果相似。
取样方法一般有两种:随机取样和系统聚类取样,但是作物各性状变异的分布不一定均衡,一些重要的种质资源可能会因为取样的随机性而丢失,所以为了使核心种质更具代表性和科学性,大多采用系统聚类取样来减小偏差。目前,园艺作物聚类取样中,遗传距离使用最多的是欧式距离,其次是Nei's遗传距离,再次是马氏距离;聚类方法的应用频率为:非加权组平均法(UPGMA)>离差平方和法>类平均法>最短距离法>最大距离法[36]。本研究对原始材料先分组后聚类,采用的聚类方法为欧式距离结合离差平方和法,并与随机取样相比较,发现聚类后构建的核心种质各项参数值均高于随机取样。
代表性是核心种质所需具备的最重要的性质[6],而核心种质的代表性检验由任何一个参数单独完成都有一定局限性,须借助一系列的评价参数达到综合考量的目的。选择合理的评价参数,取样比例方法、总体取样规模等的研究就有判定的标准。张洪亮等[27]分析水稻核心种质时,表明表型方差、变异系数、表型保留比率、遗传多样性指数等是核心种质所需的重要评价参数。Hu等[38]研究表明,当均值差异百分率小于20%,并且极差符合率大于80%时,认为所构建的核心种质具有代表性。此外,均值差异百分率越小,极差符合率和变异系数变化率越大,核心种质的构建效果就越好。这一评价标准已被普遍接受并在核心种质评价中获得高度使用[7,28,38-39]。本研究采用前人广泛使用的参数进行综合评价,对各性状特征值对比分析,可以看出核心种质与原始种质15个性状最大值、最小值、均值、标准差、变异系数和多样性指数均表现一致;仅缺失“追抱”1个花抱性状,因此通过定向选择的方式,添加1种种质对丢失的花抱性状进行补充和添加2种种质对花序高度、外层瓣长2个性状进行完善,以最小的样本数最大程度的代表整个种质资源的遗传信息。
李宝琴[19]以106个大菊菊花品种为材料构建了36个品种的核心种质。所涉及的种质资源总体的规模较小,资源总体有限、涵盖的表型多样性可能受到限制。本研究种质数量为2 249个品种,以此为原始种质构建的核心种质可以充分代表传统菊花的遗传多样性,反映传统菊花的遗传结构。本研究基于4个方面的比较构建了传统菊花核心种质,相比张飞等[20]以固定的方法构建的菊花品种初选核心种质,在构建方法上更为谨慎、系统。
4 结论
依据舌状花花色的不同将2 249个传统菊花品种划分为8个组,通过取样策略的比较发现,最合适的总体取样规模为10%,对数比例法是最优的组内取样比例法,组内取样方法为聚类的方案是最优的取样策略。以最优方案构建核心种质,各特征值与原始种质表现一致,多个评价参数值表明核心种质的均度和丰度较好,充分体现了表型的遗传多样性。通过补充聚类过程中丢失的“追抱”花抱性状,表型保留比例达到100%。并且对花序高度、外层瓣长2个性状再次完善,最终构建得到228个基于表型性状的传统菊花品种核心种质,占原始种质的10.14%。
[1] 李鸿渐. 中国菊花. 南京: 江苏科学技术出版社, 1993.
LI H J. Chrysanthemums in China. Nanjing: Phoenix Science Press, 1993. (in Chinese)
[2] FRANKEL O H. Genetic Perspectives of Germplasm Conservation. Cambridge: Cambridge University Press, 1984: 161-170.
[3] 李自超, 张洪亮, 曹永生, 裘宗恩, 魏兴华, 汤圣祥, 余萍, 王象坤. 中国地方稻种资源初级核心种质取样策略研究. 作物学报, 2003, 29(1): 20-24.
LI Z C, ZHANG H L, CAO Y S, QIU Z E, WEI X H, TANG S X, YU P, WANG X K. Studies on the sampling strategy for primary core collection of Chinese ingenious rice. Acta Agronomica Sinica, 2003, 29(1): 20-24. (in Chinese)
[4] 赵丽娜, 任晓娣, 胡亚亚, 张涛, 张娜, 杨文香, 刘大群. 23份中国小麦微核心种质抗叶锈性评价. 中国农业科学, 2013, 46(3): 441-450.
ZHAO L N, REN X D, HU Y Y, ZHANG T, ZHANG N, YANG W X, LIU D Q. Evaluation of wheat leaf rust resistance of 23 Chinese wheat mini-core collections. Scientia Agricultura Sinica, 2013, 46(3): 441-450. (in Chinese)
[5] 徐益, 张列梅, 郭艳春, 祁建民, 张力岚, 方平平, 张立武. 黄麻核心种质的遴选. 作物学报, 2019, 45(11): 1672-1681.
XU Y, ZHANG L M, GUO Y C, QI J M, ZHANG L L, FANG P P, ZHANG L W. Core collection screening of a germplasm population in jute(spp.). Acta Agronomica Sinica, 2019, 45(11): 1672-1681. (in Chinese)
[6] 胡兴雨, 王纶, 张宗文, 陆平, 张红生. 中国黍稷核心种质的构建. 中国农业科学, 2008, 41(11): 3489-3502.
HU X Y, WANG L, ZHANG Z W, LU P, ZHANG H S. Establishment of broomcorn millet core collection in China. Scientia Agricultura Sinica, 2008, 41(11): 3489-3502. (in Chinese)
[7] 刘遵春, 张春雨, 张艳敏, 张小燕, 吴传金, 王海波, 石俊, 陈学森. 利用数量性状构建新疆野苹果核心种质的方法. 中国农业科学, 2010, 43(2): 358-370.
LIU Z C, ZHANG C Y, ZHANG Y M, ZHANG X Y, WU C J, WANG H B, SHI J, CHEN X S. Study on method of constructing core collection ofbased on quantitative traits. Scientia Agricultura Sinica, 2010, 43(2): 358-370. (in Chinese)
[8] 胡建斌, 马双武, 王吉明, 苏艳, 李琼. 基于表型性状的甜瓜核心种质构建. 果树学报, 2013, 30(3): 404-411.
HU J B, MA S W, WANG J M, SU Y, LI Q. Establishment of a melon () core collection based on phenotypic characters. Journal of Fruit Science, 2013, 30(3): 404-411. (in Chinese)
[9] 李国强, 李锡香, 沈镝, 王海平, 宋江萍, 邱杨. 基于形态数据的大白菜核心种质构建方法的研究. 园艺学报, 2008, 35(12): 1759-1766.
LI G Q, LI X X, SHEN D, WANG H P, SONG J P, QIU Y. Studies on the methods of constructing Chinese cabbage core germplasm based on the morphological data. Acta Horticulturae Sinica, 2008, 35(12): 1759-1766. (in Chinese)
[10] 明军, 张启翔, 兰彦平. 梅花品种资源核心种质构建. 北京林业大学学报, 2005, 27(2): 65-69.
MING J, ZHANG Q X, LAN Y P. Core collection ofSieb. et Zucc. Journal of Beijing Forestry University, 2005, 27(2): 65-69. (in Chinese)
[11] 赵冰, 张启翔. 中国蜡梅种质资源核心种质的初步构建. 北京林业大学学报, 2007(S1): 16-21.
ZHAO B, ZHANG Q X. Preliminary construction of the core germplasm ofin China. Journal of Beijing Forestry University, 2007(S1): 16-21. (in Chinese)
[12] 顾翠花. 中国紫薇属种质资源及紫薇、南紫薇核心种质构建[D]. 北京: 北京林业大学, 2008.
GU C H. Studies ongermplasm and core collection establishment inand[D]. Beijing: Beijing Forestry University, 2008. (in Chinese)
[13] 陈焕杰. 山茶种质资源核心库构建[D]. 杭州: 浙江农林大学, 2013.
CHEN H J. Construction of core collection germplasm of camellia [D]. Hangzhou: Zhejiang Agriculture and Forestry University, 2013. (in Chinese)
[14] 李保印. 中原牡丹品种遗传多样性与核心种质构建研究[D]. 北京: 北京林业大学, 2007.
LI B Y. Studies on genetic diversity and construction of core collection of tree peony cultivars from Chinese[D]. Beijing: Beijing Forestry University, 2007. (in Chinese)
[15] 王晓菡. 中国芍药品种遗传多样性SRAP分析和核心种质的初步构建[D]. 泰安: 山东农业大学, 2010.
WANG X H. Analysis of genetic diversity and construction of the core collection for Chinese herbaceous peony cultivars using SRAP marker [D]. Taian: Shandong Agricultural University, 2010. (in Chinese)
[16] 杨美, 付杰, 向巧彦, 刘艳玲. 利用AFLP分子标记技术构建花莲核心种质资源. 中国农业科学, 2011, 44(15): 3193-3205.
YANG M, FU J, XIANG Q Y, LIU Y L. The core-collection construction of flowerbased on AFLP molecular markers. Scientia Agricultura Sinica, 2011, 44(15): 3193-3205. (in Chinese)
[17] 艾叶, 陈璐, 兰思仁, 谢泰祥, 陈娟, 彭东辉. 基于形态学性状构建建兰品种核心种质. 分子植物育种, 2019, 17(23): 7924-7934.
AI Y, CHEN L, LAN S R, XIE T X, CHEN J, PENG D H. Construction of core collection ofvarieties based on morphological traits. Molecular Plant Breeding, 2019, 17(23): 7924-7934. (in Chinese)
[18] 周凯, 郭维明, 王智芳. 菊花不同部位水浸液自毒作用的研究. 西北植物学报, 2008, 28(4): 759-764.
ZHOU K, GUO W M, WANG Z F. Autotoxicity of aquatic extracts from different parts of. Acta Botanica Boreali- Occidentalia Sinica, 2008, 28(4): 759-764. (in Chinese)
[19] 李宝琴. 大菊品种分类研究及核心种质构建初探 [D]. 北京: 北京林业大学, 2009.
LI B Q. Classification and core construction of chrysanthemum varieties [D]. Beijing: Beijing Forestry University, 2009. (in Chinese)
[20] 张飞, 谢伟, 陈发棣, 房伟民, 陈素梅. 中国菊花品种初选核心种质的代表性检验. 南京农业大学学报, 2009, 32(2): 47-50.
ZHANG F, XIE W, CHEN F D, FANG W M, CHEN S M. Representativeness test for candidate core collection of(×) in China. Journal of Nanjing Agricultural University, 2009, 32(2): 47-50. (in Chinese)
[21] 中华人民共和国农业部. 植物新品种特异性、一致性和稳定性测试指南菊花 NY/T 2228—2012[S]. 北京: 中国农业出版社, 2013.
Ministry of Agriculture of the People's Republic of China. Guidelines for the conduct of tests for distinctness, uniformity and stability.. NY/T 2228—2012[S]. Beijing: Chinese Agriculture Press, 2013. (in Chinese)
[22] 高志红, 章镇, 韩振海, 房经贵. 中国果梅核心种质的构建与检测. 中国农业科学, 2005, 38(2): 363-368.
GAO Z H, ZHANG Z, HAN Z H, FANG J G. Development and evaluation of core collection of Japanese apricot germplasms in China. Scientia Agricultura Sinica, 2005, 38(2): 363-368.(in Chinese)
[23] 沈志军, 马瑞娟, 俞明亮, 蔡志翔, 许建兰. 国家果树种质南京桃资源圃初级核心种质构建. 园艺学报, 2013, 40(1): 125-134.
SHEN Z J, MA R J, YU M L, CAI Z X, XU J L. Establishment of peach primary core collection based on accessions conserved in national fruit germplasm repository of Nanjing. Acta Horticulturae Sinica, 2013, 40(1): 125-134. (in Chinese)
[24] HUANG C Q, LONG T, BAI C J, WANG W Q, LIU G D. Establishment of a core collection ofbased on morphological data. Tropical Grasslands-Forrajes Tropicales, 2020, 8(3): 203-213.
[25] 刘娟, 廖康, 赵世荣, 曹倩, 孙琪, 刘欢. 利用ISSR分子标记构建新疆野杏核心种质资源. 中国农业科学, 2015, 48(10): 2017-2028.
LIU J, LIAO K, ZHAO S R, CAO Q, SUN Q, LIU H. The core collection construction of Xinjiang wild apricot based on ISSR molecular markers. Scientia Agricultura Sinica, 2015, 48(10): 2017-2028. (in Chinese)
[26] 刘艳阳, 梅鸿献, 杜振伟, 武轲, 郑永战, 崔向华, 郑磊. 基于表型和SSR分子标记构建芝麻核心种质. 中国农业科学, 2017, 50(13): 2433-2441.
LIU Y Y, MEI H X, DU Z W, WU K, ZHENG Y Z, CUI X H, ZHENG L. Construction of core collection of sesame based on phenotype and molecular markers. Scientia Agricultura Sinica, 2017, 50(13): 2433-2441. (in Chinese)
[27] 张洪亮, 李自超, 曹永生, 裘宗恩, 余萍, 王象坤. 表型水平上检验水稻核心种质的参数比较. 作物学报, 2003, 29(2): 252-257.
ZHANG H L, LI Z C, CAO Y S, QIU Z E, YU P, WANG X K. Comparison of parameters for testing the rice core collection in phenotype. Acta Agronomica Sinica, 2003, 29(2): 252-257. (in Chinese)
[28] 李洪果, 杜庆鑫, 王淋, 杜红岩, 陈锡民. 利用表型数据构建杜仲雌株核心种质. 分子植物育种, 2017, 15(12): 5197-5209.
LI H G, DU Q X, WANG L, DU H Y, CHEN X M. Establishment of female core collection ofOliv. Based on phenotypic characters. Molecular Plant Breeding, 2017, 15(12): 5197-5209. (in Chinese)
[29] AN Y L, MI X Z, ZHAO S Q, GUO R, XIA X B, LIU S R, WEI C L. Revealing distinctions in genetic diversity and adaptive evolution between two varieties ofby whole-genome resequencing. Frontiers in Plant Science, 2020, 11: 603819.
[30] 齐永文, 樊丽娜, 罗青文, 王勤南, 陈勇生, 黄忠兴, 刘睿, 刘少谋, 邓海华, 李奇伟. 甘蔗细茎野生种核心种质构建. 作物学报, 2013, 39(4): 649-656.
QI Y W, FAN L N, LUO Q W, WANG Q N, CHEN Y S, HUANG Z X, LIU R, LIU S M, DENG H H, LI Q W. Establishment ofL. core collections. Acta Agronomica Sinica, 2013, 39(4): 649-656. (in Chinese)
[31] 代攀虹, 孙君灵, 何守朴, 王立如, 贾银华, 潘兆娥, 庞保印, 杜雄明, 王谧. 陆地棉核心种质表型性状遗传多样性分析及综合评价. 中国农业科学, 2016, 49(19): 3694-3708.
DAI P H, SUN J L, HE S P, WANG L R, JIA Y H, PAN Z E, PANG B Y, DU X M, WANG M. Comprehensive evaluation and genetic diversity analysis of phenotypic traits of core collection in upland cotton. Scientia Agricultura Sinica, 2016, 49(19): 3694-3708. (in Chinese)
[32] 雷刚, 周坤华, 方荣, 吴茵, 陈学军. 基于表型数据的辣椒核心种质构建研究. 西北植物学报, 2016, 36(4): 804-810.
LEI G, ZHOU K H, FANG R, WU Y, CHEN X J. Studies on the constructing of pepper core collection based on phenotypic data. Acta Botanica Boreali-Occidentalia Sinica, 2016, 36(4): 804-810. (in Chinese)
[33] 李自超, 张洪亮, 曾亚文, 杨忠义, 申时全, 孙传清, 王象坤. 云南地方稻种资源核心种质取样方案研究. 中国农业科学, 2000, 33(5): 1-7.
LI Z C, ZHANG H L, ZENG Y W, YANG Z Y, SHEN S Q, SUN C Q, WANG X K. Study on sampling schemes of core collection of local varieties of rice in Yunnan, China. Scientia Agricultura Sinica, 2000, 33(5): 1-7. (in Chinese)
[34] 刘长友, 王素华, 王丽侠, 孙蕾, 梅丽, 徐宁, 程须珍. 中国绿豆种质资源初选核心种质构建. 作物学报, 2008, 34(4): 700-705.
LIU C Y, WANG S H, WANG L X, SUN L, MEI L, XU N, CHENG X Z. Establishment of candidate core collection in Chinese mungbean germplasm resources. Acta Agronomica Sinica, 2008, 34(4): 700-705. (in Chinese)
[35] 李慧峰, 陈天渊, 黄咏梅, 吴翠荣, 李彦青, 卢森权, 陈雄庭. 基于形态性状的甘薯核心种质取样策略研究. 植物遗传资源学报, 2013, 14(1): 87-93.
LI H F, CHEN T Y, HUANG Y M, WU C R, LI Y Q, LU S Q, CHEN X T. Sampling strategies of sweet potato core collection based on morphological traits. Journal of Plant Genetic Resources, 2013, 14(1): 87-93. (in Chinese)
[36] 缪黎明, 王神云, 邹明华, 李建斌, 孔李俊, 余小林. 园艺作物核心种质构建的研究进展. 植物遗传资源学报, 2016, 17(5): 791-800.
MIAO L M, WANG S Y, ZOU M H, LI J B, KONG L J, YU X L. Review of the studies on core collection for horticultural crops. Journal of Plant Genetic Resources, 2016, 17(5): 791-800. (in Chinese)
[37] BROWN A H D. Core collections: a practical approach to genetic resources management. Genome, 1989, 31(2): 818-824.
[38] HU J, ZHU J, XU H M. Methods of constructing core collections by stepwise clustering with three sampling strategies based on the genotypic values of crops. Theoretical and Applied Genetics, 2000, 101(1): 264-268.
[39] 郭大龙, 刘崇怀, 张君玉, 张国海. 葡萄核心种质的构建. 中国农业科学, 2012, 45(6): 1135-1143.
GUO D L, LIU C H, ZHANG J Y, ZHANG G H. Construction of grape core collections. Scientia Agricultura Sinica, 2012, 45(6): 1135-1143. (in Chinese)
Construction of Core Collection of TraditionalBased on Phenotypic Traits
LI JiaWei, SU JiangShuo, ZHANG Fei, FANG WeiMin, GUAN ZhiYong, CHEN SuMei, CHEN FaDi
State Key Laboratory of Crop Genetics and Germplasm Enhancement/Key Laboratory of Landscaping, Ministry of Agriculture and Rural Affairs/College of Horticulture, Nanjing Agricultural University, Nanjing 210095
【】Exploring the optimal sampling method of constructing the core collection of traditional chrysanthemum varieties and the resulted core collection would help to facilitate the collection and preservation of traditional chrysanthemum germplasm resources.【】A collection of 2 249 traditional chrysanthemum germplasm resources, recorded in the monograph “Chinese Chrysanthemum”, were divided into eight groups according to ligulate floret color. Sixteen alternative core collections, resulted from stepwise clustering method of four overall sampling scale (5%, 10%, 15%, and 20%) and four group sampling ratio (simple ratio, logarithmic ratio, square root ratio, and diversity ratio), were compared to find the best sampling strategy for constructing core collection of traditional chrysanthemum. Consequently, the construction effects of two intra-group sampling methods (cluster and random) were further studied. The representativeness of the core collection established under the optimal method was comprehensively tested by both multiple characteristic values (minimum, maximum, mean, standard deviation, coefficient of variation, and diversity index) and evaluation parameters (percentage of mean difference, percentage of variance difference, range coincidence rate, variable rate of coefficient of variation, and phenotypic retention ratio). 【】According to flower color, each group showed a normal distribution, ensuring the uniformity of sampling; Both logarithmic ratio method and diversity ratio method could make the sampling number of each group more balanced, and had a corrective effect. The parameter values of the core collection constructed under the logarithmic ratio method reached the maximum, showing the optimal sampling ratio method. With the increase of the overall sampling size, the genetic diversity index showed a trend of increasing first and then decreasing, the variation rate of coefficient of variation continued decreasing, and the range of coincidence rate and phenotypic retention ratio continued increasing. When the sampling size was greater than 10%, the genetic diversity index and the variation rate of coefficient of variation decreased, while the range coincidence rate and phenotypic retention ratio increased slightly, it was concluded that the most suitable overall sampling size was 10%. The parameter values of the alternative core collection constructed by cluster sampling were larger than those by random sampling, indicating the better richness and uniformity of core collection by the cluster sampling method. The eigenvalues of the core collection were consistent with those of the original collection, and the several evaluation parameters showed the expected uniformity and abundance of the core collection, reflecting the phenotypic diversity. By supplementing the “chasing hug” trait lost by clustering and improving the two traits of inflorescence height and outer petal length, the core collection of 228 traditional chrysanthemum varieties was finally constructed, accounting for 10.14% of the original materials.【】Based on 15 phenotypic traits of 2 249 traditional chrysanthemum varieties, the best core collection construction method was determined after systematic comparison of alternative core collections constructed by various overall sampling size, sampling ratio method and sampling method in the group, and the representativeness of the core collection was analyzed and verified. The eigenvalues and evaluation parameters showed that the core collection constructed in this study was effective and capable of representing the genetic diversity of the original traditional chrysanthemum collection.
traditional chrysanthemum; phenotypic traits; core collection; sampling strategy; evaluation parameter

10.3864/j.issn.0578-1752.2021.16.013
2020-09-17;
2021-02-09
国家重点研发计划(2019YFD1001500)、江苏省现代农业产业技术体系建设项目(JATS[2020]281)
李嘉伟,E-mail:2018104101@njau.edu.cn。通信作者管志勇,E-mail:guanzhy@njau.edu.cn
(责任编辑 赵伶俐)
