长链非编码RNA组蛋白去乙酰化酶3通过哺乳动物雷帕霉素靶蛋白信号通路调控肝癌细胞增殖、迁移侵袭和凋亡
2021-09-02陈斌王猛张囡囡
陈斌,王猛,张囡囡
作者单位:1枣庄矿业集团中心医院肝病科,山东 枣庄277000;2枣庄市市中区人民医院感染性疾病科,山东 枣庄277000
肝癌是世界上常见的一种恶性肿瘤,其发病率居所有癌症第五位,致死率居所有癌症第二位。由于肝癌的发病隐匿,一旦确诊已至晚期,并且极易发生转移,以致其致死率极高。因此,研发有效的治疗药物对肝癌病人具有重要意义。组蛋白去乙酰化酶3(histone deacetylase 3,HDAC3)具有抑制组蛋白发生乙酰化和基因转录的作用,其在肿瘤中过度表达导致抑癌基因表达下调,以促进肿瘤的发展。组蛋白去乙酰化酶3在很多肿瘤中均表现出表达异常升高,其中包括肝癌,令人遗憾的是其在肝癌细胞的细胞表型变化中的作用尚未十分清楚。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种高度保守且广泛表达于哺乳动物中的丝/苏氨酸蛋白激酶,归属于磷脂酰肌醇3-激酶相关激酶(phosphatidylinositol 3-kinase related kinase,PIKK)家族。mTOR信号通路抑制剂在癌症的临床治疗中已得到普遍应用,但是该通路是否参与HDAC3在肝癌中的功能机制尚未完全清楚。本研究于2018年9月至2019年5月拟以肝癌细胞SK-Hep1为研究对象,检测其中HDAC3的表达,观察敲减HDAC3、激活mTOR信号通路对肝癌细胞增殖、迁移、侵袭和凋亡的影响,以期揭示其机制可能与敲减HDAC3抑制mTOR信号通路活性相关,为肝癌的治疗提供新思路。
1 材料与方法
1.1 材料
正常肝细胞细胞系CVCL_SA11 MIHA、肝细胞癌细胞细胞系CVCL_0525 SK-Hep1均购自美国菌种保藏中心(ATCC);DMEM购自Hyclone公司;胎牛血清购自杭州四季青;CCK-8试剂盒购自美国sellect公司;Lipofectamine2000、RNA抽提试剂盒、逆转录试剂盒购自日本TaKaRa公司;mTOR信号通路抑制剂MHY1485购自美国AbMole公司;聚偏二氟乙烯(PVDF)膜购自德国罗氏公司;ECL发光液购自北京雷根生物公司;RIPA蛋白裂解液均购自碧云天公司;Transwell小室购自美国Corning公司。1.2 方法
1.2.1
细胞培养将SK-Hep1细胞和MIHA细胞用DMEM培养基(含10%胎牛血清)在5%二氧化碳,37℃细胞培养箱中正常培养,每2~3天传代1次。1.2.2
细胞转染与分组把正常培养的对数期肝细胞癌细胞SK-Hep1和肝正常细胞MIHA标记为SK-Hep1组、MIHA组;使用脂质体试剂盒Lipofectamine2000将si-NC、si-HDAC3(购自上海吉玛公司)、si-HDAC3+DMSO、si-HDAC3+MHY1485转染至SK-Hep1细胞,48 h后,实时荧光定量逆转录聚合酶链反应(qRT-PCR)检测转染效率(按照“1.2.3”的方法操作,检测各组细胞中HDAC3的表达水平,以检测转染是否成功)。1.2.3
qRT-PCR法检测细胞 中HDAC3的mRNA表达收集si-NC组、si-HDAC3组、si-HDAC3+DMSO组、si-HDAC3+MHY1485组细胞,提取RNA,逆转录为互补DNA(cDNA)。qRT-PCR检测试剂盒检测各个样本中HDAC3 mRNA的含量。计算方法,以甘油醛-3-磷酸脱氢酶(GAPDH)为内参,2法计算HDAC3的相对表达。引物信息(5'-3'):HDAC3,正向引物GCTGCTGGACATATGAGAC,反向引物TGCCTCTGGCCTGCTATA;GAPDH,正 向 引 物GCACCGTCAAGGCTGAGAAC,反向引物ATGGTGGTGAAGACGCCAGT。1.2.4
CCK-8法检测细胞增殖取对数生长期的si-NC组、si-HDAC3组、si-HDAC3+DMSO组、si-HDAC3+MHY1485组细胞,将其调整为10个/毫升,取100 μL加入到96孔板,培养24 h。然后加入20 μL的CCK-8溶液,在490 nm波长下检测吸光度。吸光度与细胞增殖能力成正比。
1.2.5
Transwell小室检测细胞迁移侵袭为了检测si-NC组、si-HDAC3组、si-HDAC3+DMSO组、si-HDAC3+MHY1485组细胞的迁移和侵袭能力,使用未铺基质胶、铺有基质胶的Transwell小室分别检测细胞迁移、侵袭能力,二者的操作步骤相同。具体操作方法如下:将细胞先用无血清培养基培养24 h,调整细胞至10个/毫升,取200 μL均匀缓慢注入上室聚碳酸酯膜,600 μL含血清培养基加入下室,培养箱培养24 h。擦下上室聚碳酸酯膜表面细胞。甲醇固定,结晶紫染色。最后,用湿棉签擦去膜上表面剩余的细胞,再用镊子轻轻取下聚碳酸酯膜,使其下表面朝上,进行载玻片封片。用显微镜400倍观察细胞的数量,随机选取5个视野,拍照计数,取平均值。1.2.6
膜联蛋白V-异硫氰酸荧光素(Annexin VFITC)/碘化丙啶(PI)双染检测细胞凋亡收集si-NC组、si-HDAC3组、si-HDAC3+DMSO组、si-HDAC3+MHY1485组细胞,用200 μL结合缓冲液悬浮。先加入5 μL的Annexin V-FITC,避光孵育15 min,然后加入5 μL的PI,结束染色后,立即上机,检测分析凋亡情况。细胞的凋亡率(%)=早期凋亡率+晚期凋亡率。每个样品重复3次,实验重复3次。1.2.7
蛋白质印迹法(Western blotting)检测细胞中Akt激酶、4E-BP1、p-S6K1、S6K1蛋白表达收集si-NC组、si-HDAC3组、si-HDAC3+DMSO组、si-HDAC3+MHY1485组细胞,用RIPA裂解液裂解,BAC法进行定量,100℃水浴变性,12 000 r/min离心10 min,取上清。然后将准备好的浓缩胶、分离胶小心拔出梳子,取50 μL进行上样,电泳后,将蛋白转至PVDF膜上。转膜过程需要注意的是整个仪器和环境需要保持0~4℃的低温状态。转膜结束后,用2.5
%的脱脂奶粉进行封闭,洗膜。将膜浸入500~1 500倍稀释的各个一抗反应液中孵育过夜。次日,先进性洗膜,然后将膜转移至稀释过的二抗反应液中4℃孵育2 h,洗膜。最后,进行显影、定影和曝光,整个过程需在暗室中进行。用Image J分析条带的灰度值,以目的条带灰度值与GAPDH灰度值的比值表示目的蛋白的表达。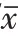
2 结果
2.1 HDAC3在肝癌细胞中的表达
与MIHA组比较,SK-Hep1组细胞中HDAC3的表达异常升高[(1.00±0.06)比(4.38±0.34),t
=29.370,P
<0.001]。可见,HDAC3在肝癌细胞中高表达。2.2 敲减HDAC3的肝癌细胞
与si-NC组比较,si-HDAC3组SK-Hep1细胞 中HDAC3 mRNA的 表达异常降低[(0.32±0.03)比(1.01±0.07),t
=27.180,P
<0.001]。提示,成功构建敲减HDAC3的肝癌细胞。2.3 敲减HDAC3对肝癌细胞增殖、迁移侵袭和凋亡的影响
结果如表1所示,与si-NC组比较,si-HDAC3组SK-Hep1细胞在48、72h细胞活性显著降低,迁移细胞数和侵袭细胞数均显著降低,细胞凋亡率显著升高(P
<0.05)。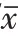
表1 敲减组蛋白去乙酰化酶3(HDAC3)对肝癌细胞增殖、迁移侵袭和凋亡的影响/±s
2.4 敲减HDAC3对肝癌细胞中mTOR信号通路活性的影响
结果如图1和表2所示,与si-NC组比较,si-HDAC3组SK-Hep1细胞中Akt激酶、4E-BP1、p-S6K1蛋白表达均显著降低(P
<0.001),S6K1蛋白表达差异无统计学意义(P
>0.05)。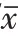
表2 敲减组蛋白去乙酰化酶3(HDAC3)的肝癌细胞哺乳动物雷帕霉素靶蛋白(mTOR)信号通路相关蛋白的表达/±s

图1 敲减组蛋白去乙酰化酶3(HDAC3)的肝癌细胞哺乳动物雷帕霉素靶蛋白(mTOR)信号通路相关蛋白的表达
2.5 激活mTOR信号通路对敲减HDAC3抑制肝癌细胞增殖、迁移侵袭和促进凋亡的影响
结果如表3所示,与si-HDAC3+DMSO组相比,si-HDAC3+MHY1485组SK-Hep1细胞中HDAC3表达显著升高,在48、72 h细胞活性显著升高,迁移细胞数和侵袭细胞数均显著升高,细胞凋亡率显著降低(P
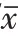
表3 激活哺乳动物雷帕霉素靶蛋白(mTOR)信号通路对敲减组蛋白去乙酰化酶3(HDAC3)抑制肝癌细胞增殖、迁移侵袭和促进凋亡的影响/±s
<0.05)。
3 讨论
HDAC3在细胞周期调节中起关键作用,并且其在胰腺癌、乳腺癌、淋巴瘤中均表现出失调,也包括肝细胞癌。Lu等在肝癌的研究中报道,敲除HDAC3后能够明显损害肝脏再生和肝细胞增增,过表达HDAC3与肝癌的生长和预后不良紧密相关,敲减HDAC3则可以抑制肝癌的生长。Wu等研究报道,HDAC2在肝癌病人的肿瘤组织中表达异常升高,并且其可通过激活Hedgehog信号通路加重肝癌病人的恶性化进程。由此可见,HDAC3在肝癌发生发展中的重要作用。我们运用检测了肝癌细胞中HDAC3的表达发现其异常升高,这与前人的研究结果相一致。进一步研究,我们建立敲减HDAC3的肝癌细胞,并通过CCK-8、Transwell小室、流式细胞术检测细胞的增殖、迁移、侵袭和凋亡发现,敲减HDAC3后,肝癌细胞的增殖、迁移、侵袭均被抑制,细胞的凋亡得到促进,这揭示了HDAC3对肝癌细胞表型变化的调控作用。进一步研究发现,敲减HDAC3可抑制肝癌细胞中mTOR信号通路的活性,因此我们认为HDAC3在肝癌中的功能可能与该通路具有一定的相关性。
研究发现,mTOR信号通路在人类多种癌症发生异常。矮甘草皂苷单体13(DT-13)在体外通过激活AMP活化蛋白激酶(AMPK)并抑制m-TOR来阻断结直肠癌肿瘤生长。mTOR/p70S6K通路在卵巢癌中被激活。卡铂可迅速mTOR表达,使卵巢癌细胞阻滞在G0/G1期,并诱导细胞凋亡。过表达微小RNA-1(miR-1)可通过靶向下调原癌基因c-Met,调控Akt/mTOR信号通路来抑制前列腺癌细胞的存活和增殖。大量研究报道,mTOR信号通路在肝癌的发生、发展、诊断治疗中均具有重要的调控作用。Malakar等报道,在肝癌中抑制mTOR的活性能够逆转原癌基因MALAT1对肝癌的致癌特性。我们研究发现,敲减HDAC3能够抑制肝癌细胞中mTOR信号通路相关基因Akt、4E-BP1、p-S6K1的蛋白表达,揭示敲减HDAC3能够抑制肝癌中mTOR信号通路的活性,此结果为探索肝癌中HDAC3发挥作用的功能机制的研究提供了依据。激活mTOR信号通路能够部分逆转敲减HDAC3的抑制肝癌细胞的细胞表型恶性化发展的作用。不仅敲减HDAC3能够抑制mTOR信号通路的活性,激活mTOR信号通路也能够逆向调控HDAC3的表达和功能。这为HDAC3在肝癌的诊断、基因治疗和靶向治疗中的应用提供了依据。
基于本研究结果,认为长链非编码RNA HDAC3抑制肝癌细胞的增殖、迁移、侵袭,促进凋亡,其机制与可能失活mTOR信号通路相关。
