四川猪传染性胸膜肺炎放线杆菌耐药基因流行规律与表型相关性研究*
2021-09-01王佳凡郑博文马晓平曹三杰黄小波
王佳凡,郑博文,杨 超,2,马晓平 ,曹三杰,黄小波
(1.四川农业大学 动物医学院 猪病研究中心,四川 成都 611130;2.四川水利职业技术学院 生物工程系,四川 成都 611231)
猪肉是目前世界上最常消费的肉类产品之一。随着养猪业规模化和集约化的发展,呼吸系统疾病的经常性发生给养猪业造成重大的经济损失[1-2]。猪传染性胸膜肺炎(porcine pleuropneumonia)是猪最重要的呼吸系统疾病之一,由胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)引起。APP 属于巴氏杆菌科放线杆菌属,为革兰氏阴性球杆菌,有荚膜。根据APP 生长对烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)的依赖性,将其分为生物Ⅰ型和生物Ⅱ型[3]。
目前,根据荚膜多糖的抗原特性将该物种分为18 种血清型[4]。不同国家和地区的优势血清型不同,且不同血清型的毒力和免疫原性也存在差异。国内流行的血清型主要以1、3、5 和7 型为主[5-6]。目前,动物源细菌耐药形势极其严峻,细菌耐药研究已成为全球公认的热点,多重耐药菌及耐药基因的传播给食品安全和公众健康造成了巨大风险。由于抗菌药物的滥用,导致APP 对抗菌药物产生了不同程度的耐药性,耐药菌株的产生导致该疾病防控困难。因此在治疗时应结合药敏试验结果来选择抗菌药物。
本研究以病猪为研究对象,采集病变组织,通过常规方法进行分离细菌的鉴定,对分离株进行药物敏感性试验,用PCR 方法检测分离菌所携带的耐药基因,为该地区养猪场猪的呼吸道疾病防控和药物治疗提供依据。
1 材料与方法
1.1 材料
1.1.1 病料来源
病料来源于四川省18 个规模化养猪场疑似猪传染性胸膜肺炎发病猪肺脏组织。
1.1.2 主要培养基及试剂
PPLO 固体培养基和PPLO 肉汤培养基均购自青岛海博生物技术有限公司;酵母粉(YEAST EXTRACT)购自Oxoid 公司;AGAR (琼脂粉)购自北京沃比森科技有限公司;氧化型辅酶I (NAD)购自上海瑞永生物科技有限公司;Agarose (琼脂糖)购自成都市科隆化学品有限公司;标准小牛血清购自北京平睿生物科技有限公司;革兰氏染液购自北京索莱宝科技有限公司;微量生化反应试剂和药敏纸片均购自杭州微生物试剂有限公司。DL2000 DNA Marker、2×PCR MasterMix、细菌基因组DNA 提取试剂盒均购自宝生物工程(大连)有限公司。
1.1.3 药敏纸片
药敏试验受试药物总共有9 大类18 种:氨苄西林、阿莫西林、头孢氨苄、头孢曲松、红霉素、盐酸克林霉素、盐酸林可霉素、复方新诺明、链霉素、庆大霉素、卡那霉素、四环素、多西环素、氯霉素、氟苯尼考、诺氟沙星、环丙沙星和萘啶酸。
1.2 方法
1.2.1 细菌分离培养及形态观察
无菌采集病死猪肺脏病料,使用接种环无菌划线接种于PPLO 固体培养基(含0.01% NAD)上,置于5% CO2培养箱中37 ℃培养24 h,观察记录细菌菌落的形态特征。挑取可疑单个菌落进行纯化培养。对纯化培养后的单个菌落涂片进行革兰氏染色,并在显微镜下进行观察。
1.2.2 生化鉴定试验
无菌挑取纯化培养的单个菌落分别接种于添加NAD 的微量生化反应管中,37 ℃培养24 h,按照说明书鉴定。
1.2.3 PCR 分子鉴定
根据文献[7]合成1 段ApxⅣ毒素基因的特异性引物:F:5′-TTATCCGAACTTTGGTTTAGCC-3′,R:5′-CATATTTGATAAAACCATCCGTC-3′。预期片段长度为418 bp,该引物由上海生工生物工程股份有限公司合成。用水煮模板法提取DNA 作为模板,PCR反应体系40 μL:2×TaqMix 酶20.0 μL,上下游引物各2.0 μL,DNA 模板2.0 μL,ddH2O 16.0 μL。PCR 反应条件:95 ℃5 min;95 ℃ 45 s,55 ℃ 30 s,72 ℃ 1 min,32 个循环;72 ℃ 10 min。经1%琼脂糖凝胶电泳后,阳性PCR 产物回收,送至北京六合华大基因科技有限公司测序。
1.2.4 同源性及进化树分析
将测序结果在GenBank 进行BLAST。选取NCBI 中与猪传染性胸膜肺炎放线杆菌同源性相近的几条序列,用MEGA-X 软件对选取的序列进行编辑,并构建系统进化树分析结果。
1.2.5 药敏试验
采用K-B 药敏纸片法,将菌株纯培养物制成含菌量约为5×107~5×108CFU/mL 菌悬液,用灭菌棉签均匀涂布于PPLO 固体培养基上,选取18 种抗生素的药敏纸片贴于培养基上,置于37 ℃培养箱,培养16~18 h,测量抑菌圈直径。药敏结果按照CLSI 2013 年M100 S23 规定的药敏折点[8],判定耐药(R)、中度(I)或敏感(S)。
耐药率=对某种抗菌药耐药的菌株数/总菌株数×100%。
1.2.6 耐药基因的检测
利用试剂盒提取细菌基因组总DNA 作为PCR 反应模板,用核酸蛋白分析仪(Eppendorf 公司)测定含量,并以OD260/280评价其纯度,于-20 ℃保存备用。
根据细菌耐药情况及参考相关文献[9-16]报道,设计合成6 类20 种耐药基因的检测,包括:大环内酯类和林可酰胺类mefA、ermA和ermB基因;磺胺类sul1、sul2和sul3基因;氨基糖苷类aac(6′)-Ie-aph(2″)-Ia、aph(2″)-Ib、aph(2″)-Ic、aph(2″)-Id、aph(3″)-IIIa和ant(6′)-Ia基因;四环素类tetA、tetB、tetC、tetM和tetX基因;氯霉素类floR、cat1 和cmlA基因。引物序列见表1。
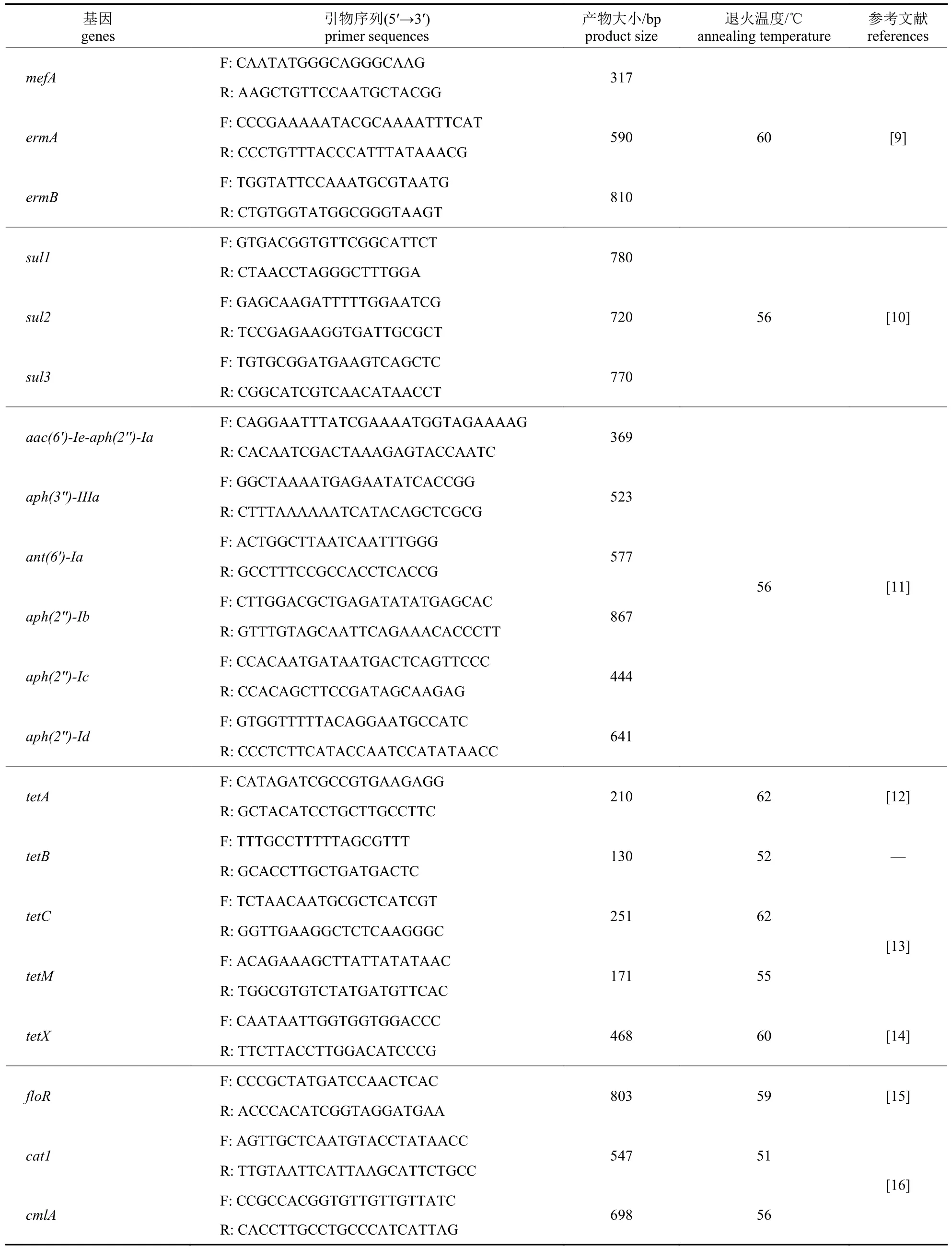
表1 耐药基因引物序列Tab.1 The primer sequences of dug-resistant genes
PCR 扩增反应体系(20 μL):2×TaqPCR Master Mix 10 μL,上、下游引物各1 μL,DNA 模板2 μL,灭菌超纯水6 μL。PCR 操作按说明书进行。PCR 产物在1%琼脂糖凝胶中电泳后用凝胶成像仪成像分析,将目的片段进行胶回收并送生工生物工程(上海)有限公司测序。
2 结果与分析
2.1 细菌分离结果
平板上分离出圆形、小而透明的露珠样黏液型菌落(图1),革兰氏染色结果为革兰氏阴性菌,多成短杆状,两极着色明显(图2)。

图1 菌落形态)Fig.1 Colony morphology

图2 革兰氏染色镜检结果(1 000 ×))Fig.2 Gram staining microscopic examination results
2.2 生化鉴定结果
11 株APP 分离菌株均能发酵葡萄糖和果糖,不能发酵乳糖和山梨醇,部分菌株可发酵甘露醇,氧化酶、过氧化氢酶、尿素酶和硝酸盐还原酶试验结果均为阳性,VP 试验为阴性反应。生化试验结果与猪传染性胸膜肺炎放线杆菌的生化特性一致(表2),初步确定为猪传染性胸膜肺炎放线杆菌。

表2 11 株APP 分离株的生化鉴定结果Tab.2 Biochemical identification results of 11 APP isolates
2.3 分离株PCR 鉴定结果
采用ApxⅣ毒素基因的特异性引物对分离菌株和标准菌株进行PCR 扩增,均获得预期长度(418 bp)的特异性条带(图3),测序结果在NCBI中进行BLAST 比对,与ApxⅣ毒素基因(GenBank登录号:AX002405)的同源率达99%以上。
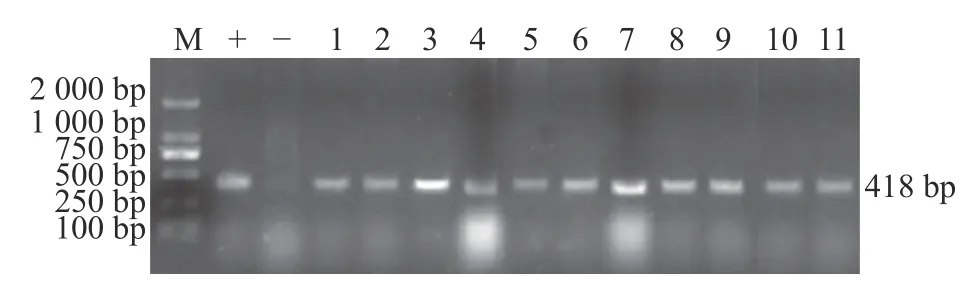
图3 分离株PCR 扩增结果)Fig.3 PCR amplification results of isolates
2.4 同源序列及系统进化分析
将11 株菌的测序结果在NCBI 上比对,挑选9 株核苷酸同源性较高的参考菌株进行序列同源性分析和系统发育分析,参考菌株为APP 加拿大分离株L20 (CP000569.1)、APP 德国分离株AP76 (CP001091.1)、APP 英国分离株MIDG2331(LN908249.1)、APP 美国分离株NCTC11384 (LS-483358.1)、APP 丹麦分离株NCTC10976 (LR13 4515.1)、APP 阿根廷分离株S4074 (CP030753.1)、APP 中国分离株ADOD (CP029003.1)、APP 南韩分离株KL16 (CP022715.1)和APP 中国分离株JL03 (CP000687.1),结果见图4。分离菌株与已发表的9 株猪传染性胸膜肺炎放线杆菌序列同源性在98%~100%之间,系统进化分析结果表明:APP 四川分离株SC1811、SC1810 和SC1809 进化关系较近;SC1808 与APP 中国分离株JL03 亲缘关系比较近,聚成一簇,并与SC1803 处于同一分支;SC1806、SC1805 和SC1801 进化关系较近,并且与APP 阿根廷分离株S4074、中国分离株ADOD 和南韩分离株KL16 处于同一分支;SC1804 和SC1802 与APP 丹麦分离株NCTC1097进化关系较近;SC1807 与APP 加拿大分离株L20、德国分离株AP76 和英国分离株MIDG2331进化关系相近。可进一步证明11 株分离株为猪传染性胸膜肺炎放线杆菌。

图4 APP 分离菌株系统进化关系)Fig.4 Phylogenetic relationship of APP isolated strains
2.5 药敏试验结果
药敏试验结果显示:分离的11 株菌对氨苄西林、阿莫西林、头孢氨苄、头孢曲松、诺氟沙星、环丙沙星和萘啶酸敏感,对四环素、多西环素、盐酸林可霉素、复方新诺明和链霉素等不同程度耐药(表3)。其中对盐酸林可霉素、复方新诺明、链霉素、四环素和多西环素耐药率都超过了50%。
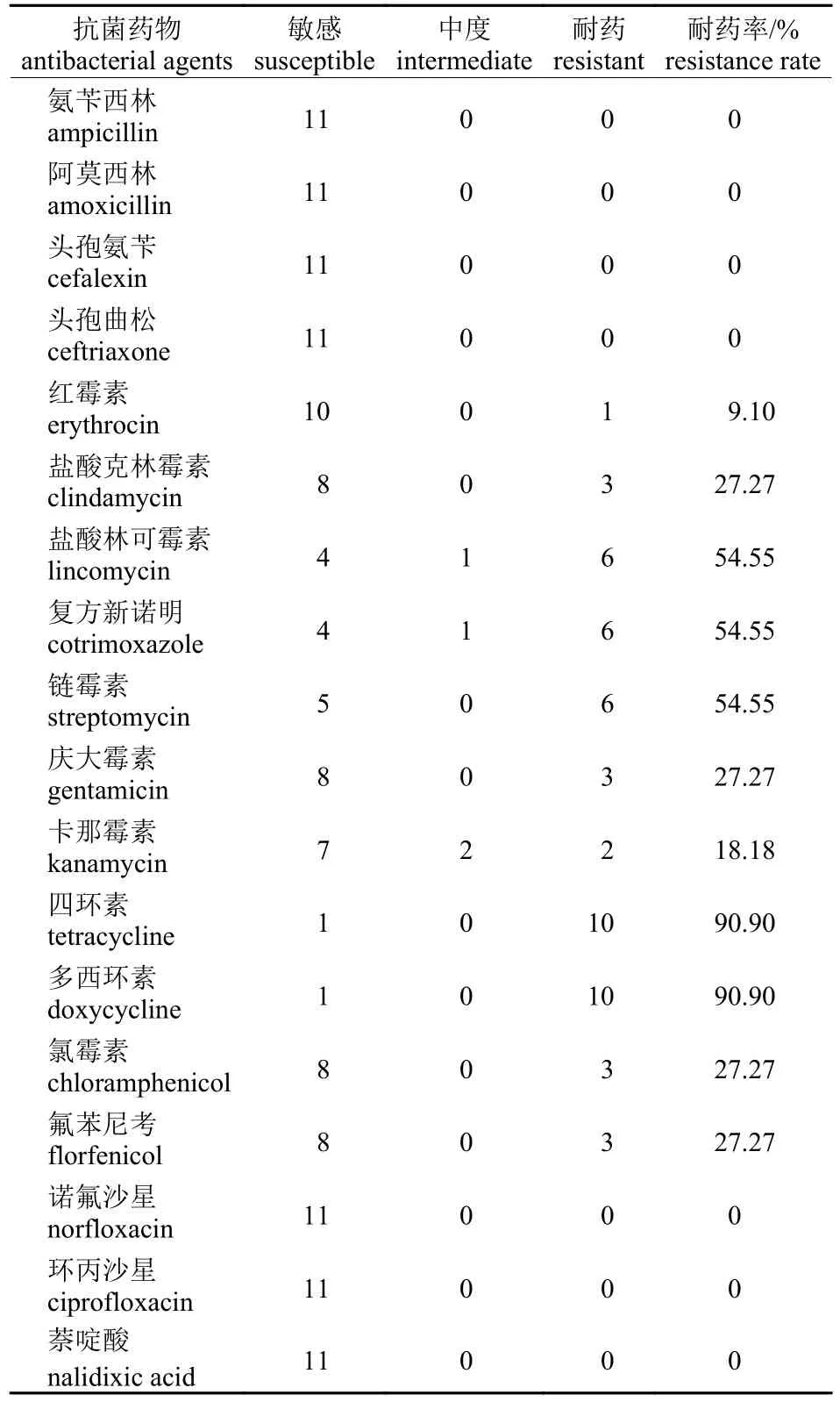
表3 APP 临床分离株的药物敏感性Tab.3 Antimicrobial susceptibility of APP clinical isolates
2.6 耐药基因的PCR 扩增结果
利用PCR 检测方法,通过对11 株菌株进行主要耐药基因检测。11 株APP 中磺胺类sul3基因携带率最高,为100% (6/6),而sul1和sul2基因未检测出;四环素类中tetC基因携带率最高,为100% (10/10),tetB基因携带率为40.0% (4/10),tetA、tetM和tetX基因未检测出;氨基糖苷类中ant(6′)-Ia基因携带率最高,为85.7% (6/7),aph(2″)-Id和aac(6′)-Ie-aph(2″)-Ia基因携带率均为14.3% (1/7),aph(3″)-IIIa、aph(2″)-Ib和aph(2'')-Ic基因未检测出;氯霉素类中floR基因携带率最高,为100% (3/3),cat1和cmlA均未检测出;大环内酯类和林可酰胺类中ermB基因检出率分别为100% (1/1)和16.7% (1/6),mefA和ermA基因均未检测出。凝胶电泳结果见图5、6,耐药谱和耐药基因携带情况见表4。

表4 11 株分离株耐药谱和耐药基因携带情况Tab.4 Drug resistance spectrum and resistance genes carrying status of 11 isolates

图5 耐药基因的PCR 扩增结果)Fig.5 PCR amplification results of drug resistance genes

图6 耐药基因的PCR 扩增结果)Fig.6 PCR amplification result of resistant genes
3 讨论
本研究对四川地区部分养猪场呼吸系统疾病进行诊断,通过实验室检测确诊该病原为猪传染性胸膜肺炎放线杆菌。试验只分离出11 株APP,总体分离率比较低。本研究在对分离株的形态、生长特性和生化特征进行分离鉴定的基础上,采用ApxⅣ毒素基因的特异性基因序列同源性分析进行细菌的分子鉴定。经过BLAST 比对,分离菌株与猪传染性胸膜肺炎放线杆菌的同源性达99%以上,进一步证实分离的11 株菌均为猪传染性胸膜肺炎放线杆菌,同源性比对和进化树结果显示:11 株APP 和9 个代表菌株的同源性为98%~100%。进化树中分离菌株SC1808与APP 中国分离株JL03 聚成一簇,亲缘关系较近;SC1806、SC1805 和SC1801 与APP 中国分离株ADOD 处于同一分支,亲缘关系近;其余分离株与不同国家APP 分离株有不同的进化关系。这表明20 株猪传染性胸膜肺炎放线杆菌可能由于在地理位置上分布广,没有展现出明显的地域特性和物种特性。
综合国内外药敏试验结果显示:国外临床分离的菌株多对头孢类、大环内酯类、喹诺酮类和氯霉素类的氟苯尼考敏感,对氨基糖苷类、磺胺类和四环素类耐药[17-21],国内临床分离的菌株与国外存在一致性[22-27]。本试验分离的11 株菌均对β-内酰胺类和喹诺酮类药物敏感,对四环素类药物高度耐药,耐药率高达90.90%;对盐酸林可霉素、复方新诺明和链霉素比较耐药,耐药率达到54.55%;对庆大霉素、氯霉素、氟苯尼考和盐酸克林霉素耐药率为27.27%;对红霉素和卡那霉素耐药率为分别为9.10%和18.18%;对氨苄西林、阿莫西林和头孢曲松等7 种抗菌药物敏感,与已有研究报道结果大体相似但存在差异,以上几类药物可为临床治疗提供参考。本次共检测了大环内酯类和林可胺类(ermA、ermB和mefA)、磺胺类(sul1、sul2和sul3)、四环素类(tetA、tetB、tetC、tetM和tetX)、氨基糖苷类[aac(6′)-Ie-aph(2″)-Ia、ant(6′)-Ia、aph(3″)-IIIa、aph(2'')-Ib、aph(2″)-Ic和aph(2″)-Id]和氯霉素类(floR、cat1和cmlA) 20 种耐药基因。耐药基因检出结果显示:检出率最高的sul3、tetC、ant(6')-Ia、floR和红霉素中的ermB基因耐药率分别为100%、100%、85.7%、100%和100%。耐药基因tetB、aph(2'')-Id、aac(6')-Ie-aph(2'')-Ia和林可胺类中的ermB检出率分别为40.0%、14.3%、14.3%和16.7%,结合药敏试验结果发现耐药基因检出结果与耐药结果基本一致,表明耐药基因的携带是细菌对抗菌药物产生耐药的主要原因之一。值得注意的是,林可胺类药物耐药基因只检测出ermB且只有16.7%,可能存在其他未检测的耐药基因(如lin),甚至存在新的耐药机制。耐药表型间的相关性也可以指导临床用药,减少多重耐药株的出现。
猪传染性胸膜肺炎放线杆菌不同的血清型之间的药物敏感性存在差异,即使是同一血清型,来自不同地区的不同菌株对同一种药物的敏感性也有很大差异,故临床用药要根据分离菌株药敏试验结果采取针对性的防治措施。总之,病原菌的耐药机制十分复杂,耐药性已经严重威胁到人类和动物的生命安全。通过研究抑制耐药性的产生和阻断耐药机制,才能真正地防治猪传染性胸膜肺炎放线杆菌疾病。
4 结论
本研究对四川地区部分猪场呼吸系统疾病猪进行诊断,通过检测确诊该病原为猪传染性胸膜肺炎放线杆菌。药敏试验结果显示:11 株APP对四环素和多西环素耐药率高达90.90%;对盐酸林可霉素、复方新诺明和链霉素耐药率均为54.55%;对盐酸林可霉素、庆大霉素、氯霉素和氟苯尼考耐药率均为27.27%;对卡那霉素和红霉素耐药率分别为18.18%和9.10%;对氨苄西林、阿莫西林和头孢曲松等7 种抗菌药物敏感。同时携带多重耐药基因,以sul3、tetB、tetC、ant(6')-Ia和floR基因为主。该研究将为该病的防治提供科学依据。
