脱硫废水蒸发过程中HCl 释放特性试验1
2021-09-01刘峰均董伟钢杨林军冯永新
刘峰均, 董伟钢, 杨林军, 赵 宁, 冯永新
(1. 能源热转换及其过程测控教育部重点实验室(东南大学), 江苏 南京 210096;2. 绍兴市生态环境局柯桥分局, 浙江 绍兴 312000;3. 广东电科院能源技术有限责任公司, 广东 广州 510080)
1 前 言
目前,燃煤电厂脱硫方式以石灰石-石膏湿法脱硫(wet flue gas desulfurization,WFGD)为主[1-2],湿法脱硫过程中为了防止Cl-质量浓度过高影响脱硫效果以及对管道的腐蚀需要通过定期更换部分脱硫浆液维持脱硫浆液中Cl-质量浓度在20 000 mg·L-1以下[3],这个过程形成了大量的脱硫废水,脱硫废水的排放量为15~20 kg·(MW·h)-1[4]。脱硫废水的水质受到煤种及脱硫系统运行参数等因素的影响,一般呈弱酸性,其中悬浮物浓度、重金属含量、总可溶性固体(total dissolved solids,TDS)浓度、化学需氧量(chemical oxygen demand,COD)普遍较高,经三联箱处理后的水质稍有改善,但水质依然较差[5]。现阶段,关于脱硫废水处理比较主流的技术有主、旁烟道蒸发技术和旋转喷雾干燥技术,都是在除尘前通过中高温热烟气对雾化的脱硫废水液滴进行蒸发从而实现脱硫废水零排放[1,6-7]。脱硫废水含有大量的Cl-,在脱硫废水蒸发的过程中,Cl-会转化生成HCl 释放到气相[8],之后随烟气进入除尘设备和脱硫系统,绝大部分HCl 又会被脱硫浆液吸收导致浆液中Cl-质量浓度的增加,因此研究脱硫废水中Cl-转化生成HCl 的机理和规律十分必要,从而探寻抑制Cl-转化生成HCl 的措施。Cui 等[9]采用喷雾干燥系统研究发现,提高脱硫废水的pH值可以抑制HCl 的生成。周正[10]采用MgCl2、CaCl2配制的模拟脱硫废水研究发现烟气温度、脱硫废水中Cl-浓度对HCl 的释放比例存在一定的影响。Ma 等[11]采用MgCl2、CaCl2、NaCl 配制的模拟脱硫废水研究发现,脱硫废水TDS 浓度的增大会导致HCl 释放比例略有降低。
综上,关于脱硫废水蒸发过程中HCl 的生成机理和规律虽都有相应的研究,但不够全面,且绝大部分规律是采用模拟脱硫废水实验得出的结论。本研究通过蒸发脱硫废水低温蒸发产物对应氯盐结晶盐,探讨不同蒸发温度下不同氯盐结晶盐的HCl 释放规律,了解脱硫废水蒸发过程中HCl 释放的机理;之后通过电厂实际脱硫废水,探究蒸发温度、TDS、脱硫废水pH 值、Cl-浓度等对HCl 释放的影响。
2 实验系统与方法
2.1 实验系统
如图1 所示为脱硫废水蒸发实验系统,主要有供气系统、样品蒸发系统、HCl 采集系统3 部分组成。供气系统主要为小流量空气供气泵,其体积流量控制在0.8 L·min-1,在实验过程中起到载气的作用;样品蒸发系统主要由KXS-2.4 数显电砂浴锅、三颈烧瓶、保护管材质为Incone600的K型温度传感器及其显示器、冷凝管组成,其中温度传感器探头布置于烧瓶底部用以检测析出盐分的温度,实验温度以K 型热电偶温度显示器的读数为准,空气冷凝管的作用是为了防止被加热溶液在高温下沸腾导致未蒸发液滴被夹带进入吸收液中引起的实验误差,在溶液基本蒸发后,用石棉保温三颈烧瓶和空气冷凝管使壁面上少许的液体蒸发;HCl 采集系统主要由冰浴槽、含KOH吸收液的吸收瓶组成。系统中各管线及烧瓶塞采用耐高温耐酸碱腐蚀的硅胶材质。
2.2 实验及测试方法
实验开始前,先称量三颈烧瓶的质量并记录,再取一定量的样品于250 mL 三颈烧瓶中,之后连接管线,将烧瓶放置于已到达预定温度的电砂浴锅中,实验过程中观察温度传感器的读数,当读数到达实验温度后再继续加热10 min,之后将烧瓶取出并保持空气供气泵开启,当温度读数低于60 ℃时,关闭空气供气泵并断开管路。之后对三颈烧瓶出口管路的石英弯头、硅胶管残余的液体及吸收瓶中的吸收液进行收集处理后采用Dionex 生产的ICS-2100 型离子色谱仪测试其Cl-浓度;三颈烧瓶放在干燥皿中冷却至室温对其进行称重。部分实验蒸干后的固相产物进行XRD 分析测试其组分。
2.3 脱硫废水水质
取自2 个电厂三联箱后的脱硫废水,其主要水质参数见表1,表中ρB为质量浓度。

表1 脱硫废水水质参数Table 1 Quality parameters of desulfurization wastewater
3 结果与分析
3.1 不同氯盐的HCl 释放规律
脱硫废水中Cl-在蒸发过程中会与不同的阳离子结合析出不同的氯盐或氯盐结晶水合物(统称氯盐),而这些氯盐的热稳定性不同,在蒸发过程中转化生成HCl 的反应条件也不同[12]。由于脱硫废水自由水分在蒸发的过程中处于沸腾状态,液体温度保持在沸点温度[13],因此实验先取2 种脱硫废水在100 ℃下蒸发,对固相产物进行XRD 分析,结果如图2 所示。从图中可以看出,脱硫废水蒸发析出的氯盐主要有MgCl2·6H2O、NaCl,还有少量的CaCl2·6H2O。脱硫废水在采用旁路热烟气蒸发法处理时,烟气温度一般在280~360 ℃,而这些烟气与雾化的脱硫废水液滴接触传热后,烟气温度会有一个明显的下降,烟气温度为150~300 ℃[1,6],根据传热学原理[14],脱硫废水蒸发后析出的盐分被加热的温度为150~300 ℃,因此选取150、200、250、300 ℃ 4 个温度梯度考察MgCl2·6H2O、CaCl2·6H2O、NaCl 晶体分解产生HCl的机理。

图2 100 ℃脱硫废水固相蒸干产物XRD 图谱Fig.2 XRD patterns of solid-phase products of desulfurization wastewater after 100 ℃ evaporation
3.1.1 氯盐结晶盐的HCl 析出
分别称取5 g 的MgCl2·6H2O、CaCl2·6H2O、NaCl 晶体于三口烧瓶中,在150、200、250、300 ℃ 4个温度下进行蒸发实验,实验结果如图3 所示,其中,w(HCl)为HCl 析出质量占比,t为蒸发温度。随着蒸发温度升高,MgCl2·6H2O 晶体对应的HCl 析出占比增大明显,从0.37% 增至36.35%;CaCl2·6H2O晶体对应的HCl 析出占比较小,随温度升高增大趋势不明显,仅从0.02% 增至0.22%;NaCl 晶体对应的HCl 析出占比极小且随温度升高变化不明显,保持在0.01% 以内。这是由于在150 ℃时MgCl2·6H2O、CaCl2·6H2O、NaCl 晶体溶于自身析出的结晶水或自身含有的微量水分中,Mg2+、Ca2+、Na+发生水解反应生成对应的碱式化合物Mg(OH)2、Ca(OH)2、NaOH 和H+,从而促进自由态H+与Cl-结合生成HCl,这是低温蒸发过程中HCl 析出的主要途径[11,15]。随着蒸发温度升高,不仅H+与Cl-结合生成HCl,MgCl2·6H2O晶体在蒸发过程中的脱水产物MgCl2·2H2O 在193 ℃发生分解反应生成Mg(OH)Cl,这个过程也是产生HCl 的一种途径[11,16];CaCl2·6H2O 晶体在蒸干过程中也发生了脱水反应生成CaCl2·2H2O,CaCl2·2H2O 在260 ℃会分解生成Ca(OH)Cl 和HCl[12,17],但程度较弱;而NaCl 晶体不发生分解反应。这说明高温蒸发过程中HCl 的析出途径主要有自由H+与Cl-的结合以及氯盐的分解,且MgCl2·6H2O 的分解对HCl 的释放贡献最大。

图3 氯盐结晶盐蒸发过程中HCl 析出占比Fig.3 Proportions of HCl precipitation during evaporation of chloride crystal salts
3.1.2 氯盐溶液的HCl 析出从3.1.1 节3 种不同氯盐晶体的蒸发实验可知,氯盐不仅通过分解反应产生HCl,也会通过金属离子的水解反应促进自由态H+与Cl-结合生成HCl。由于脱硫废水是以溶液的形式存在,通过水解和分解产生的HCl 的占比也会有所不同,实验采用不同浓度的氯盐溶液来探究不同温度下HCl 的析出占比。实验采用MgCl2·6H2O、CaCl2·6H2O、NaCl 晶体分别配制成浓度为0.01、0.02、0.05、0.10、0.20 mol·L-1的MgCl2、CaCl2、NaCl 溶液,之后分别在150、300 ℃的温度下进行蒸发实验,实验结果如图4 所示,图中cB为浓度。从图中可以看出,不论在150 还是300 ℃下蒸发,HCl 的析出占比与以上3 种氯盐溶液的浓度呈反比,这是由于氯盐溶液浓度越低越有利于金属离子的水解及水的电离,在完全反应的前提下,等量(mol)的金属离子水解反应产生的HCl 比等量(mol)的金属氯盐分解反应产生的HCl 多[11-12],其次在高温下CaCl2·6H2O 分解极少且NaCl 不分解,因此水解程度越高,HCl 的析出占比也就越高。此外,在相同浓度下,MgCl2溶液蒸发析出HCl 的占比要明显高于CaCl2、NaCl 溶液,而CaCl2和NaCl 溶液蒸发析出HCl 的占比比较接近。这是由于溶液中金属离子的水解会对H+的浓度造成一定的影响,而金属离子的水解能力的强弱顺序为Mg2+>Ca2+>Na+[18-19],但由于CaCl2溶液的Cl-浓度是NaCl 溶液的2 倍,因此可能会导致NaCl 溶液蒸发过程中HCl 的析出占比与CaCl2溶液比较接近,甚至更高。而当温度由150升至300 ℃时,同一类型同一浓度的氯盐溶液蒸发析出的HCl 占比明显增大,结合3.1.1 节可知,一方面当温度升高会导致氯盐结晶产物分解产生HCl;另一方面,金属阳离子的水解反应以及水的电离反应都属于吸热反应,蒸发温度的升高会促进水解反应的进行以及水的电离[20]。

图4 不同浓度氯盐溶液蒸发过程中HCl 析出占比Fig.4 Proportions of HCl precipitation during evaporation of different concentrations of chloride salts
3.2 脱硫废水蒸发过程中HCl 析出的影响因素
由3.1 节的实验可以看出,脱硫废水蒸发过程中HCl 的析出来源为H+与Cl-的结合以及金属氯盐的分解,这2 个过程可能会受到蒸发工况及脱硫废水物性的影响,因此采用电厂实际脱硫废水探讨了脱硫废水蒸发过程中蒸发温度、脱硫废水TDS 浓度、脱硫废水pH 值、脱硫废水Cl-浓度对HCl释放特性的影响。
3.2.1 蒸发温度的影响
取2 种脱硫废水,分别在150、200、250、300 ℃的实验温度下进行蒸发实验,对HCl 析出占比进行测试,实验结果如图5 所示。从图中可以看出,随着温度升高,脱硫废水蒸发析出HCl 的占比不断增大,结合3.1 节可知温度的升高对HCl 的2 个释放途径均有促进作用,当温度从150 升至300 ℃时,A 类脱硫废水从2.54% 上升至16.95%,B 类脱硫废水从2.48% 上升至22.31%。从图5 中还可以看出,A、B 2 类脱硫废水的HCl 析出占比在150 ℃时相当,其余温度B 类废水较高。从3.1 节可知在150 ℃时,HCl 的析出来源主要是H+与Cl-的结合,结合表1 的脱硫废水水质,两类废水的pH 值、Cl-浓度相差不大,在蒸发过程中可能金属离子水解促进作用相近,因此HCl 析出占比相当;当蒸发温度为300 ℃时,HCl 的析出来源不仅有H+与Cl-的结合,还有析出的金属氯盐的分解。脱硫废水在蒸发的过程中会根据盐分溶解度的不同先后析出不同的结晶盐,实验过程中脱硫废水析出盐分的液体温度约为100 ℃,此时,氯盐的溶解度依次为CaCl2·6H2O > MgCl2·6H2O > NaCl,硫酸盐的溶解度为MgSO4> Na2SO4> CaSO4,硝酸盐的溶解度为Ca(NO3)2·6H2O > NaNO3> Mg(NO3)2·6H2O,此外MgCl2·6H2O > Mg(NO3)2·6H2O > MgSO4,NaNO3> Na2SO4> NaCl,而在上述结晶盐中CaSO4的溶解度最小[21],结合表1 可知,A 类脱硫废水的SO42-不能被Ca2+消耗完,而B 类脱硫废水的SO42-会被Ca2+消耗完,因此根据溶解度的大小,A 类脱硫废水的Mg2+会先与剩余的SO42-以及NO3-结合后再与已经与Na+结合析出NaCl 后的Cl-结合,B 类废水会先与NO3-结合后再与已经与Na+结合析出NaCl 的Cl-结合。A 类脱硫废水的Na+和NO3-质量分数高于B 类脱硫废水,Mg2+质量分数低于B 类脱硫废水,因此相比B 类脱硫废水,Cl-与Mg2+结合析出MgCl2·6H2O 占比小,从而在高温下分解HCl 的析出占比较小。在实际工程应用中,锅炉的烟气温度主要与锅炉负荷有关[22],不宜直接调节烟气温度。因此,在保证脱硫废水蒸干的前提下,可以增大脱硫废水处理量或者减小烟气抽取量,调节脱硫废水蒸发的温度,从而降低HCl 的析出占比。
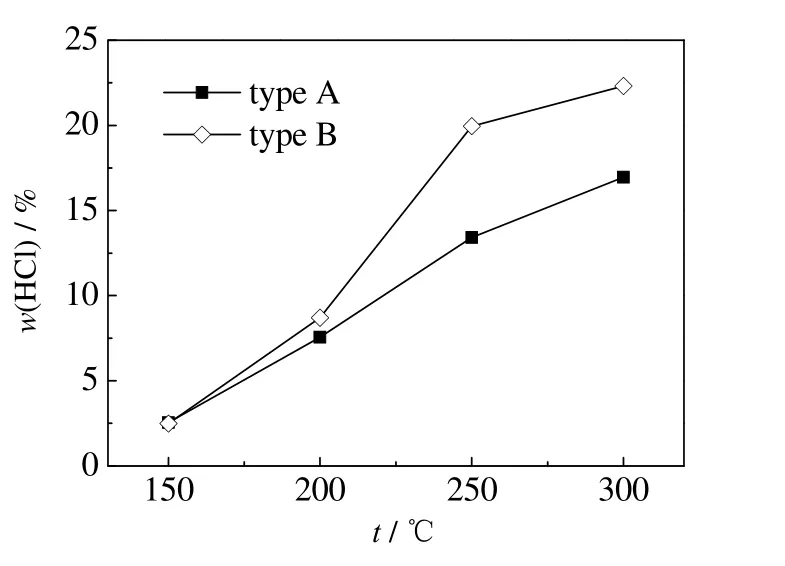
图5 蒸发温度对HCl 析出占比的影响Fig.5 Effects of evaporation temperature on the proportion of HCl precipitation
3.2.2 脱硫废水TDS 浓度的影响
采用A 类脱硫废水,用去离子水将其分别稀释1、2、5、10、20 倍,分别在150 和300 ℃下进行蒸发实验,结果如图6 所示。从图中可以看出,随着稀释倍数增大,HCl 的析出占比也增大,当稀释倍数从1 增至20 倍时,在150 ℃时HCl 的析出占比从2.54% 增至5.27%;在300 ℃时HCl 的析出占比从16.95%增至52.34%。这与3.1.2 节结果一致,稀释作用降低了脱硫废水中氯盐的浓度,从而增大了HCl 的析出占比。在实际工程中,可以对脱硫废水进行适当浓缩,一方面可以回用浓缩后的清水节约水资源,另一方面减少脱硫废水的处理量,且在蒸发处理时会降低HCl 的析出占比。
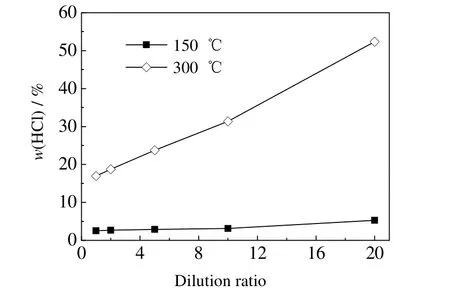
图6 TDS 浓度对HCl 析出占比的影响Fig.6 Effects of TDS concentration on the proportion of HCl precipitation
3.2.3 脱硫废水pH 值的影响
采用A 类废水,分别采用HNO3和KOH 溶液调节脱硫废水的pH 值为3、5、6、7、9,采用与3.2.2节相同的实验条件进行实验,实验结果如图7 所示。从图中可以看出,随着pH 升高,脱硫废水蒸发过程中HCl 析出占比也随之减小;在150 ℃时,HCl 析出占比从6.12% 降至1.47%,在300 ℃时,HCl 析出占比从25.11% 降至12.29%。在相同的蒸发温度下,随着脱硫废水pH 值的增大,H+的浓度是减小的,自由态H+与Cl-结合生成HCl 的反应平衡左移,HCl 的析出占比会减小;且脱硫废水pH 值的升高还会促使更多的Mg2+与OH-结合生成Mg(OH)2,维持Mg(OH)2水解平衡,导致析出的氯盐中MgCl2·6H2O 的比重降低,而高温下HCl 产生的一个主要途径就是MgCl2·6H2O 的分解,因此,HCl 的析出占比随pH 值的增大而减小。脱硫废水在电厂中一般会经过三联箱处理,在处理过程中可以适当添加中和药剂使脱硫废水呈碱性,可以有效地限制HCl 的析出。

图7 pH 值对HCl 析出占比的影响Fig.7 Effects of pH value on the proportion of HCl precipitation
3.2.4 脱硫废水Cl-浓度的影响由于溶液的电荷平衡,不可能单纯地在脱硫废水中添加Cl-来改变脱硫废水的Cl-浓度,因此实验采用A 类脱硫废水,分别添加MgCl2·6H2O、CaCl2·6H2O、NaCl 晶体,脱硫废水的Cl-质量浓度ρ(Cl-)调至20 000、40 000、60 000、80 000 mg·L-1,采用与3.2.2 节相同的实验条件进行实验,实验结果如图8 所示。从图中可以看出在150 ℃,添加MgCl2·6H2O、CaCl2·6H2O、NaCl 晶体,HCl 的析出占比都随ρ(Cl-)的增大而减小;在300 ℃,随着CaCl2·6H2O、NaCl 晶体的添加,HCl 的析出占比降低,而随着MgCl2·6H2O的添加,HCl 析出占比升高。结合3.1 节可知,在150、300 ℃时氯盐溶液浓度的增大均会减小HCl 的析出占比;在300 ℃时,在添加NaCl 晶体时,NaCl 的溶解度比较小,溶液在蒸发过程中会优先析出NaCl,而NaCl 是不分解产生HCl 的,因此析出占比随着NaCl 晶体的添加而减小;在添加CaCl2·6H2O 晶体时,Ca2+会与SO42-结合生成CaSO4,这样会有更多的Mg2+与Cl-结合生成MgCl2·6H2O,因此在ρ(Cl-)为20 000 mg·L-1时,HCl 析出占比只是略有减小,而继续添加CaCl2·6H2O 晶体时,Cl-多以CaCl2·6H2O 的形式析出,而CaCl2·6H2O 分解生成HCl 的反应程度极小,因此,HCl 的析出占比不断减小。当添加MgCl2·6H2O晶体时,在ρ(Cl-)=20 000 mg·L-1时,HCl 析出占比变化不大,随着Cl-浓度的增大,HCl 的析出占比是不断增大的,这是由于在添加MgCl2·6H2O 晶体时,Cl-主要是以MgCl2·6H2O 晶体的形式析出,随着MgCl2·6H2O 晶体不断加入,蒸发过程中MgCl2·6H2O 晶体析出占比不断增大,因此HCl 的析出占比不断增大,而在ρ(Cl-)=20 000 mg·L-1时,HCl 析出占比变化不大可能与H+与Cl-结合生成HCl 的占比减小有关。实际工程应用时应重点关注脱硫废水中Mg2+的质量分数,若质量分数过高可以在三联箱多添加一些中和剂对其进行去除,可有效降低HCl 的析出。

图8 脱硫废水Cl-浓度对HCl 析出占比的影响Fig.8 Effects of Cl- concentration of desulfurization wastewater on HCl precipitation proportion
4 结 论
(1) 脱硫废水蒸发析出的HCl 主要有2 个途径:一是脱硫废水中自由态H+与Cl-结合生成HCl,这个过程同时受到金属阳离子(主要为Mg2+)水解的影响;二是脱硫废水蒸发析出的氯盐结晶盐(主要为MgCl2·6H2O)在高温下分解产生HCl;此外,脱硫废水中氯盐浓度的变化会影响2 种途径的化学反应程度,氯盐溶液浓度越低,其蒸发过程中水解程度越大,HCl 析出占比越高。
(2) 脱硫废水蒸发的过程中HCl 的析出占比受蒸发温度、脱硫废水水质的影响。其中蒸发温度的影响最大,当蒸发温度从150 增至300 ℃时,HCl 的析出占比可从2.54% 升至16.95%;在蒸发温度为300 ℃时,将脱硫废水的pH 调至9,可将HCl 的析出占比降至12.29%;脱硫废水TDS 浓度的减小,会使HCl的析出占比增大,可达52.34%;Cl-浓度的改变随金属离子种类的变化对HCl 析出有不同的影响,Cl-浓度协同Ca2+、Na+浓度增大时,HCl 的析出占比减小,可降至2.13% 以下,当协同Mg2+浓度增大时,HCl析出占比增大,可至32.78% 以上。
