三维动脉自旋标记联合体素内不相干运动成像鉴别诊断良恶性脑膜瘤
2021-09-01马玉燕李宗芳曾颖卿赵琪瑞
马玉燕,邓 玥,李宗芳,唐 丹,曾颖卿,包 含,赵琪瑞,赵 卫
(昆明医科大学第一附属医院影像科,云南 昆明 650032)
脑膜瘤是神经系统常见肿瘤[1],良性脑膜瘤临床常见,生长缓慢,可根治性切除;恶性脑膜瘤多呈膨胀性、浸润性生长,术后复发率较高[2]。肿瘤恶性程度与微血管结构和肿瘤细胞增殖密切相关[3]。三维动脉自旋标记(three dimensional arterial spin labeling, 3D-ASL)及体素内不相干运动(intravoxel incoherent motion, IVIM)成像技术能反映肿瘤血流灌注及细胞密度,可用于鉴别良、恶性脑膜瘤[4-6]。本研究观察3D-ASL联合IVIM鉴别诊断良、恶性脑膜瘤的价值。
1 资料与方法
1.1 一般资料 收集2017年11月—2019年4月57例经病理证实的脑膜瘤患者,男17例,女40例,年龄23~70岁,平均(51.5±10.6)岁;其中良性脑膜瘤43例(良性组),包括血管瘤型4例、砂粒体型7例、纤维型16例、过渡型9例、脑膜上皮细胞型6例及淋巴浆细胞型1例,恶性14例(恶性组),包括非典型性6例、透明细胞型6例、脊索瘤样型1例及间变型1例;术前均接受常规、增强MR扫描及MR 3D-ASL、IVIM成像。
1.2 仪器与方法 采用GE Discovery MR750 3.0T MR扫描仪,24通道相控阵头颈联合线圈,先行头部常规MR平扫,之后行轴位3D-ASL和IVIM成像,最后行常规T1W增强扫描。
扫描序列及参数:常规轴位T2WI,TR 4 373 ms,TE 115 ms,层厚5.0 mm,层间距1.0 mm;轴位T1WI,TR 2 500 ms,TE 24 ms,层厚5.0 mm,层间距1.0 mm;轴位T2液体衰减反转恢复(fluid attenuated inversion recovery, FLAIR),TR 9 000 ms,TE 24 ms,层厚4.0 mm,层间距0 mm;增强扫描参数同上。3D-ASL:采用背景抑制、假连续性标记的快速自旋回波成像序列,TR 4 852 ms,TE 10.7 ms,层数36层,标记后延迟时间(postlabeling delay, PLD)2.0 s,NEX 4,扫描时间5 min 59 s。IVIM:采用单次激发自旋回波-平面回波成像(spin echo-echo planar imaging, SE-EPI)序列,TR 5 200 ms,TE minimum(最小值),层数20层,层厚5.0 mm,层距1.0 mm,b值为0、25、50、80、100、200、400、800、1 000、1 500、2 000、3 000 s/mm2,扫描时间5 min 38 s。
1.3 图像处理与分析 采用GE ADW4.6后处理工作站。以Functool软件对ASL原始图像进行处理,将脑血流量(cerebral blood flow, CBF)图与T2 FLAIR图像进行匹配,获得伪彩图,于其中手动勾画ROI,使之覆盖整个肿瘤区域,并结合平扫和增强图像,尽可能避开囊变、坏死及出血区,测量瘤区及对侧正常脑白质区CBF,并计算相对CBF(relative CBF, rCBF),rCBF=瘤体区CBF/对侧正常脑白质区CBF。对所有参数均测量3次,取平均值作为结果。
采用Functool软件中的MADC程序对双指数模型多b值IVIM图像进行后处理,勾画ROI方法同ASL,获得真扩散系数(D)、假性扩散系数(D*)和灌注分数(f),并绘制相应伪彩图。
1.4 统计学分析 采用SPSS 23.0统计分析软件。以±s表示符合正态分布的计量资料,行两独立样本t检验;中位数(上下四分位数)表示不符合者,行两独立样本Wilcoxon秩和检验。采用χ2检验比较计数资料。采用受试者工作特征(receiver operating characteristic, ROC)曲线评价各参数鉴别诊断良恶性脑膜瘤的阈值、敏感度、特异度和曲线下面积(area under the curve, AUC)。P<0.05为差异有统计学意义。
2 结果
良性组43例,男12例,女31例,年龄23~69岁,平均(50.1±11.7)岁;恶性组14例,男5例,女9例,年龄29~70岁,平均(53.8±12.1)岁;2组患者性别(χ2=0.044,P=0.827)、年龄(t=-1.039,P=0.312)差异均无统计学意义。
恶性组rCBF大于良性组(P<0.05),D小于良性组(P<0.05);组间D*、f差异均无统计学意义(P均>0.05)。见表1及图1、2。
表1 良、恶性脑膜瘤rCBF、D、D*、f比较(±s)

表1 良、恶性脑膜瘤rCBF、D、D*、f比较(±s)
组别rCBF(ml/min·100g)D(×10-3mm2/s)D*(×10-3mm2/s)f良性组(n=43)2.876±2.600.600±0.0816.490±5.6700.27±0.07恶性组(n=14)5.366±2.950.518±0.1367.860±3.7130.29±0.09t值-3.467-2.104-1.094-1.789P值0.0040.0350.2740.074
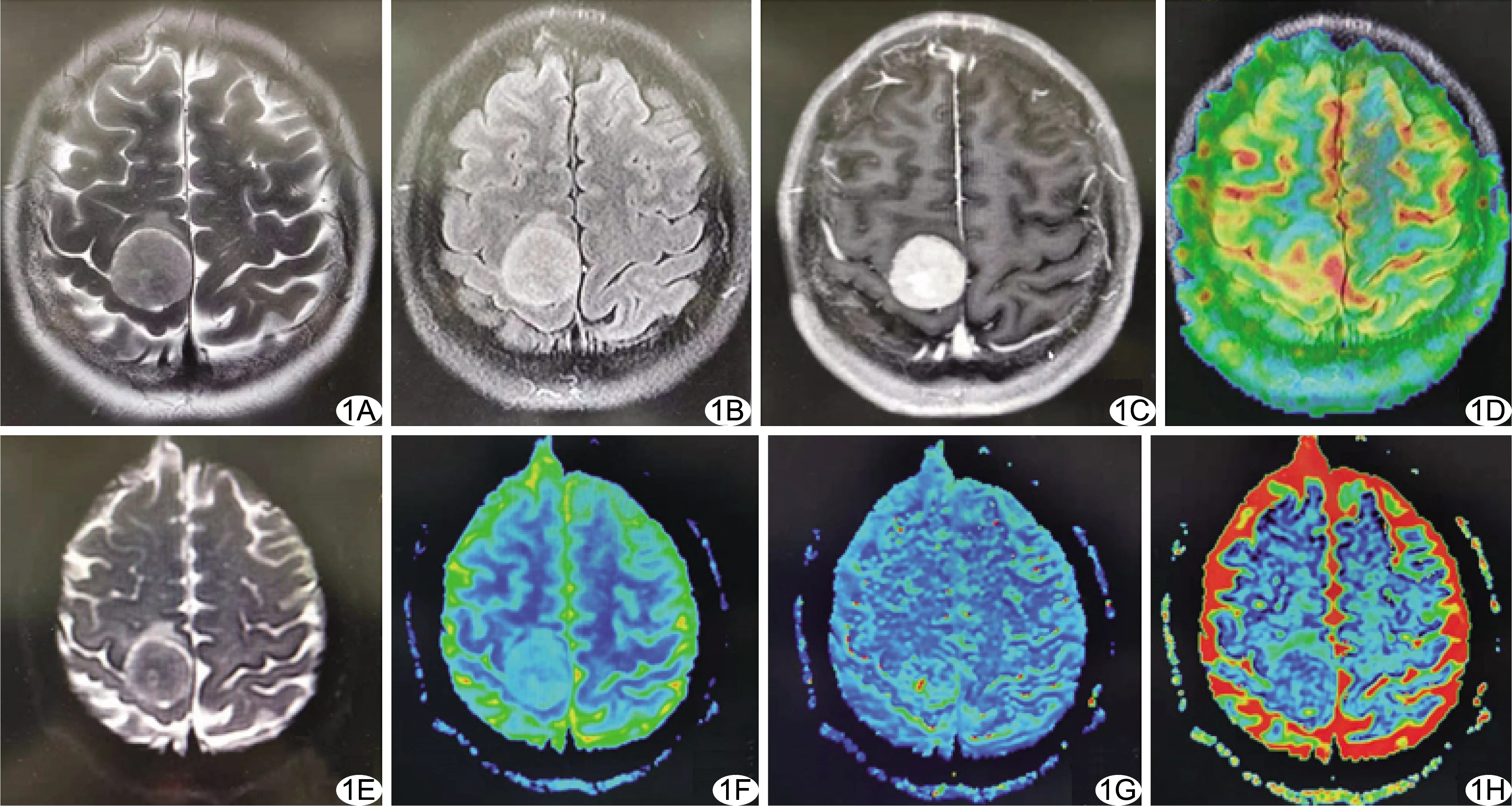
图1 患者女,53岁,右额顶部良性纤维型脑膜瘤 A、B.T2WI(A)、T2 FLAIR(B)图像示病灶呈高信号;C.增强T1WI示病灶明显强化;D.3D-ASL灌注后处理图像,病灶灌注未见明显升高;E.表观弥散系数(apparent diffusion coefficient,ADC)图像;F.D图,D=0.589×10-3 mm2/s;G.D*图,D*=5.25×10-3 mm2/s;H.f图,f=0.222
ROC曲线结果显示,rCBF阈值为3.027 5 ml/(min·100 g)时,其鉴别诊断良、恶性脑膜瘤的敏感度为92.86%,特异度为74.42%,AUC为0.811;D阈值为0.529 5×10-3mm2/s时,其敏感度为88.37%,特异度为64.29%,AUC为0.689;rCBF联合D鉴别诊断良、恶性脑膜瘤的敏感度为85.71%,特异度为86.05%,AUC为0.832。见图3。
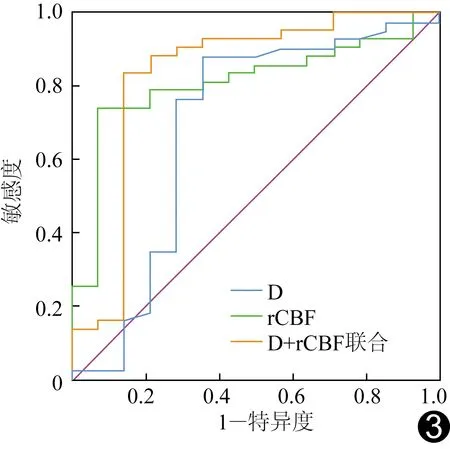
图3 rCBF、D单独及二者联合鉴别良、恶性脑膜瘤的ROC曲线
3 讨论
肿瘤恶性程度与其内新生血管结构和肿瘤细胞增殖密切相关[3]。肿瘤生成新生血管的特征是肿瘤组织血流量增加。作为一种无需注射外源性对比剂的灌注成像方式,3D-ASL利用血液中的内源性水质子为对比剂,被标记的水分子可自由通过血脑屏障,使其显示肿瘤灌注状态与血脑屏障完整与否无关,由此可更精确地评估肿瘤微循环灌注。既往研究[7-8]显示,恶性脑胶质瘤的CBF较良性明显升高,而CBF与微血管密度呈正相关,提示CBF可反映肿瘤新生血管生成,从而指导肿瘤分级。本研究恶性组rCBF显著高于良性组,与LU等[9-10]的结果相符;rCBF阈值为3.027 5 ml/min·100 g时,其鉴别良恶性脑膜瘤的敏感度、特异度分别为92.86%、74.42%,AUC为0.811,提示3D-ASL对于鉴别良、恶性脑膜瘤具有较高应用价值。
肿瘤细胞增殖程度与肿瘤细胞密度显著相关。ADC可反映肿瘤细胞密度,肿瘤恶性程度越高,细胞增殖速率越快,细胞排列致密,细胞外间隙缩小,水分子在组织间扩散越受限,ADC越小。组织中的水分子运动同时包括纯水分子扩散和毛细血管灌注,而传统弥散加权成像(diffusion-weighted imaging,DWI)忽略了微循环灌注的影响,其ADC是组织纯水分子扩散和毛细血管灌注的综合结果。在DWI基础上发展而来的IVIM成像可将血管内外纯水分子扩散与灌注区分开来,更准确地反映真实的扩散和灌注信息;其参数D代表单纯水分子扩散(缓慢扩散运动),D*代表血液微循环产生的假扩散(快速扩散运动),即毛细血管灌注相关扩散,f为灌注分数,表示微循环灌注相关扩散占体素内总扩散效应的百分比[11]。
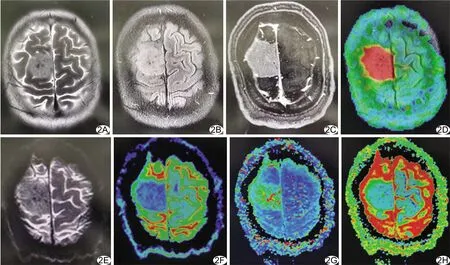
图2 患者男,42岁,右额部恶性非典型性脑膜瘤 A、B.T2WI(A)、T2 FLAIR(B)图像示病灶呈高信号;C.增强T1WI示病灶明显强化;D.3D-ASL灌注后处理图像,病灶呈明显高灌注;E.ADC图像;F.D图,D=0.488×10-3 mm2/s;G.D*图,D*=1.49×10-3 mm2/s;H.f图,f=0.267
本研究恶性组D低于良性组,与既往研究[12-14]结果相符;阈值为0.529 5×10-3mm2/s时,根据D诊断良、恶性脑膜瘤的敏感度和特异度分别为88.37%和64.29%,AUC为0.689,表明D可用于鉴别诊断良、恶性脑膜瘤。BOHARA等[14]认为恶性脑膜瘤f较良性脑膜瘤明显升高;而本研究f组间差异无统计学意义,可能与入选病例个体差异和肿瘤异质性有关,亦可能与b值选择不同有关[15]。此外,有研究[16-17]认为D*不稳定,易受脑脊液流动、微循环快速血流影响。f、D*鉴别诊断良、恶性脑膜瘤的价值有待进一步探讨。
鉴于3D-ASL、IVIM定量参数鉴别良、恶性脑膜瘤均有较高诊断价值,且二者可分别从肿瘤新生血管形成和肿瘤细胞增殖的不同角度进行判断,故本研究术前联合应用3D-ASL与IVIM鉴别良、恶性脑膜瘤,AUC为0.832,高于单独rCBF和D,表明联合应用两种成像技术可提高术前定性诊断脑膜瘤的准确率。
本研究存在的不足:恶性脑膜瘤发病率较低,本研究样本中恶性病例数较少,可能造成一定偏倚;良恶性脑膜瘤病理分型均较多,不同分型对结果可能存在一定影响。
总之,基于3D-ASL及IVIM技术获得的定量参数rCBF、D对鉴别诊断良、恶性脑膜瘤均有较高价值;联合应用二者可进一步提高鉴别诊断效能。
