芥子气中毒生物标志物溯源检测技术研究进展
2021-09-01
(1. 国民核生化灾害防护国家重点实验室,北京,102205;2. 防化研究院分析化学实验室,北京,102205)
芥子气(sulfur mustard, mustard gas, SM, MG, HD)是糜烂性毒剂最典型代表,学名为2, 2’-二氯二乙硫醚。HD作为化学战剂首先部署于第一次世界大战,大约有130万的人受到芥子气的损伤,伤亡率占化学毒剂总伤亡人数的 80%以上[1]。第二次世界大战日本侵华期间,日军广泛对中国军民施用了HD,造成了巨大伤亡。直到现在,在中国仍有大量的日本遗留化学武器,其中大部分是HD和芥路混合毒剂,据不完全统计这些日遗化武已经使3000多名中国公民受到不同程度的伤害[2]。2003 年中国齐齐哈尔的“8·4”事件正是此类典型事件。此后,两伊战争上也有HD施用的报道[3]。虽然化武公约严格禁止HD的生产、储存和施用,但以往遗留在化学炮弹中的HD仍会时刻威胁人民的生命安全。因此,有必要建立和发展可靠的分析方法溯源性检测和鉴定HD染毒,为指证HD的使用和改善HD染毒人员的医疗救治提供依据。与其它体内代谢物相比,HD与蛋白质加合物更为稳定、具有较长的半衰期,能够在较长时间范围内检测到这些加合物,成为HD中毒检测的重要生物标志物。
1 HD概述与中毒机理
与神经性毒剂相比,糜烂性毒剂HD的致死性相对较低。HD具强烈的细胞毒作用,能使人或动物皮肤产生红斑、水疱、坏死,并能引起眼、呼吸道、消化道粘膜和组织损伤,出现程度不同的全身中毒,主要表现为造血系统和消化道粘膜等的损害[4]。虽然HD中毒机理尚未完全阐明,但普遍认为由于HD具两个亲电碳原子,是典型的双功能烷基化试剂,进入体内后能形成硫鎓正离子,生理条件下,硫鎓正离子通过SN1机制与体内器官或组织中的多种化合物分子的亲核性基团如氨基、巯基、羟基、羧基、磷酸基及咪唑基等反应,生成对应的烷基化产物,进而产生各种毒理效应,如破坏细胞正常的分裂繁殖;抑制酶的活性;使蛋白变性,导致细胞和组织坏死、溃烂等。而HD进入体内后的水解代谢物硫二甘醇(TDG)和它的氧化产物硫二甘醇亚砜(TDGO)、一系列β-裂解酶代谢产物、HD与DNA在鸟嘌呤N7, O6位置上的加合物和在腺嘌呤N3位置上的加合物,HD与一些蛋白质的加合物已经被作为侦检临床样本中HD暴露的重要生物标志物,并且为医学治疗提供了可靠的信息。
2 水解产物、与谷胱甘肽加合物及其β-裂解产物为HD中毒生物标志物
HD进入体内在生理条件下,迅速形成的硫鎓正离子中间体具强的电负性,能够与水、谷胱甘肽等小分子亲核试剂反应分别生成硫二甘醇(TDG)和HD-谷胱甘肽加合物(图1),后者再经β-裂解酶作用生成β-裂解产物,这些代谢物均为HD中毒的重要生物标志物。
2.1 HD水解产物
由HD水解生成的TDG,可以通过氧化反应转化生成硫二甘醇亚砜(TDGO)(图1)。一直以来,由于TDG和TDGO少量存在于正常健康人的尿液中,它们作为确证HD中毒的生物标志物存在一定的争议。然而,TDG和TDGO在正常人体内的背景值极低,分别仅为0~1.0 ng/mL和2~8.0 ng/mL[5],遭遇HD染毒的样本中两者的含量将显著增加,研究证实,体内TDG浓度高于2 ng/mL,TDGO浓度高于10 ng/mL,可初步认定为HD中毒。因此,它们常作为核查HD暴露的辅助性依据。此外,进入体内的HD也有极少量发生氧化,生成HD亚砜(SMO,图1),该代谢产物被检测存在于尿液、血液和分泌物中。SMO为非内源性物质,被用作HD中毒的重要生物标志物。这些水解、氧化产物可在HD暴露后迅速出现在生物体液中,并于数日内经尿液排出体外。
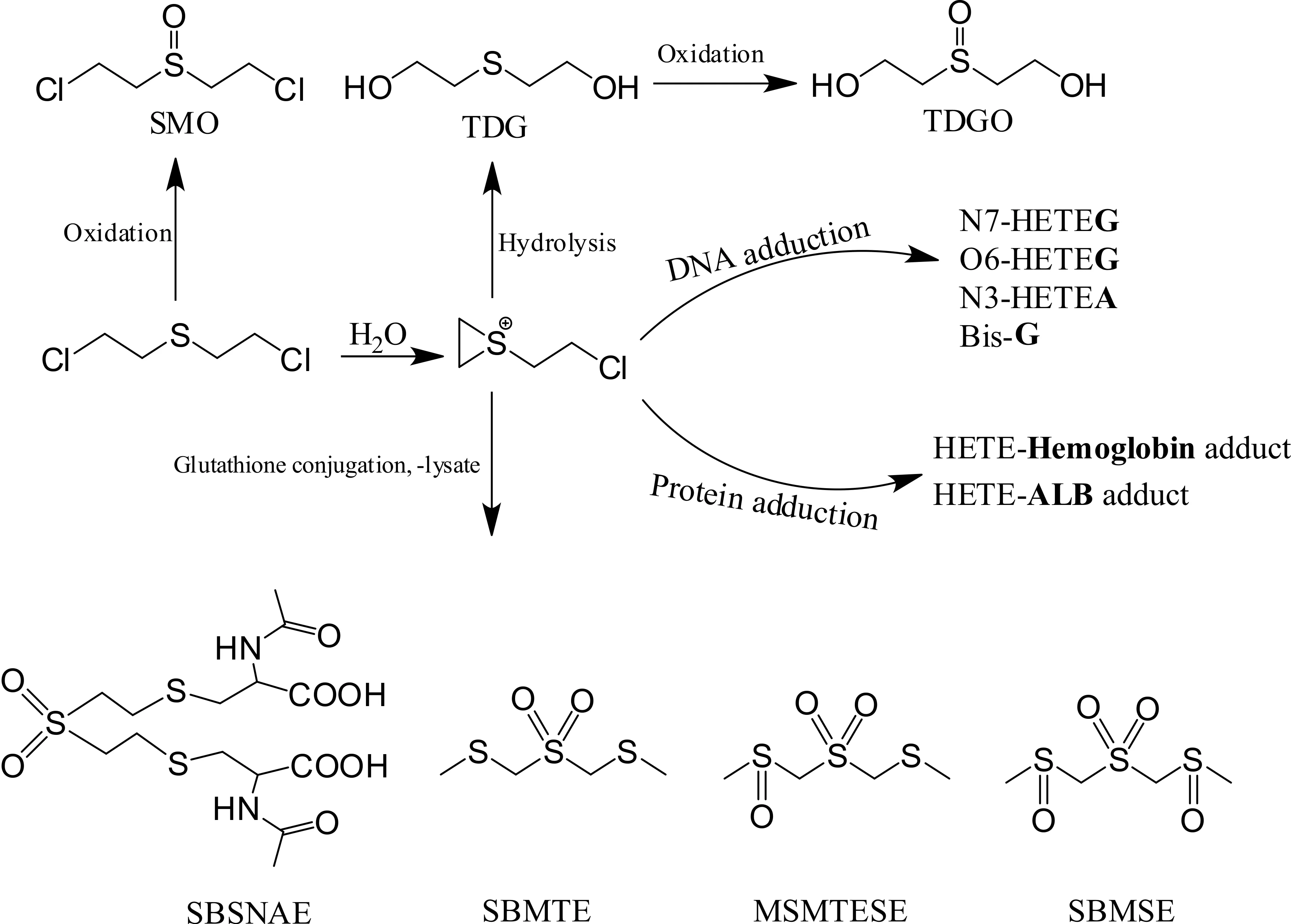
图1 HD在体内代谢的4种主要途径
TDG和TDGO的定量检测,常通过衍生化制备,再由GC-MS/MS检测,检测限可达0.5 ng/mL。此外,近年来,LC-ESI-MS/MS也被发展用于检测这些化合物,该类方法样品制备简单,无需复杂的衍生化过程,采用SRM模式,检测限达0.05 ng/mL(SMO)、5.0 ng/mL(TDG)和0.5 ng/mL(TDGO)[6]。
2.2 HD-谷胱甘肽加合物及其β-裂解产物
谷胱甘肽(GSH)是人体内具有活性的含有3个氨基酸的小分子肽类物质,HD与谷胱甘肽的加合位点为半胱氨酸上的巯基。HD-谷胱甘肽加合物经γ-谷氨酰基转肽酶和二肽酶酶解后游离出HD-半胱氨酸加合物,再由N-乙酰转移酶转化生成SBSNAE(图1)。再经β-裂解酶作用,生成一系列特征性的非内源性的小分子标志物,被称为“β-裂解产物”;主要为:1,1’-磺酰基二(2-甲亚磺酰基)乙烷(SBMSE)和1-甲基亚磺酰基-2-(2-甲巯基乙基磺酰基)乙烷(MSMTESE)等(图1)。此外,经检测,这些特征性代谢产物随尿液排出体外,在体内可停留约1周。
β-裂解产物的分析检测手段主要是GC-MS或GC-MS/MS,然而,由于SBMSE和MSMTESE的热稳定性较差,分析前通常应用三氯化钛等将其还原成单一的1,1’-磺酰基二(2-甲巯基)乙烷(SBMTE),然后再进行检测。Black等[8]和王颖等采用GC-PCI-MS检测尿液中的β-裂解产物,检测限分别为2 ng/mL和0.5 ng/mL。Young等[10]应用GC-MS/MS进行检测,该方法具最高的灵敏度,尿样中的β-裂解产物的检测限可达0.038 ng/mL。然而,应用这些气质联用技术涉及到复杂的样品制备步骤,一定程度上限制了其应用与推广。为了获得更简便的检测方法,LC-MS/MS定量检测血液[6]、尿液中β-裂解产物的分析方法逐渐被建立和应用。该类方法无需还原反应等处理,只要简单的制备即可直接进入LC-MS/MS分析。近来,一个高特异性、灵敏的检测血浆中所有β-裂解产物和SBSNAE的方法被建立和考察,检测限分别为0.01 ng/mL(SBMSE和MSMTESE)、0.05 ng/mL(SBMTE)和0.5 ng/mL(SBSNAE),较Read等建立的LC-MS 或LC-MS/MS分析方法的灵敏度有较大的提高[6]。
对于尿液中HD代谢物的溯源检测,虽然已有大量的液质和气质检测方法已经被建立,但以上方法未见有一种单独的方法能够同时检测HD在尿液中的水解代谢物、与谷胱甘肽的加合物及其β-裂解产物。然而,本实验室Liu等通过固相萃取方法的改进,首次建立了一个单独的可以同时定量检测尿液中HD的4个代谢物液质分析方法,避免了以往需要多个分析方法才能完成此4个化合物检测的问题[11]。
3 HD与蛋白质和核酸加合物作为HD中毒的生物标志物
HD进入体内,除了与水、谷胱甘肽等小分子亲核试剂反应外,还与DNA和蛋白质等大分子上的亲核基团反应,生成相应的HD-DNA或HD-蛋白质加合物(图1)。这些大分子加合物较为稳定,在体内可存在数月之久,因此它们已成为HD中毒溯源检测的重要生物标志物。
3.1 HD-核酸加合物
HD中毒引发的细胞毒性被认为主要由HD烷基化DNA所致,烷基化的DNA直接使遗传信息无法准确复制,进而发生错误的转录与翻译,最终表现出机体的损伤。由HD介导的DNA烷基化位点发生在脱氧鸟嘌呤(G)的N7位,产物为N7-(2-羟乙基硫代乙基)鸟嘌呤(N7-HETEG);脱氧腺嘌呤(A)的N3位,产物为N3-(2-羟乙基硫代乙基)腺嘌呤(N3-HETEA);脱氧鸟嘌呤(G)的O6位,产物为O6-(2-羟乙基硫代乙基)鸟嘌呤(O6-HETEG)(图2)。此外,一分子的HD与两个鸟嘌呤在N7位上发生链内或链间交联,产物为双(鸟嘌呤-7)衍生物(Bis-G)(图2)。这些位点的烷基化具明显的倾向性,经测定,N7-HETEG含量最高,约占DNA总加合物的61%,N3-HETEA和Bis-G各约占17%,而O6-HETEG仅占总加合物的0.1%。

图2 4个HD-DNA加合物的结构式
基于此,早期的检测方法主要集中于N7-HETEG,方法主要为32P 后标记法、免疫检测法和质谱分析。前两者虽然具高的特异性和灵敏度,但操作步骤相对复杂且定量的准确度不高。质谱法可以弥补这方法的缺点,因此检测获得了越来越多的重视。由于N7-HETEG的极性强,需先采用五氟苯甲酰溴或双三甲基硅基三氟乙酰胺等对其进行衍生化,再进入GC-MS检测。但该方法样品制备过程仍过于复杂,衍生化条件过于苛刻,因此应用上受到了很大限制。相比之下,LC-MS/MS方法无需衍生化即可直接检测,相关的方法也获得了发展和应用。Fidder等[12]将样品经SPE简单分离净化后,直接进入LC-MS/MS 分析,在HD染毒豚鼠尿液中检测到了N7-HETEG,检测限为0.2 ng/ml。Wei等[13]建立了专门适用于人血液中N7-HETEG加合物的检测方法,血液中的DNA经分离、酸水解,再进入LC-MS/MS定量分析,方法检测限为0.33 ng/mL,应用该方法能够在染毒浓度为312 ng/ml HD的全血中,检测到N7-HETEG。Batal等[14]主要分析了SM处理的小牛胸腺DNA和人白血病单核细胞中最丰富的3种DNA加合物N7-HETEG、N3-HETEA和BisG,该方法基于外部校准曲线的使用,后续研究集中于DNA加合物在内脏分布情况。Zhang等建立并验证了一种氘代同位素稀释UHPLC-MS/MS同时定量N7-HETEG、N3-HETEA、Bis-G、和O6-HETEG的方法,该方法更为简便、灵敏,4个分析物的检测限分别为0.01、0.11、0.04和0.002 fmol,此外该课题组分析发现脂肪细胞系和脂肪组织中的DNA加合物水平远高于其他组织,一定程度上表明HD可能易在富脂环境富集[7]。Zubel[15]课题组以15N/13C的HD-DNA加合物标样为内标,同样利用同位素稀释超高液相色谱-质谱技术,在多种样本中定量分析了HETEG、HETEA及BisG与芥子气染毒剂量和染毒时间的关系。。
3.2 HD-蛋白质加合物
与其它代谢产物相比,HD与蛋白质加合物更为稳定、具有较长的半衰期,能够在较长时间范围内检测到这些加合物[16, 17],是HD中毒长期溯源性检测的重要生物标志物。虽然,在体内HD能够使多种蛋白质上的亲核氨基酸残基发生烷基化,但其中作为生物标志物被认为最重要的是HD与血红蛋白N-末端缬氨酸反应,生成的HD-血红蛋白烷基化加合物;以及与血清白蛋白第34位的半胱氨酸反应,生成的HD-白蛋白烷基化加合物(图3);主要是由于这两种蛋白加合物含量高、易于分离和检测。
HD与血红蛋白N-末端Val残基形成的加合物最为稳定,能够在体内存在长约120天。HD-血红蛋白加合物的检测方法主要是使用Edman降解法结合气相色谱 (GC)-NICI-MS分析鉴定产生的S-羟乙基硫乙基(S-HETE)-Val加合物。HD-血红蛋白加合物经Edman降解后,生成N-末端Val加合物,再由七氟丁酸酐或七氟丁酰咪唑衍生化后,用NCI-GC/MS分析衍生化产物,检测限可达0.1 μmol/L。该方法被应用于实际HD染毒样品的溯源性检测,测定HD 染毒22~26天的伊朗伤员全血样本,均检出了(S-HETE)-Val加合物。
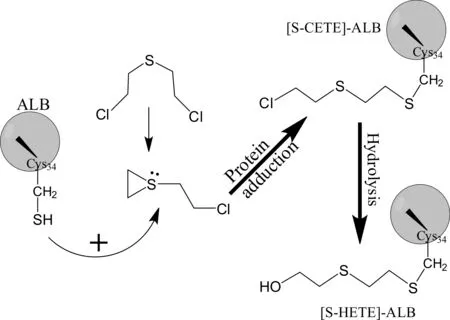
图3 HD与人血清白蛋白第34位Cys残基加合反应过程
HD与人血清白蛋白(ALB)第34位半胱氨酸残基,生成稳定的S-羟乙基硫乙基([S-HETE])-ALB加合物在体内的半衰期为20~25天。该HD-ALB加合物的检测方法主要为蛋白酶解结合LC-ESI-MS-MS分析,方法基于应用链酶蛋白酶酶解[S-HETE]-ALB加合物,转换生成分子量较小、易于质子化的三肽加合物“[S-HETE]-CPF”,再进行LC-ESI-MS-MS的检测分析[22]。以d8-HD作为内标,分析定量HD暴露血浆中[S-HETE]-CPF三肽加合物的定量方法已经被建立,应用该方法在真实HD暴露样本中检测出[S-HETE]-ALB加合物,有效地确证了HD样本的染毒。最近,Pantazides等[25]建立了一个改进的定量HD-ALB加合物方法,该方法具简化的样品制备步骤,使用少量的血液样本,选择蛋白酶K酶解[S-HETE]-ALB加合物,解决了以往不同批次链酶蛋白酶酶解产生[S-HETE]-CPF三肽加合物的量变异性较大的问题。但该方法仅能测定[S-HETE]-CPF加合物的量,而非暴露HD的浓度,测定结果无法直接给出人员HD中毒程度的信息;本实验室Liu等通过引入HD模拟剂作为内标,建立了血浆中HD-ALB加合物的定量检测方法,实现了HD染毒浓度的直接测定[26]。
4 结论
鉴于糜烂性毒剂HD在生物医学样本中溯源性鉴定需求,大量的HD中毒溯源生物标志物分析检测方法被开发和建立,其中基于质谱分析的技术在生物标志物的检测鉴定领域具有明显优势,不足是仍要结合复杂的样品前处理程序才能获得满意的灵敏度,分析检测周期较长,无法实现现场检测;此外,对于大量中毒样本,不能同时处理和分析。因此,今后建立适合高通量、自动化分析HD中毒溯源生物标志物检测方法,建立健全相应的高通量设备或装备体系;以及结合分子识别与光学检测,设计适于现场检测的芯片等,实现生物医学样本中毒剂与蛋白质加合物在现场的快速、准确、特异性检测,将是未来应用和发展的趋势。
