髓样分化蛋白-2及Toll样受体4在星形细胞瘤中的表达及临床意义
2021-09-01方亮李得生
方亮 李得生
Toll样受体4(TLR4)是一种在感染和炎症中起重要作用的受体,在哺乳动物中,Toll样受体高度保守,可参与非特异性免疫[1]。研究表明,TLR4还参与了恶性肿瘤的发生发展过程,并在肿瘤免疫逃逸中发挥关键作用[2]。在炎症反应中,髓样分化蛋白-2(MD2)是起连接作用的重要蛋白,和TLR4结合后与脂多糖(LPS)共同参与炎症免疫反应。星形细胞瘤是一种恶性程度很高的恶性肿瘤,预后较差,死亡率较高,且目前常规的外科手术等手段无法根治高级别星形细胞瘤(HGA)。TLR4-MD2作为神经炎症发生的主要信号,其发生发展与神经炎症反应、基因突变等密切相关[3],但目前在星形细胞瘤的研究中尚未见明确报道。本研究采用免疫组化法和实时荧光定量聚合酶链反应(qRT-PCR)法检测不同级别星形细胞瘤组织中TLR4、MD2的蛋白和mRNA表达水平及下游关键信号因子中肿瘤坏死因子α(TNF-α)、髓样分化因子88(MYD88)蛋白和mRNA表达水平,并探讨其临床意义。
对象与方法
1.对象:收集2019年1月~2020年8月于山东国欣颐养集团新汶中心医院接受手术切除的低级别星形细胞瘤(LGA,WHO Ⅰ级、Ⅱ级)患者50例及HGA(WHO Ⅲ级、Ⅳ级)患者50例,所有患者术后经病理组织检查证实为星形细胞瘤[4]。按照WHO分级标准[4],Ⅰ级患者中毛细胞型星形细胞瘤14例,室管膜下巨细胞型星型细胞瘤9例;Ⅱ级患者中弥漫型星形细胞瘤16例,少突胶质细胞瘤11例;Ⅲ级患者中间变星形细胞瘤9例,间变少突胶质细胞瘤10例;Ⅳ级患者中胶质母细胞瘤31例。排除标准:(1)术前接受化疗或放疗;(2)临床资料缺失;(3)肝肾功能不全。本研究通过山东国欣颐养集团新汶中心医院伦理委员会审核批准。
2.方法
(1)免疫组化法检测TLR4、MD2、MYD88和TNF-α的表达水平:所有患者肿瘤组织样本于术中离体后立刻保存于液氮中。肿瘤组织经甲醛固定、石蜡包埋、切片后采用EnVision试剂盒进行免疫组化染色。TLR4、MD2、MYD88和TNF-α的单克隆抗体购于Abcam公司(产品号:ab13556、ab24182、ab135693、ab6671),阴性对照采用血清代替一抗,空白对照采用磷酸盐缓冲液(PBS)代替一抗。在400倍显微镜下,采用5个不同的视野进行阳性细胞观察,对染色程度(阴性着色为0分,淡黄色为1分,浅褐色为2分,深褐色为3分)和阳性范围(0~25%为1分,26~50%为2分,51~75%为3分,76~100%为4分)进行评分,表达水平等于2项评分的乘积。
(2)qRT-PCR检测肿瘤组织中TLR4、MD2、MYD88和TNF-α的mRNA表达水平:液氮保存的新鲜冰冻肿瘤组织用研钵研磨后,采用Trizol法提取组织总RNA。使用RNA simple Total RNA Kit逆转录试剂盒(美国Thermo公司)逆转录合成cDNA,反应体系25 μl。参照qRT-PCR试剂盒说明书操作,采用20 μl反应体系,cDNA模板1 μl,引物设计采用Primer 5软件进行设计,GAPDH作为内参,引物序列由上海生工生物公司合成。检测不同级别星形细胞瘤组织中TLR4、MD2、MYD88和TNF-α的mRNA表达水平。每组设置3个复孔检测。引物序列见表1。

表1 引物序列
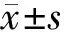
结 果
1.两组患者肿瘤组织中TLR4、MD2、MYD88和TNF-α表达水平比较:HGA组患者肿瘤组织中TLR4(9.92±1.93)、MD2(7.27±1.90)、MYD88(8.76±2.64)及TNF-α(10.26±1.71)的表达水平均高于LGA组(6.38±1.70、5.99±1.57、7.05±1.86、4.13±1.09),差异有统计学意义(P<0.01)。见图1。
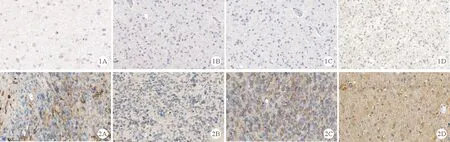
图1 LGA组患者肿瘤组织中TLR4、MD2、TNF-α和MYD88的表达情况(A:TLR4;B:MD2;C:TNF-α;D:MYD88;×400)图2 HGA组患者肿瘤组织中TLR4、MD2、TNF-α和MYD88的表达情况(A:TLR4;B:MD2;C:TNF-α;D:MYD88;×400)
2.两组患者肿瘤组织中TLR4、MD2、MYD88和TNF-α的mRNA表达水平比较:HGA组患者肿瘤组织中TLR4(1.64±0.49)、MD2(2.52±0.70)、MYD88(1.93±0.54)和TNF-α(2.56±0.73)的mRNA表达水平均高于LGA组患者(0.98±0.25、1.37±0.38、1.00±0.26、0.99±0.23),差异均有统计学意义(P<0.05)。
3.星型细胞瘤患者TLR4、MD2与MYD88和TNF-α的相关性分析:Pearson线性相关分析结果显示,星型细胞瘤患者MYD88表达水平与TLR4(r=0.397)、MD2(r=0.501)均呈正相关,TNF-α表达水平与TLR4(r=0.478)、MD2(r=0.426)均呈正相关(P<0.001)。
讨 论
炎症反应是人类在进化过程中形成的抵御外界病原体入侵的重要保护机制,然而越来越多的证据表明,许多高危因素可引起炎症反应的发生,而慢性炎症的长期存在可造成许多疾病的发生[5]。相关研究发现,肿瘤组织中浸润了大量的白细胞,因此将肿瘤的研究和炎症反应相结合,一般炎症反应中炎症因子表达种类较多,如TNF、白细胞介素(IL)-1/6、前列腺素(PG)、趋化因子配体2(CCL2)、IL-8等,这些炎症因子可以转移到病灶,形成正反馈的恶性循环[6]。在肿瘤进展的研究中发现,微环境中浸润的炎症细胞和炎症微环境可造成肿瘤细胞的增殖,凋亡的减少,除此之外,这些浸润的炎症细胞还可影响肿瘤的产生,通过对T细胞、自然杀伤细胞的抑制促进肿瘤的进展[7]。
颅内HGA是一种恶性程度极高的肿瘤,在星形细胞瘤的研究中同样发现炎症反应起重要作用[8],TLR4及其附属蛋白MD2是介导LPS信号的关键通路[9],与LPS引起的神经炎症反应密切相关。LPS与TLR4的结合还需要MD2的介导,MD2是表达在胞膜上的一种蛋白,研究发现,单独的TLR4无法与LPS结合,而MD2和TLR4共转染后可很好的介导LPS的炎症反应,且同时激活下游的核因子(NF)-κB和MAPK信号[10-11]。Dziarski等[12]发现,MD2不仅可以增强TLR4介导的LPS反应,还可以增强革兰阳性菌的肽聚糖、磷脂酸反应,拓宽了TLR4对于LPS结构的识别范围。Rajamanickam等[13]研究发现,MD2抑制剂L6H21可通过阻断TLR4-MD2/NF-κB信号通路来抑制结肠肿瘤的侵袭和转移。Kanczkowski等[14]研究报道,TLR4-MD2信号与肾上腺肿瘤的发生、发展有一定关联。
接头蛋白MYD88在TLR4-MD2通路中扮演重要角色,Kawai等[15]研究发现,MYD88缺失小鼠对LPS具有抵抗性,且这些小鼠腹腔提取的巨噬细胞无法被LPS识别产生促炎因子IL-6、TNF-α等,然而LPS刺激这些巨噬细胞后,仍能激活NF-kB和MAPK家族成员。说明MYD88缺失小鼠仍然对LPS刺激有一定的反应性,所以MYD88是关键的TLR4-MD2下游信号因子。TNF-α作为较为关键的炎症因子,于1975年发现,被称为是前炎症细胞因子,启动了炎症反应的关键,可在神经免疫和炎症中发挥重要作用,影响血管内皮细胞和肿瘤血管的增生、炎症反应,还可以促进黏附分子在内皮细胞的表达,引起白细胞的黏附、聚集,从而激活小胶质细胞[16]。TNF-α也是TLR4-MD2信号下游关键的炎症因子,其表达同样与胶质瘤的恶性程度相关[17-18]。
因此,我们推断TLR4-MD2的高表达介导的炎症反应可能与星形细胞瘤的发生和发展密切相关。本研究发现,与LGA组比较,HGA组肿瘤组织中TLR4和MD2呈高表达,且HGA组肿瘤组织中TLR4与MD2的mRNA的表达水平均高于LGA组,均提示TLR4与MD2表达水平升高参与了肿瘤的进展。下游关键的MYD88表达与TLR4-MD2表达相一致,MYD88与TLR4结合可传递炎症信号。
综上,我们发现星形细胞瘤中TLR4-MD2信号、下游MYD88及关键炎症因子TNF-α的表达与肿瘤恶性程度相关,这为星形细胞瘤的发生发展提供新的研究方向,后续可进行深入研究,为星形细胞瘤的诊治提供思路。
