流感病毒感染中炎症小体的激活和调控机制
2021-08-31林裕贵李程颐李培群钟伟娟林春秀张增峰
林裕贵,李程颐,李培群,钟伟娟,林春秀,张增峰
流感是人类的主要传染病之一,除了人流感病毒易感人类外,动物流感病毒也频繁地跨越物种间的屏障向人类传播,严重威胁人类健康和公共卫生安全。研究表明,炎症小体是宿主抗流感病毒感染的重要机制之一,可以激活炎性半胱天冬酶(Caspase)分子,介导促炎细胞因子IL-1β和IL-18的分泌,参与机体的固有免疫和适应性免疫;但是炎症小体过度激活也会激发严重的炎症反应,导致组织器官免疫损伤,因此炎症小体的激活及其调控机制已经成为当前研究的热点。本文主要介绍流感病毒与炎症小体的研究进展,重点介绍流感病毒感染过程中涉及到炎症小体激活和调控的各种细胞和病毒因素,以期有助于流感病毒感染与宿主抗病毒免疫机制的研究。
1 流感病毒与宿主抗感染免疫概述
流感病毒属正粘病毒科,是一种呈球状或丝状的分节段、单股负链RNA病毒,根据核蛋白(Nucleoprotein,NP)和基质蛋白(Matrix protein,M)的抗原特性不同可分为甲(A)、乙(B)、丙(C)、丁(D)4种不同类型。其中,甲、乙、丙型流感病毒均能感染人,而最新发现的丁型流感病毒主要感染牛、猪等家畜,目前尚未发现其可感染人[1]。流感病毒中,甲型流感病毒(Influenza A virus,IAV)宿主范围广、变异速度快、流行范围大、致病力强,因而对人类的危害最大。IAV基因组由8个分节段的RNA组成,编码11种以上蛋白。根据病毒囊膜表面血凝素(Hemagglutinin,HA)和神经氨酸酶(Neuraminidase,NA)的抗原性差异,IAV可进一步分为18种HA亚型(H1-H18)和11种NA亚型(N1-N11),在人类流行的主要有H1N1、H2N2和H3N2亚型。人流感病毒主要感染上呼吸道组织,但持续感染时可感染细支气管、肺泡等下呼吸道组织,从而引发病毒性肺炎;而禽流感病毒主要感染下呼吸道的肺泡[2]。机体的抗感染免疫包括固有免疫和适应性免疫:固有免疫由物理屏障和各种吞噬细胞、自然杀伤细胞以及机体分泌的干扰素(IFNs)等组成,在流感病毒感染的早期启动并形成局部抗感染的免疫微环境;适应性免疫由T淋巴细胞和B淋巴细胞介导,主要依赖细胞毒性T淋巴细胞和中和抗体对被感染的细胞进行杀伤,在感染的中晚期联合固有免疫共同清除病毒。值得注意的是,机体免疫引起的过度炎症反应即“细胞因子风暴”(Cytokine storm)被认为是致病性流感病毒感染致死的主要原因[3]。在这一过程中,炎症小体作为炎症反应的关键启动和调节分子发挥了重要作用。
2 炎症小体在流感病毒感染中的作用
2.1 炎症小体的保护性和损害性作用 炎症小体是由一类具有识别病原体或细胞应激信号功能的胞质模式识别受体(Pattern recognition receptors,PRRs)参与组装的多蛋白复合体[4]。现已发现与流感病毒感染相关的炎症小体PRRs包括:NOD样受体(NOD-like receptors,NLRs)家族的NLRP3、AIM2样受体(AIM2-like receptors,ALRs)家族的AIM2、维甲酸诱导型基因I(Retinoic acid-inducible gene I,RIG-I)以及粘病毒抵抗蛋白A(Myxovirus Resistant Protein A,MxA)。流感病毒感染研究表明,炎症小体兼具保护性和损害性作用。研究发现,与野生型小鼠相比,NLRP3炎症小体或Caspase-1缺陷小鼠的生存率显著下降[5-7],在此过程中,NLRP3炎症小体促进了小鼠感染后的肺部损伤修复[5],同时通过调节CD4+、CD8+T细胞以及B细胞介导的抗体生成而影响了适应性免疫[6]。此外,在流感病毒感染早期使用NLRP3抑制剂MCC950处理可以使小鼠生存率下降,然而在感染中后期使用MCC950处理则可以提高小鼠的生存率,表明NLRP3炎症小体介导的炎症反应可能是影响流感病程的关键因素,在感染的不同阶段起到不同作用[8]。但炎症小体在致病性流感病毒感染中的作用则倾向于损害性,如1918年的流感大流行毒株和高致病性H5N1禽流感病毒,在猴子模型中诱导了依赖于NLRP3炎症小体介导的细胞因子风暴,引发了强烈的肺部损伤[9-10]。此外,AIM2炎症小体在两个独立的小鼠模型研究中也分别表现出了保护性和损害性作用[11-12]。总体而言,炎症小体在流感病毒感染中的作用是一把双刃剑,它所介导的炎症反应对机体正确启动固有免疫和适应性免疫都至关重要,但炎症小体的过度激活可能导致严重的免疫病理损伤,甚至诱发细胞因子风暴。因此,深入了解机体和病毒对炎症小体的激活和调控机制就显得非常重要。
2.2 炎症小体的结构和促炎机制 流感病毒激活的NLRP3、AIM2、RIG-I 以及MxA炎症小体均属于经典模型,主要由感受器蛋白PRRs、衔接蛋白凋亡相关的斑点样蛋白[Apoptosis associated speck-like protein containing CARD(a caspase activation and recruitment domain),ASC]和效应蛋白Caspase-1前体(Pro-Caspase-1)构成,PRRs被刺激激活后,可以通过接头蛋白ASC上的Caspase募集结构域募集Pro-Caspase-1,Pro-Caspase-1随后自我裂解为具有活性的Caspase-1,后者将Pro-IL-1β和Pro-IL-18加工成为成熟的IL-1β和IL-18,从而诱导炎症反应[4]。此外,炎症小体还能诱导一种严格依赖于Gasdermin(GSDM)蛋白家族介导的细胞焦亡,分为人源或鼠源Caspase-1通过炎症小体介导的经典途径和人源Caspase-4,5或鼠源Caspase-11直接结合脂多糖(LPS)介导的非经典途径[13]。经典途径中,焦亡的发生需要持续激活炎症小体,产生的Caspase-1除了裂解Pro-IL-1β和Pro-IL-18,还裂解GSDMD产生具有细胞膜毒性的N端结构域(GSDMD-N),从而导致细胞裂解和促炎因子释放[14]。研究还发现,Caspase-3在化疗药物的作用下,也能作为炎性Caspase裂解GSDME引发焦亡[15]。
3 流感病毒介导炎症小体的激活机制
流感病毒激活炎症小体需要双重信号[16]:第一信号是启动信号,主要依赖于Toll样受体(Toll-like receptors,TLRs)和RIG-I样受体(RIG-I-like receptors,RLRs),通过识别病毒RNA和分泌促炎因子激活核因子κB(NF-κB)信号通路,上调Pro-IL-1β、Pro-IL-18和炎症小体成分的转录表达;第二信号是组装信号,即炎症小体PRRs的激活,进而诱导炎症小体的组装活化。
3.1 TLRs的激活 人体中的TLRs包括TLR1-10,其中TLR3和TLR7/8(高度同源)可以分别感知流感病毒感染所产生的复制中间体双链RNA(Double-stranded RNA,dsRNA)和单链RNA(Single-Stranded RNA,ssRNA),并分别通过含TIR结构域诱导β干扰素的接头蛋白(TIR-domain-containing adaptor inducing interferon-β,TRIF)和髓样分化因子88(Myeloid differentiation factor protein 88,MyD88)途径介导抗病毒免疫反应[17]。不同细胞感染流感病毒后通过不同类型的TLRs激活炎症小体,例如小鼠骨髓来源巨噬细胞(BMMs)主要依靠TLR7来激活[18],而正常人支气管上皮细胞(Normal human bronchial epithelium,NHBE)主要依靠TLR3和RIG-I[19]。这可能与TLRs在不同细胞中的分布差异有关,NHBE中分布有TLR1-6,而TLR7几乎不表达[20]。TLR1、TLR2、TLR4、TLR5、TLR6和TLR9则可以识别脂肽或肽聚糖、LPS、鞭毛蛋白以及含有未甲基化CpG的DNA序列(CpG-DNA)等多种细菌成分[17],其对共生菌群的识别也是炎症小体激活的第一信号的重要来源。感染流感病毒的小鼠经口服抗生素治疗后能抑制NLRP3炎症小体的激活,减少Pro-IL-1βmRNA、Pro-IL-18mRNA的转录以及IL-1β、IL-18的表达,而在使用不同类型的TLRs激活剂聚肌胞苷酸(Polyinosinic polycytidylic acid,Poly I:C)、LPS、鞭毛蛋白、CpG-DNA后能不同程度地恢复小鼠的免疫损伤[21]。肠道菌群对呼吸道抗流感病毒免疫也至关重要,完好的肠道菌群可上调小鼠TLR7信号通路,进而促进呼吸道中炎症小体的激活,减轻流感病毒对呼吸道黏膜的损伤[22]。在流感病毒合并肺炎链球菌感染的小鼠模型中,肺炎链球菌可以激活TLR2,与流感病毒协同作用于NLRP3炎症小体的激活[23]。此外,有研究发现流感病毒的功能RNA蛋白复合物可激活TLR10,并介导细胞因子和β-干扰素的生成[24]。
3.2 RLRs的激活 RLRs是胞质中一类可以识别异己RNA的RNA解旋酶,成员主要包括RIG-I、黑色素瘤分化相关基因5(Melanoma differentiation-associated gene 5,MDA5)和遗传学与生理学实验室蛋白2(Laboratory of genetics and physiology 2,LGP2)。RIG-I和MDA5识别不同类型的RNA,RIG-I识别短链(<300 bp)dsRNA和病毒的含5′端三磷酸基团修饰的ssRNA(5′PPP-ssRNA),MDA5则识别长链(>1 000 bp)dsRNA[25]。RIG-I和MDA5在识别出异己RNA后,通过结合下游线粒体抗病毒信号蛋白(Mitochondrial antiviral signaling adaptor,MAVS)激活NF-κB和干扰素调节因子(Interferon regulatory factor,IRF)IRF3/7信号通路,诱导细胞因子和IFNs的表达,产生抗病毒效应[25]。LGP2则通过结合RIG-I、MDA5起到免疫调节作用[26],或协助RIG-I、MDA5与RNA的组装[27]。有研究发现MDA5也参与了流感病毒感染的先天免疫应答,但其机制尚不明确[28]。此外,RIG-I还具有炎症小体感受器的作用。研究发现,RIG-I是流感病毒感染人原代肺上皮细胞及NHBE细胞过程中主要的炎症小体激活因子,IL-1β的分泌主要依赖于RIG-I,而非NLRP3;免疫共沉淀试验进一步发现,与正常肺上皮细胞或NHBE细胞相比,流感病毒感染的细胞内RIG-I/Caspase1和RIG-I/ASC复合体明显增加,表明RIG-I可独立组装成RIG-I炎症小体[19]。
3.3 NLRP3的激活 NLRP3炎症小体是现已知激活剂类型最多样化的炎症小体,可以识别各种病原体以及内源性分子引发的多种细胞损伤信号而激活,如细胞体积改变、溶酶体破裂、活性氧(Reactive oxygen species,ROS)或线粒体DNA(Mitochondrial DNA,mtDNA)、K+外流以及Ca2+离子信号升高等[29]。研究表明,流感病毒也能有效地激活NLRP3炎症小体,主要通过以下机制:1)病毒RNA激活:研究发现,流感病毒感染或转染病毒RNA到小鼠或人源巨噬细胞,以及将纯化的病毒RNA或RNA类似物Poly I:C直接注射到小鼠腹腔,都能诱导依赖于NLRP3的IL-1β分泌并引起炎症反应,这表明流感病毒 RNA可以直接激活NLRP3炎症小体[30];但单纯转染病毒RNA时,NLRP3炎症小体的激活程度要低于病毒感染[6],提示NLRP3炎症小体的激活还与其它病毒感染因素有关。2)线粒体激活:线粒体活性氧(Mitochondrial reactive oxygen species,mtROS)是NLRP3炎症小体激活的一种机制,但研究发现流感病毒并不依赖mtROS来激活NLPR3炎症小体,而是通过NLPR3和MAVS以线粒体膜电位依赖的方式与线粒体融合蛋白2(Mitofusin2,Mfn2)结合而激活[31];但 mtROS可能参与了相关过程,小鼠感染流感病毒后使用mtROS抑制剂可以减轻气道和肺部的炎症反应,并降低其气道IL-1β的表达[32]。3)PB1-F2(Polymerase basic protein 1-F2,PB1-F2)激活:PB1-F2蛋白是流感病毒表达的一种毒力因子,研究发现高分子量的PB1-F2蛋白聚合物能诱导NLRP3炎症小体的形成,暴露在PB1-F2蛋白或感染表达PB1-F2蛋白的IAV都能引起小鼠强烈的炎症反应[33]。此外,PB1-F2蛋白具有靶向线粒体的序列,来自致病性H7N9禽流感病毒的PB1-F2蛋白可以定位在线粒体上并诱导mtROS生成,从而激活NLRP3炎症小体[34]。4)基质蛋白2(Matrix protein 2,M2)激活:流感病毒M2蛋白是一种具有离子通道活性的膜蛋白,当病毒复制时主要表达于细胞的膜系统。研究发现,M2蛋白可以通过在高尔基体反面网状结构上转出质子[18]或在细胞膜上介导K+外流[35],引起细胞内离子浓度紊乱,激活NLRP3炎症小体。5)Z-DNA结合蛋白1(Z-DNA-Binding Protein 1,ZBP1)激活:ZBP1是一种由IFNs诱导产生的多功能感受器,可以识别细胞内的DNA和RNA。最新研究发现,ZBP1还可以识别流感病毒的NP和聚合酶碱性蛋白1(Polymerase basic protein 1,PB1),在流感病毒感染时通过两个受体相互作用蛋白同型结构域(RIP homotypic interaction motif,RHIM)募集RIP激酶(RIPK)RIPK1和RIPK3介导不同的细胞死亡方式,ZBP1-RIPK1诱导细胞凋亡或坏死性凋亡,而ZBP1-RIPK3激活NLRP3炎症小体诱导细胞焦亡[36]。RIPK1-RIPK3复合体还能激活动力蛋白相关蛋白1(Dynamin-related protein 1,DRR1),并迁移向线粒体,导致线粒体损伤和NLRP3炎症小体的激活[37]。(6)2′-5′寡聚腺苷酸合成酶/核糖核酸酶L(2′-5′ oligoadenylate synthetase/RnaseL,OAS/RnaseL)激活:OAS酶是IFNs诱导的抗病毒蛋白,能催化ATP合成2′-5′寡聚腺苷酸,激活RnaseL对流感病毒ssRNA的酶切活性,产生的RNA裂解产物再通过DHX33解旋酶和MAVS激活NLRP3炎症小体[38]。见图1。
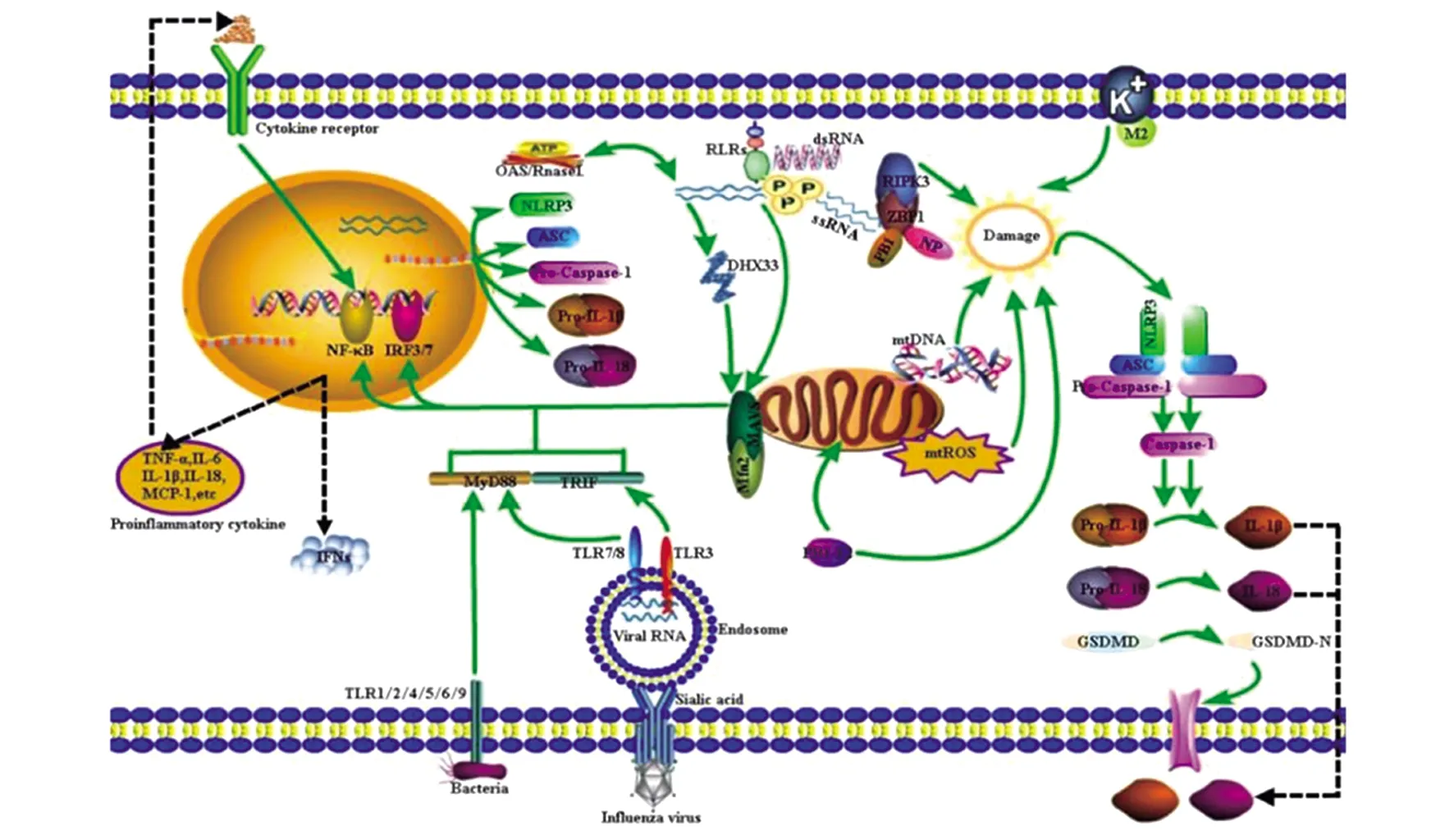
图1 流感病毒感染中NLRP3炎症小体的激活机制
3.4 MxA的激活 MxA是IFNI诱导产生的一种广谱抗病毒蛋白,最新研究发现MxA在呼吸道上皮细胞中能识别流感病毒NP,并通过GTP酶结构域与ASC结合,从而作为一个炎症小体感受器发挥作用,用MxA转基因小鼠感染IAV后,发现MxA能在感染早期引起呼吸道上皮细胞的快速炎症反应,促进早期肺内IL-1β生成和粒细胞募集[39]。
3.5 AIM2的激活 AIM2是一种胞质感应器,能识别来自病毒、细菌或自身细胞损伤的dsDNA,在固有免疫反应中起着重要作用。研究表明,感染流感病毒的细胞可在死亡裂解后释放出自身dsDNA,从而激活AIM2炎症小体[11-12]。
4 机体对炎症小体的调控和流感病毒的免疫逃逸
4.1 机体对炎症小体的调控 炎症小体受机体正、负两个方向的调控,使机体既能有效清除病毒,又避免了免疫病理损伤。炎症小体正调控机制中,主要是RIG-I-IFNs通路:流感病毒感染激活RIG-I引发IFN-I反应,而IFN-I与干扰素受体1(Interferon alpha/beta receptor 1,IFNAR1)结合后,能激发RIG-I、TLR3和NLRP3的表达,RIG-I激发后进一步促进IFN-I的表达,形成NLRP3炎症小体和RIG-I激活的正反馈途径[19];此外,IFNs能诱导上文提到的ZBP1和OAS/RnaseL的表达和激活,进而激活NLRP3炎症小体。但必须强调的是,IFNs也具有负调控炎症小体的作用,因为其能有效抑制病毒复制,从而缩短炎症时间和发生范围。炎症小体负调控机制中,主要是线粒体自噬:线粒体自噬是一种重要的自我调节机制,它能将损伤的线粒体通过自噬体转运到溶酶体内进行降解,从而有利于维持细胞的稳态。研究发现,NOD2-RIPK2信号途径能够激活启动线粒体自噬的关键分子UNC-51样激酶1(Unc-51 like autophagy activating kinase 1,ULK1),从而清除损伤的线粒体;而敲除RIPK2或ULK1后,细胞的线粒体自噬功能降低,导致线粒体超氧化物增加而激活NLRP3炎症小体[40]。
4.2 流感病毒对炎症小体的免疫逃逸 当宿主与流感病毒在漫长的共同进化中发展出通过炎症小体清除病毒的机制时,病毒也进化出了可以逃逸炎症小体作用的机制。1)PB1-F2:研究发现,PB1-F2蛋白的长度差异可影响炎症小体的激活,大部分致病性毒株表达的全长型PB1-F2蛋白可通过线粒体外膜转位因子40(Translocase of the outer membrane 40,TOM40)向线粒体内膜空间转移,PB1-F2蛋白的积累可减少线粒体内壁碎片的生成,从而抑制NLRP3炎症小体的激活[41]。2)非结构蛋白1(Nonstructural protein 1,NS1):流感病毒NS1蛋白对IFNs具有拮抗作用,它可以与IFNs途径中的病毒RNA、RIG-I、TRIM(Tripartite motif,TRIM)蛋白TRIM25、切割与多聚腺苷酸化特异因子30 kDa亚基(CPSF30)等不同成分相互作用,从而抑制宿主IFNs反应[42]。NS1蛋白还可以抑制NF-κB通路,使ProIL-1βmRNA和ProIL-18mRNA的表达降低,以及通过其RNA结合区和TRIM25结合区靶向作用于NLRP3产生抑制效应[43-44]。
5 展望和总结
截至目前,大量研究肯定了流感病毒感染中炎症小体的重要作用,尤其是在急性或重症流感的不同阶段,炎症小体可能倾向于保护性或损伤性作用,这使得调控炎症小体可能成为一种潜在的流感治疗策略。据报道,在小鼠模型上已开展了大量相关研究,除了上文中的MCC950,还包括预防移植排斥药物西罗莫司[45],P2X7(Purinergic 2X7, P2X7)受体抑制剂丙磺舒和AZ11645373[46]等。其它研究也揭示了炎症小体相关的激活和调控因子,如缺氧诱导因子-2α激活的长链非编码RNA-NEAT1通过作用于Caspase-1促进炎症小体的激活[47];NIMA(Never in mitosis gene A, NIMA)相关蛋白激酶7被证明是激活NLRP3炎症小体的关键上游蛋白[48];波形蛋白促进炎症小体的激活并与急性肺损伤中的炎症和纤维化有关[49];TRIM30通过调节ROS负性调控NLRP3炎症小体的激活[50];AIM2炎症小体诱导细胞膜形成孔隙,进而引起K+外排,触发NLRP3的非常规激活[51]等。但这些研究都不涉及流感病毒,因此这些激活和调控因子在流感病毒感染中的作用还有待明确。总之,进一步了解炎症小体的激活和调控机制,可以加强我们对炎症小体抗流感病毒感染作用的认识,并有助于开发流感治疗的新策略。
利益冲突:无
