一株产香酵母Trichomonascus ciferrii的分离鉴定及其纯种发酵豆豉的挥发性成分分析
2021-08-31文鹤刘江崟胡祥飞李浩杨慧林王筱兰
文鹤,刘江崟,胡祥飞,李浩,杨慧林,王筱兰*
1(江西师范大学 生命科学学院,江西 南昌,330022)2(食品科学与技术国家重点实验室(南昌大学),江西 南昌,330027)
豆豉是我国一种传统发酵豆制品,与天培(tempeh,印度尼西亚根霉型豆豉)、纳豆(natto,日本细菌型豆豉)齐名,因其独特风味受到广大人们喜爱[1-2]。豆豉中挥发性风味成分主要有酯、醛、醇、酚、呋喃、吡嗪等物质,共同赋予豆豉酯香、醇香和酱香等风味。豆豉根据生产工艺主要分为霉菌型和细菌型,而霉菌型豆豉根据制曲菌种不同又可划分为曲霉型、毛霉型和根霉型[3-4],生产工艺、菌种及环境的区别导致不同类型豆豉挥发性成分种类及含量存在明显差异[5]。这些挥发性成分除极少数来源于原料本身外,大多数是在生产加工过程中经不同微生物生长代谢产生的[6]。
我国豆豉生产工艺多沿袭传统方法,采用自然发酵,主要包括制曲和发酵(后发酵)两个阶段,在开放式环境中制曲且后发酵时间长达半个多月,外界环境对其风味、品质影响较大[3,7]。自然发酵极易受气温影响,且生产周期长,开放式生产环境难以适应消费者对食品安全及卫生等方面要求,如何提高生产水平、稳定产品品质、实现工业化成为豆豉生产企业急需解决的难题。以往豆豉研究方向主要集中在可培养和非可培养微生物多样性[8],对豆豉风味物质是由何种功能微生物产生缺乏相关研究。丰富的风味物质与多种微生物生长代谢密切相关,此前本课题组已从豆豉中筛选获得高产脂肪酶[9]、蛋白酶[10]、酒精[11]、乳酸[12]的菌株,这些产脂肪酶和蛋白酶的菌株能分解大豆中的大分子物质,生成甘油、脂肪酸、甘油单酯、二酯、氨基酸和糖类等风味前体物质,或者通过糖酵解作用直接形成乳酸、乙醇等风味物质,赋予豆豉特有的风味。通过筛选优良菌株进行豆豉纯种发酵,对控制发酵参数、避免杂菌污染、缩短生产周期、实现工业化生产和改善品质及风味有着重要意义。
本研究拟从自然发酵豆豉中筛选获得优良产香菌株,采用固相微萃取-气相色谱质谱联用技术(solid phase micro extraction-GC-MS,SPME-GC-MS)分析对比该菌株纯种发酵豆豉与自然发酵豆豉中风味物质变化,对纯种发酵豆豉品质及挥发性成分进行评价,以考察豆豉纯种发酵生产的可行性,揭示曲霉型豆豉自然发酵生产过程中风味、功能微生物和核心功能菌群之间的相关性,为豆豉传统生产和现代生产工艺结合奠定基础。
1 材料与方法
1.1 材料与试剂
曲霉型豆豉,江西南昌稻香园调味食品有限公司;黑豆(符合食品加工要求),市售;正构烷烃(C8~C40)混合标品,西格玛公司;邻氨基苯甲酸甲酯、苯甲酸甲酯(色谱纯),阿拉丁试剂有限公司;Yeast基因组DNA提取试剂盒,OMEGA公司。
脑心浸液肉汤培养基(brain heart infusion,BHI)(g/L):葡萄糖2.0,蛋白胨10.0,脱水小牛脑浸粉12.5,脱水牛心浸粉5.0,NaCl 5.0,磷酸氢二钠2.0。
1.2 仪器与设备
T100 PCR仪,BIO-RAD;固相微萃取装置(包括手柄和DVB/CAR/PDMS萃取头),Supelco公司;PowerEase 90 W核酸凝胶电泳仪,Life technologies公司;7890A/5975气相色谱-质谱联用仪,Agilent公司。
1.3 实验方法
1.3.1 样品采集
在同一生产周期内采集样品,取后发酵的第1、5、9、13、19天的豆豉样品,采集后用无菌的塑封袋密封,冰袋冷藏带回实验室进行下一步操作,置于实验室4 ℃冰箱冷藏备用。
1.3.2 菌株的筛选与鉴定
1.3.2.1 菌种富集培养
分别取4 g以上5组豆豉样品加到装有10 mL无菌生理盐水的试管中,涡轮振荡5 min,吸取1 mL菌液接入装有100 mL BHI培养基的锥形瓶中,30 ℃、180 r/min摇床培养24 h。采用平板稀释涂布法,分别取上述培养基中的菌液梯度稀释至10-4~10-7,取100 μL分别均匀涂布到BHI培养基平板上,于30 ℃恒温培养36 h,挑取不同菌落形态的菌株转至斜面上,于4 ℃冰箱中保存。
1.3.2.2 分离纯化
将筛选得到菌株在BHI培养基平板上划线分离,在30 ℃恒温培养箱培养24 h,重复划线3次以上,在显微镜下观察到形态单一的菌体则说明菌株已经分离纯化。
1.3.2.3 菌株鉴定
将上述目的菌株划线活化后,观察菌落形态特征;对菌株进行革兰氏染色,用光学显微镜观察细胞形态;采用Yeast基因组DNA提取试剂盒并参照试剂盒内说明书提取总DNA。选用真菌通用引物ITS 1/ITS 4进行扩增。PCR反应体系50 μL[2]:Premix Taq 25 μL、Primer F 1 μL、Primer R 1 μL、模板 1 μL、ddH2O 22 μL。热循环参数:95 ℃预变性3 min,95 ℃ 变性30 s,55 ℃退火30 s,72 ℃延伸60 s,循环30次,72 ℃延伸5 min。产物经电泳验证PCR扩增成功后将产物送至上海生工进行测序,测序结果提交到GenBank获得登录号,在NCBI里进行Blast序列比对分析,然后通过MEGA 6.0软件用领接法(Neighbor-Joining,NJ)构建系统进化树。
1.3.3 豆豉采集
纯种发酵样品:用接种环挑取适量上述菌接种到装有100 mL YPD液体培养基的锥形瓶中,30 ℃、180 r/min恒温培养36 h,再将菌液(5×106CFU/mL)按10%接种量接种到经121 ℃、20 min蒸熟的市售黑豆中,不经过制曲环节,直接在烧杯中30 ℃恒温发酵19 d。发酵结束,在烧杯上、中、下3层取样(深度分别为5、10、15 cm,下同),取样后充分混匀,每份样品采集3组。
自然发酵样品:该豆豉是经过传统工艺的制曲、洗曲阶段后,在发酵池自然发酵19 d的样品。在同一发酵池的上、中、下3层取样,取样后充分混匀,每份样品采集3组。
1.3.4 SPME萃取挥发性成分
将DVB/CAR/PDMS萃取头按照包装里的说明书进行老化备用,将自然发酵第19天、纯种发酵第19天的豆豉样品(每个样品设置3组重复)进行研磨,分析前取研磨后的豆豉样品过40目筛。取3 g样品,加入到20 mL顶空进样瓶中,采用恒温水浴加热,60 ℃平衡20 min,将SPME装置置于顶空进样瓶上方,60 ℃恒温萃取30 min,再采用GC-MS分析[13]。
1.3.5 标准曲线测定
取250 mg苯甲酸甲酯标品,100 mg邻氨基苯甲酸甲酯标品,溶解于25 mL无水乙醇中配成母液,依次分别取1.25、1.00、0.833、0.714、0.625、0.50 mL的母液,分别加入一定量的乙醇,定容至5 mL。取全部上述溶液,采用1.3.4中挥发性成分SPME的条件进行萃取后,再采用GC-MS分析。采用标准曲线法计算样品中目标物质的含量,以2.50、2.00、1.67、1.43、1.25、1.00 g/L质量浓度的苯甲酸甲酯为横坐标,峰面积为纵坐标,制作苯甲酸甲酯标准曲线;以1.00、0.80、0.67、0.57、0.50、0.40 g/L质量浓度的邻氨基苯甲酸甲酯为横坐标,峰面积为纵坐标,制作邻氨基苯甲酸甲酯标准曲线,测出样品的峰面积后在标准曲线上查出其对应的浓度。
1.3.6 GC-MS分析条件
色谱条件参照文献[14]:Agilent 19091S-433毛细管柱(30 m×0.25 mm×0.25 μm);进样口温度250 ℃,载气He,流速1.0 mL/min,分流进样;升温程序:起始40 ℃,保持5 min,5 ℃/min升至85 ℃,10 ℃/min升至250 ℃,保持5 min。
质谱条件:离子源EI,电离电压70 eV,离子源温度230 ℃,四极杆温度150 ℃,全扫描模式,质量扫描范围35~400 amu。
1.3.7 成分鉴定及含量计算
定性分析:各样品组分质谱信息与NIST08质谱库进行检索,初步确定化合物,采用样品GC-MS分析条件进行正构烷烃C8~C40系列混合标品分析,根据文献[15]中的方法计算线性保留指数(linear retention indice,LRI),再与NIST数据库中的线性保留指数进行比,对化合物定性进行进一步确认[14]。
定量分析:挥发性成分相对含量用峰面积归一化法计算[16];采用外标法对纯种发酵豆豉中主要挥发性成分定量,用主要挥发性成分标准品的峰面积与其对应的浓度做标准曲线,根据标准曲线法计算样品中目标物质的含量。
2 结果与分析
2.1 菌株的筛选与鉴定
2.1.1 菌株形态特征
经过富集和分离纯化,从自然发酵豆豉中分离获得23株不同的菌株,经复筛得到1株产香能力较强的菌株,命名为WLW。通过菌落形态观察,菌落直径2~3 mm,奶油色,半球状,大而隆起,表面较光滑,湿润,不易挑起,有大量向下生长嵌入培养基的假菌丝;光学显微镜观察显示该菌株形成较长的藕节状假菌丝。

a-菌落形态;b-显微形态图1 WLW在YPD培养基上的菌落形态及显微形态Fig.1 Colony morphology and microscopic morphology of WLW on YPD medium
2.1.2 ITS序列及系统发育分析
将上海生工的测序结果上传到GenBank,获得登录号MW509947.1,再将ITS基因序列在NCBI数据库中进行Blast同源性比对。利用MEGA 6.0软件进行多序列比对分析,用NJ法构建系统发育树(图2)。结果显示菌株WLW与Trichomonascusciferrii(KY109915.1)的同源性达99%以上。综合WLW菌株的形态学特征、生理生化特征及同源性和系统发育分析,将菌株WLW鉴定为Trichomonascusciferrii。将该菌株送至广东省微生物菌种保藏中心(GDMCC)进行保藏,保藏号为:GDMCC No.61319。
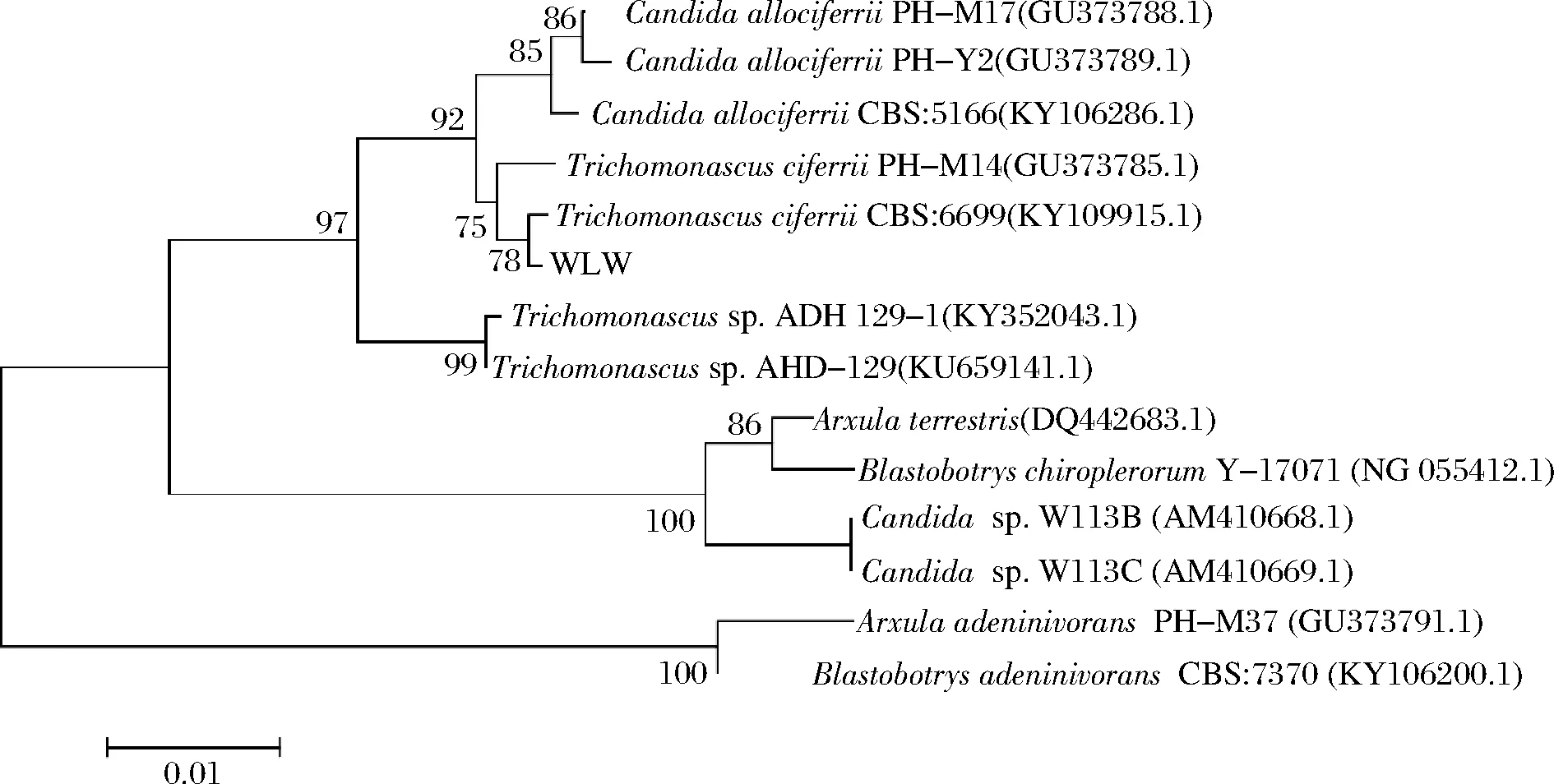
图2 基于ITS序列构建的菌株WLW系统发育树Fig.2 Phylogenetic tree of strain WLW based on ITS sequence
2.2 纯种发酵和自然发酵豆豉挥发性成分的总离子流色谱图
纯种发酵和自然发酵豆豉挥发性成分用SPME萃取后再通过GC-MS分析,得到样品中挥发性成分GC-MS总离子流色谱图。由图3可知,色谱峰较均匀分布在0~40 min,并且丰度较高,说明GC-MS条件适宜[17]。SPME是根据萃取头极性不同,通过相似相溶原理萃取不同的物质,李金林等[13]发现豆豉中挥发性物质极性成分占比较高,而DVB/CAR/PDMS萃取头属于中等极性,适用于萃取中等极性和极性化合物,这说明用DVB/CAR/PDMS萃取头对豆豉样品进行SPME萃取较为合适。由图3-a可以看出,豆豉纯种发酵的挥发性成分中有2种化合物的峰面积尤为突出,由图3-b可以看出,豆豉自然发酵的挥发性成分中有3种化合物的峰面积较为突出。
2.3 纯种发酵和自然发酵豆豉挥发性成分鉴定
采用NIST08质谱库检索和NIST数据库比对,进一步确定检测到的挥发性成分,结果如表1所示,纯种发酵豆豉共检测出44种挥发性成分,其中酯3种、酮2种、酚3种、醇12种、醛5种、酸5种、吡嗪7种、呋喃2种、芳香族3种、其他2种;自然发酵豆豉共检测出87种挥发性成分,其中酯15种、酮7种、酚5种、醇10种、醛10种、酸10种、吡嗪10种、呋喃3种、芳香族6种、其他11种。
采用外标法对纯种发酵豆豉中的主要挥发性成分进行定量分析,以外标物苯甲酸甲酯的质量浓度X(g/L)及其对应的峰面积做标准曲线为y=47 713 490.20x+126 056 260.05,R2=0.995,以外标物邻氨基苯甲酸甲酯的质量浓度X(g/L)及其对应的峰面积做标准曲线为y=75 257 089.46x-25 853 586.18,R2=0.991,2种方法的线性较好且符合方法学要求。
2.4 纯种发酵和自然发酵豆豉挥发性成分对比分析
纯种发酵和自然发酵豆豉中挥发性成分种类、数量及含量变化如图4所示。通过表1分析发现,在发酵19 d后,自然发酵豆豉形成的挥发物种类为纯种发酵豆豉的1.98倍,峰面积总和也远超纯种发酵豆豉。自然发酵豆豉中各种类风味物质含量较为均衡,共同造就豆豉酯香、醇香和酱香等多层次风味特征,而纯种发酵豆豉形成的44种风味物质中,酯类化合物相对含量高达81.66%,尤其是苯甲酸甲酯和邻氨基苯甲酸甲酯2种风味物质格外突出。其中纯种发酵豆豉中有9种风味物质在自然发酵豆豉中未检出,但也仅为纯种发酵总挥发性成分的1.38%,可能是在自然发酵豆豉中含量过低而未能检测出。以上说明利用WLW菌株纯种发酵豆豉工业化生产可行,虽没有自然发酵豆豉挥发性成分种类多,但该菌株纯种发酵豆豉能高产酯类化合物,赋予豆豉更浓郁的酯香、果香和花香。

表1 纯种发酵和自然发酵豆豉中主要挥发性成分Table 1 The main volatile components in fermented Douchi by purebred fermentation and natural fermentation

续表1

a-挥发性成分数量变化;b-挥发性成分含量变化图4 纯种发酵和自然发酵豆豉中挥发性成分种类、数量及含量变化Fig.4 Chang in species, amount, and content of volatile compounds in fermented Douchi by purebred and natural fermentation
在自然发酵豆豉中挥发性成分主要为酸、醛、酚、醇,分别占总挥发性成分的36.49%、24.59%、11.41%、9.43%。酸、醇赋予豆豉甜香、果香、奶酪味、脂香、花香等有益风味。2-甲基丁酸和异戊酸分别占总挥发性成分的19.02%、13.44%,2-甲基丁酸具有辛辣的羊乳干酪味和愉快的水果香气,异戊酸具有赋予豆豉甜香、果香、奶油香、浆果香等美好风味。酸类物质含量较高的原因可能是由蛋白质和脂肪分解产生的氨基酸、脂肪酸等大分子继续分解产生小分子酸类风味物质造成的[18],赵文鹏等[19]发现酸类化合物主要是在后发酵过程中产生的。醇类物质可由羰基化合物通过还原作用或微生物代谢生成[20],大量酸类物质的存在可以和醇类化合物通过酯化反应形成酯类化合物,豆豉特殊风味是一个缓慢形成的过程[21]。李金林等[13]在研究曲霉型豆豉时发现酯类是后发酵过程中形成最多的一类物质,醛是大豆中脂肪氧化产物[18],醛类化合物主要为苯甲醛和可卡醛,分别占总挥发物的15.70%和4.55%,苯甲醛是一种工业上常用的芳香醛,具有强烈的杏仁气味,同时具有甜香、坚果香和樱桃味等良好风味,可卡醛具有苦可可香、坚果香、烘烤香、甜香和青草香等良好风味。在自然发酵豆豉中酸、醛、酚、醇的含量占总挥发性成分的52.71%,共同组成豆豉特有的风味。
纯种发酵豆豉中挥发性成分主要为酯、芳香族、呋喃、醇,含量分别为总挥发性成分的81.66%、5.86%、4.99%、4.61%,尤为突出的是酯类化合物中的苯甲酸甲酯和邻氨基苯甲酸甲酯,分别占纯种发酵豆豉总挥发性成分的60.49%和21.16%,二者之和超过80%,而二者在自然发酵中占其总挥发性成分的0.61%和0.23%,差异明显。其中苯甲酸甲酯具有强烈的果香和花香,有晚香玉和依兰依兰似的香韵,天然存在于依兰依兰花、晚香玉花和丁香花中;邻氨基苯甲酸甲酯具有强烈的果香和花香,天然存在于晚香玉、茉莉花、栀子花和橙花中。苯甲酸甲酯的峰面积高达(1 924.51±0.35)×105mAu·min,邻氨基苯甲酸甲酯的峰面积也达到(673.21±5.56)×105mAu·min,分别代入上步相对应的标准曲线换算可得苯甲酸甲酯在1 g豆豉中的含量约为23.48 mg,邻氨基苯甲酸甲酯在1 g豆豉中的含量约为2.06 mg,正是由于二者表现出强烈的花香和果香,纯种发酵的豆豉中能直接闻到茉莉花香和晚香玉似的香韵。
自然发酵豆豉呈现复合风味,而纯种发酵豆豉在风味方面表现出浓郁的酯香、果香和花香的特点,远超自然发酵豆豉。市售的豆豉往往采用自然发酵工艺,不同甚至同一品牌的不同生产批次产品的风味和品质都有较大差别。虽然自然发酵豆豉有多层次味觉体验,但不可控的生产工艺、粗放的生产环境可能造成豆豉霉变、口感风味下降甚至导致严重的食品安全问题[3]。通过添加菌种进行纯种发酵、严格控制发酵工艺能有效解决以上问题,尽管纯种发酵豆豉没有自然发酵豆豉的多重味觉体验,但可以通过筛选获得自然发酵过程中优势微生物和多菌种搭配改良产品营养和风味,为工业化大批量生产风味豆豉提供可能。
3 结论
本研究通过筛选分离得到1株产香酵母Trichomonascusciferrii,命名为WLW。利用WLW纯种发酵豆豉19 d后,以自然发酵19 d的豆豉为对照,采用SPME-GC-MS分析2组样品中挥发性成分,对纯种发酵豆豉的品质进行评价。自然发酵豆豉共检出87种挥发性成分,纯种发酵豆豉共检出44种挥发性成分,前者挥发性成分种类约为后者的1.98倍。自然发酵豆豉中各种类风味物质含量较为均衡,共同赋予豆豉酯香、醇香和酱香等多层次风味特征;而纯种发酵豆豉中酯类化合物相对含量高达81.66%,其中酯类化合物中的苯甲酸甲酯和邻氨基苯甲酸甲酯分别占总挥发性成分的60.49%、21.16%,苯甲酸甲酯在豆豉中的含量约为23.48 mg/g,邻氨基苯甲酸甲酯在豆豉中的含量约为2.06 mg/g,二者都具有强烈的花香和果香等美好风味。利用该菌株纯种发酵虽没有自然发酵豆豉挥发性成分种类多,但纯种发酵能高产酯类化合物,赋予豆豉更浓郁的酯香、花香和果香。自然发酵豆豉不可控的生产工艺、粗放的生产环境容易造成产品品质下降,甚至引发严重的食品安全问题,而纯种发酵可控的发酵工艺和更浓郁的风味特征可以改良豆豉的品质,该菌株纯种发酵工业化生产豆豉方案可行。豆豉风味物质的形成是由多种微生物代谢共同作用的结果,风味物质形成与功能微生物之间的关联还需要在未来进行进一步的研究。
