阳春砂根茎多糖分离纯化、结构表征及抗氧化活性
2021-08-31周洋杨得坡钱纯果何翠淇钟镜堂徐新军赵志敏
周洋,杨得坡,2,钱纯果,何翠淇,钟镜堂,徐新军,2,赵志敏,2*
1(中山大学 药学院,广东 广州,510006)2(广东省现代中药工程技术研究开发中心,广东 广州,510006)3(广东呀依山珍稀药材种植有限公司,广东 河源,517428)
砂仁为姜科植物阳春砂(AmomumvillosumLour.)、绿壳砂(AmomumvillosumLour.varxanthioidesT.L.Wu et Senjen)或海南砂(AmomumlongiligularT.L.Wu)的干燥成熟果实。药理学研究证实,砂仁具有多种生物学活性,如:抗炎、抑菌、调节菌群、降血糖和抗氧化等[1]。其中阳春砂仁是砂仁的主要来源,为药食同源药材,需求量大。阳春砂为多年生草本植物,需每周期更新种植,以提升砂仁产量和品质,因此产生大量的阳春砂植株,这些植株大多被随意丢弃或焚烧,对环境造成一定污染。造成这种现象的原因是目前国内外关于阳春砂的研究多集中于种子团及其中的挥发油,对其他部位和其他成分的研究较少,阳春砂未能得到充分开发利用。尤小梅等[2]比较了阳春砂仁根和叶水提物的抗氧化活性,水提物对羟自由基清除率最高可达100%,活性大小依次为:根>叶>茶多酚。多糖是水提物中的一类重要物质,关于阳春砂根茎多糖(Amomumvillosrmrhizome polysaccharide,AVRP)的研究未见报道。
多糖是由10个以上单糖通过糖苷键连接而成的聚合物,具有广泛的生物活性,如:抗氧化[3]、免疫调节[4]、抗肿瘤[5]和降血糖活性[6]等。天然多糖因具有良好的生物活性和无毒性、良好的生物降解性和生物相容性等特点,成为目前国内外研究的热点。关于阳春砂多糖的研究较少,且多聚焦于阳春砂仁粗多糖的提取方法和生物活性[7-9],关于阳春砂除果实外其他部位多糖的研究未见报道。
本研究通过对AVRP进行分离纯化、结构特征及抗氧化活性的研究,旨在为充分利用阳春砂打下基础,为AVRP的开发和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
实验材料:新鲜阳春砂根茎(经鉴定为阳春砂),广州市从化区药材基地;
实验试剂:单糖标准品和三氟乙酸,美国Sigma-Aldrich公司;DEAE-52和Sephadex G-100填料,索莱宝公司;浓硫酸,广州市梓兴化玻仪器有限公司;氢氧化钠,广州化学试剂厂;苯酚,天津市大茂化学试剂厂。
1.2 仪器与设备
EYELA N-1100旋转蒸发仪,日本东京理化器械株式会社;T6紫外可见分光光度计,北京普析通用仪器有限责任公司;Spectrum Two傅里叶变换红外(Fourier transform infrared,FT-IR)光谱仪,美国Perkin-Elmer公司;SHIMADZU LC-20A高效液相色谱仪(配ELSD-LT 2蒸发光检测器),日本岛津公司;FLUOstar Omega全自动多功能酶标仪,德国BMG Labtech公司。
1.3 AVRP的提取
称取200 g粉碎后的阳春砂根茎粉末,加入4 L 95%(体积分数)乙醇,80 ℃回流提取3 h,重复操作3次,将粉末烘干,得阳春砂根茎脱脂粉末。200 g阳春砂根茎脱脂粉末加4 L水,95 ℃提取3 h,重复3次,将水提液于60 ℃下减压浓缩,得浓缩液。向浓缩液中加入4倍体积的无水乙醇,于4 ℃静置12 h,离心收集沉淀。将沉淀复溶于去离子水中,得多糖溶液,向溶液中加入4倍体积的Sevage试剂(氯仿-正丁醇体积比4∶1),剧烈振荡后离心,取上清液,重复操作,直至溶液中无变性蛋白质,冻干后得AVRP。
1.4 AVRP的分离纯化
称取AVRP 100 mg,配制成质量浓度为20 mg/mL的溶液,经DEAE-52纤维素离子交换柱分离,依次用浓度为0、0.1、0.3、0.5、1.0 mol/L NaCl溶液进行洗脱,洗脱流速为1 mL/min,10 min/管,使用全自动馏分收集器收集,苯酚-硫酸法进行监测,得到0和0.1 mol/L NaCl洗脱下的2个组分,收集含量更多的0.1 mol/L NaCl溶液洗脱下来的组分,60 ℃减压浓缩,用截留分子质量为3 500 Da的透析袋透析,冷冻干燥得AVRPD-1。
取AVRPD-1粉末20 mg,配制成5 mg/mL的溶液,经葡聚糖凝胶Sephadex G-100柱分离,去离子水洗脱,洗脱流速为3 mL/10 min,洗脱时间为10 min/管,使用全自动馏分收集器收集,苯酚-硫酸法测多糖含量,合并同一组份,经浓缩、冷冻干燥后得到AVRP-1。
1.5 AVRP-1的组分测定
1.5.1 总糖含量测定
采用苯酚-硫酸法[10]测定AVRP-1的总糖含量,葡萄糖为标准品。精确称取葡萄糖标准品25.0 mg,定容至500 mL,得葡萄糖标准液。分别取葡萄糖标准液0、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL,加去离子水补足至1.0 mL,即得不同浓度的标准溶液,加入0.5 mL 60 g/L的苯酚溶液,混匀后缓慢滴加2.5 mL浓硫酸,室温下静置30 min,于490 nm处检测吸光度值。以吸光度值为纵坐标,葡萄糖浓度为横坐标绘制标准曲线,求出回归方程。配制质量浓度为0.04 mg/mL的AVRP-1溶液,测定方法同上,重复3次,根据回归方程求得总糖含量。
1.5.2 蛋白质含量测定
蛋白质含量测定采用Bradford法[11],牛血清白蛋白(bovine serum albumin,BSA)为标准品。精确称取50.3 mg考马斯亮蓝G250,溶于25 mL 90%(体积分数)乙醇溶液中,加入85%(体积分数)磷酸溶液55 mL,定容至500 mL,滤纸过滤后存于棕色试剂瓶中,得考马斯亮蓝标准溶液。精确称量10.0 mg BSA溶于100 mL容量瓶中,去离子水定容,得BSA标准溶液。分别取0.01、0.02、0.04、0.08、0.12、0.16、0.20 mL BSA标准溶液于试管中,以去离子水补足至1.0 mL,分别加入考马斯亮蓝溶液1.0 mL,充分混匀,于595 nm处测定其吸光度值。以吸光度值为纵坐标,BSA浓度为横坐标,绘制标准曲线,求出回归方程。配制质量浓度为2.0 mg/mL的AVRP-1溶液,测定方法同上,重复3次,根据回归方程求得蛋白质含量。
1.5.3 糖醛酸含量测定
糖醛酸含量测定采用m-间羟基联苯法[12],半乳糖醛酸(galacturonic acid,GalA)为标准品。精确称取1.191 8 g四硼酸钠,浓硫酸定容至250 mL,得0.012 5 mol/L四硼酸钠溶液;精确称取10.0 mg GalA,去离子水定容至100 mL,得0.1 mg/mL标准GalA溶液;精确称取75.0 mg间羟基联苯,用质量浓度5 g/L NaOH溶液定容至50 mL,得1.5 mg/mL间羟基联苯溶液。分别取标准GalA溶液0、0.05、0.1、0.2、0.3、0.4、0.5、0.6、0.7 mL于试管中,加去离子水补足至1.0 mL,冰浴中冷却数分钟后,每个试管中加入四硼酸钠溶液6.0 mL,轻轻振摇,沸水浴中加热5 min后立即放入冰水浴中冷却到室温,加入1.0 mL间羟基联苯,振摇混匀后于520 nm处测吸光度。以吸光度值为纵坐标,GalA浓度为横坐标,绘制标准曲线,求出回归方程。配制质量浓度为0.1 mg/mL的AVRP-1溶液,测定方法同上,重复3次,根据回归方程求得糖醛酸含量。
1.6 AVRP-1纯度鉴定及相对分子质量(Mw)测定
利用高效凝胶渗透色谱法(high-performance gel permeation chromatography,HPGPC)测定样品纯度及Mw。取已知Mw的葡聚糖标准品(5、12、25、50、150、410 kDa)配制成2.0 mg/mL的溶液,经0.22 μm滤膜过滤后进样,进样量20 μL,洗脱时间30 min。色谱条件:色谱柱型号为PolySep-GFC-P4000,流动相为水,流速为1.0 mL/min,柱温35 ℃,检测器为ELSD-LT Ⅱ型号的蒸发光检测器(SHIMADZU),检测器温度为60 ℃,Gain值为10。以标准葡聚糖Mw的对数lgMw为纵坐标,保留时间为横坐标,绘制标准曲线并得到回归方程。取AVRP-1配制成2.0 mg/mL的溶液,相同条件下进样,记录保留时间。根据样品峰形鉴定AVRP-1的纯度,标准曲线求得Mw。
1.7 AVRP-1单糖组成分析
参照文献方法[13],采用HPLC法测定AVRP-1的单糖组成。
混合标准单糖的1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolinone,PMP)衍生化:分别取0.05 mL 2.0 mmol/L单糖标准品:甘露糖(mannose,Man)、鼠李糖(rhamnose,Rha)、葡萄糖醛酸(glucuronic acid,GlcA)、GalA、葡萄糖(glucose,Glc)、半乳糖(galactose,Gal)、木糖(xylose,Xyl)、阿拉伯糖(arabinose,Ara)和岩藻糖(fucose,Fuc)溶液于反应管中混合,加入0.5 mol/L PMP甲醇溶液和0.3 mol/L NaOH溶液各0.45 mL,混匀后70 ℃反应30 min,冷却后加入0.46 mL 0.3 mol/L的HCl溶液中和,然后加入1.0 mL氯仿溶液,振摇,离心,弃氯仿层,重复3次去除过量的PMP,水层过0.45 μm滤膜后于HPLC检测。HPLC条件:SHIMADZU高效液相色谱仪,Agilent ZORBAX XDB-C18柱,波长250 nm,进样量20 μL,流速1 mL/min,流动相为0.05 mol/L磷酸盐缓冲液(pH 6.7,A)-乙腈(B)。洗脱梯度为:0~40 min 16% B等度洗脱;40~41 min 16% B降至14% B;41~54 min 14% B等度洗脱;54~55 min 14% B升至16% B;55~70 min 16% B(均为体积分数)等度洗脱。
AVRP-1的衍生化:称取AVRP-1样品5.0 mg于耐压管中,加入3 mol/L TFA溶液2.0 mL,120 ℃水解6 h,冷却后加入甲醇减压浓缩至干,重复3次除去多余的TFA,加入0.8 mL去离子水溶解。取0.1 mL完全水解的AVRP-1于反应管中,加入0.5 mol/L PMP甲醇溶液和0.3 mol/L NaOH溶液各0.1 mL,混匀后70 ℃水浴反应30 min,冷却后加入0.105 mL 0.3 mol/L HCl溶液中和,加入0.2 mL去离子水稀释,然后加入0.6 mL氯仿溶液,振摇,离心,弃氯仿层,重复3次除去过量的PMP,水层过0.45 μm滤膜后于HPLC检测。
1.8 FT-IR分析
取AVRP-1干燥粉末,使用傅里叶红外光谱仪在4 000~450 cm-1处进行测定。
1.9 AVRP-1抗氧化活性测定
1.9.1 DPPH自由基清除能力测定
参照文献方法[14],测定AVRP-1的DPPH自由基清除活性。吸取50 μL 0.1 mmol/L DPPH乙醇溶液于96孔板中,加入50 μL不同质量浓度(1.0~5.0 mg/mL)的AVRP-1溶液,该组设置为样品测定组;以无水乙醇代替DPPH乙醇溶液作样品对照组;以去离子水代替AVRP-1溶液作空白对照组;以维生素C代替AVRP-1溶液作阳性对照组。以上各组混合均匀后,避光反应30 min,于517 nm处测定吸光值。清除率计算如公式(1)所示:
(1)
式中:A0为空白对照组吸光度值;A1为样品测定组吸光度值;A2为样品对照组吸光度值。
1.9.2 羟自由基清除能力测定
参照文献方法[14],测定AVRP-1的羟自由基清除活性。于96孔板的检测孔中依次加入8 μL 18 mmol/L FeSO4溶液,8 μL 18 mmol/L水杨酸溶液,52 μL不同质量浓度(1.0~5.0 mg/mL)的AVRP-1溶液,该组设置为样品测定组;检测孔中加入8 μL 18 mmol/L水杨酸溶液,60 μL去离子水,该组设置为空白组;检测孔中加入8 μL 18 mmol/L FeSO4溶液,8 μL 18 mmol/L水杨酸溶液,52 μL去离子水,该组设置为对照组;检测孔中加入8 μL去离子水,8 μL 18 mmol/L水杨酸溶液,52 μL AVRP-1溶液,该组设置为样品对照组;以维生素C代替AVRP-1溶液作为阳性对照组。以上组别均加入32 μL 0.1%(体积分数)H2O2启动反应,静置30 min,于510 nm处测定吸光值。清除率计算如公式(2)所示:
(2)
式中:A0为空白组吸光度值;A1为对照组吸光度值;A2为样品对照组吸光度值;A3为样品测定组吸光度值。
1.10 数据分析
采用GraphPad Prism®version 7.0进行数据统计处理,所有结果均表示为3次重复的平均值±标准差(SD)。
2 结果与分析
2.1 AVRP的分离纯化
DEAE-52纤维素柱为阴离子交换柱,使用不同浓度的NaCl溶液作为洗脱液可根据所带电荷量强弱程度将样品分成不同的组分。DEAE-52柱层析洗脱图如图1所示。经过0、0.1、0.3、0.5、1.0 mol/L NaCl溶液洗脱,得到2个多糖组分,0和0.1 mol/L NaCl洗脱组分分别命名为AVRPD-0和AVRPD-1,收率分别为5.3%和13.8%。

图1 AVRP的DEAE-52洗脱曲线Fig.1 Elution curve of AVRP on DEAE-52 cellulose column
凝胶色谱柱是利用分子筛的原理,根据分子质量大小对样品进行分离,分子质量大的样品先流出色谱柱,分子质量小的后流出。选择含量更高的AVRPD-1进一步分离纯化。如图2所示,AVRPD-1经Sephadex G-100纯化后,得到单峰,命名为AVRP-1,冻干后得白色粉末,收率为54.7%。

图2 AVRP-1的Sephadex G-100洗脱曲线Fig.2 Elution curve of AVRP-1 on Sephadex G-100 column
2.2 AVRP-1的组分测定
如表1所示,AVRP-1的总糖含量为90.34%,蛋白质含量为0.64%,糖醛酸含量为43.59%,说明经过Sevage试剂除蛋白和DEAE-52、Sephadex G-100柱层析进行分离纯化后,多糖较纯。AVRP-1中糖醛酸含量较高,说明AVRP-1是酸性多糖。

表1 AVRP-1的化学组成Table 1 Chemical composition of AVRP-1 n=3)
2.3 AVRP-1纯度鉴定及相对分子质量测定
多糖的理化特性和生物活性常与分子质量联系起来,如有文献报道表明,多糖分子质量越大,其免疫调节活性或抗肿瘤活性越强[15],但也有些研究者得出相反的结论[16]。这一现象说明影响多糖药效的因素是多方面的,如单糖组成、糖苷键类型、三螺旋结构等,分子质量是其中的主要因素之一。影响多糖分子质量的因素包括产地、采收时间、提取方法和干燥方法等[17-19]。传统的热水提取法会导致多糖分子在高温和长时间提取环境下聚合,得到分子质量较大的多糖,超声辅助提取、酶辅助提取等提取方法会降解多糖,得到分子质量较小的多糖[18]。
如图3所示,AVRP-1只有单一的洗脱峰,且峰型对称,可以证明AVRP-1为纯化多糖。以葡聚糖对照品求得Mw标准曲线,线性回归方程为y=0.749 4x+10.332,R2=0.997 1,式中y为葡聚糖Mw的对数,x为保留时间。经计算,AVRP-1的Mw为3 372.01 kDa,分子质量较大。

图3 AVRP-1的HPGPC色谱图Fig.3 HPGPC chromatogram of AVRP-1
2.4 AVRP-1的单糖组成分析
单糖组成在多糖的生物活性和多糖鉴别等方面起着重要的作用。混合单糖标准品和AVRP-1的HPLC谱图分别见图4-A和图4-B。通过比对标准单糖的出峰时间可以确定单糖种类,根据各峰面积比确定单糖的摩尔比。AVRP-1由甘露糖、鼠李糖、葡萄糖醛酸、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖这7种单糖组成,摩尔比为4.14∶4.98∶ 5.10∶ 23.77∶ 17.30∶ 28.51∶16.19。

1-Man;2-Rha;3-GlcA;4-GalA;5-Glc;6-Gal;7-Xyl;8-Ara;9-FucA-混合标准单糖;B-AVRP-1图4 混合标准单糖和AVRP-1的HPLC图Fig.4 The HPLC spectra of mixed standard monosaccharide and AVRP-1
2.5 FT-IR分析


图5 AVRP-1的红外光谱图Fig.5 The FT-IR spectrum of AVRP-1
2.6 抗氧化能力测定
AVRP-1和维生素C对DPPH自由基的清除活性如图6-A所示,当多糖质量浓度从1.0增加到5.0 mg/mL时,清除能力逐渐增强,但随着多糖质量浓度增加,增长趋势逐渐减小。AVRP-1对DPPH自由基的半数有效浓度(half-maximal effective concentration,EC50)为4.50 mg/mL。
AVRP-1和维生素C对羟自由基的清除活性如图6-B所示,当多糖质量浓度从1.0增加到5.0 mg/mL时,清除能力逐渐增强,但随着多糖质量浓度增加,增长趋势逐渐减小,之后趋于平稳。AVRP-1对羟自由基的EC50为2.47 mg/mL。AVRP-1对羟自由基的清除能力强于对DPPH自由基的清除能力。
从抗氧化能力测定结果来看,AVRP-1的抗氧化能力一般,远小于维生素C,对羟自由基的清除活性大于对DPPH自由基的清除活性。抗氧化活性强弱通常是多种因素综合作用的结果,影响多糖抗氧化活性的因素包括:糖醛酸含量、硫酸根含量、分子质量大小、单糖组成和构象等。有大量文献[25]报道表明,多糖的抗氧化作用与其供氢能力有关,糖醛酸基团的存在会激发多糖中端基碳的氢原子,糖醛酸含量越高,抗氧化能力越强。AVRP-1中糖醛酸含量较高,推测AVRP-1的抗氧化活性主要来源于糖醛酸。多糖的分子质量越小,抗氧化活性越强,可能是由于大分子质量多糖穿过细胞膜的渗透能力弱,且有研究显示在相同重量基础上小分子质量多糖有更多还原羟基末端与自由基反应,因此抗氧化活性提高[26]。比如当多糖采用不同提取方法提取后,微波辅助提取法和超声辅助提取法会导致多糖降解,分子质量减小,抗氧化活性明显升高[27]。AVRP-1的分子质量较大,推测这是限制AVRP-1发挥抗氧化活性的主要因素之一。此外,多糖抗氧化活性还受到单糖组成影响。ZHANG等[26]基于Pearson相关分析发现,DPPH自由基清除活性与Ara和Gal含量相关(P<0.05),亚铁离子还原能力与Gal含量相关(P<0.05);基于多元线性回归分析发现,多糖的金属螯合能力随着Xyl和Gal的含量升高而升高。
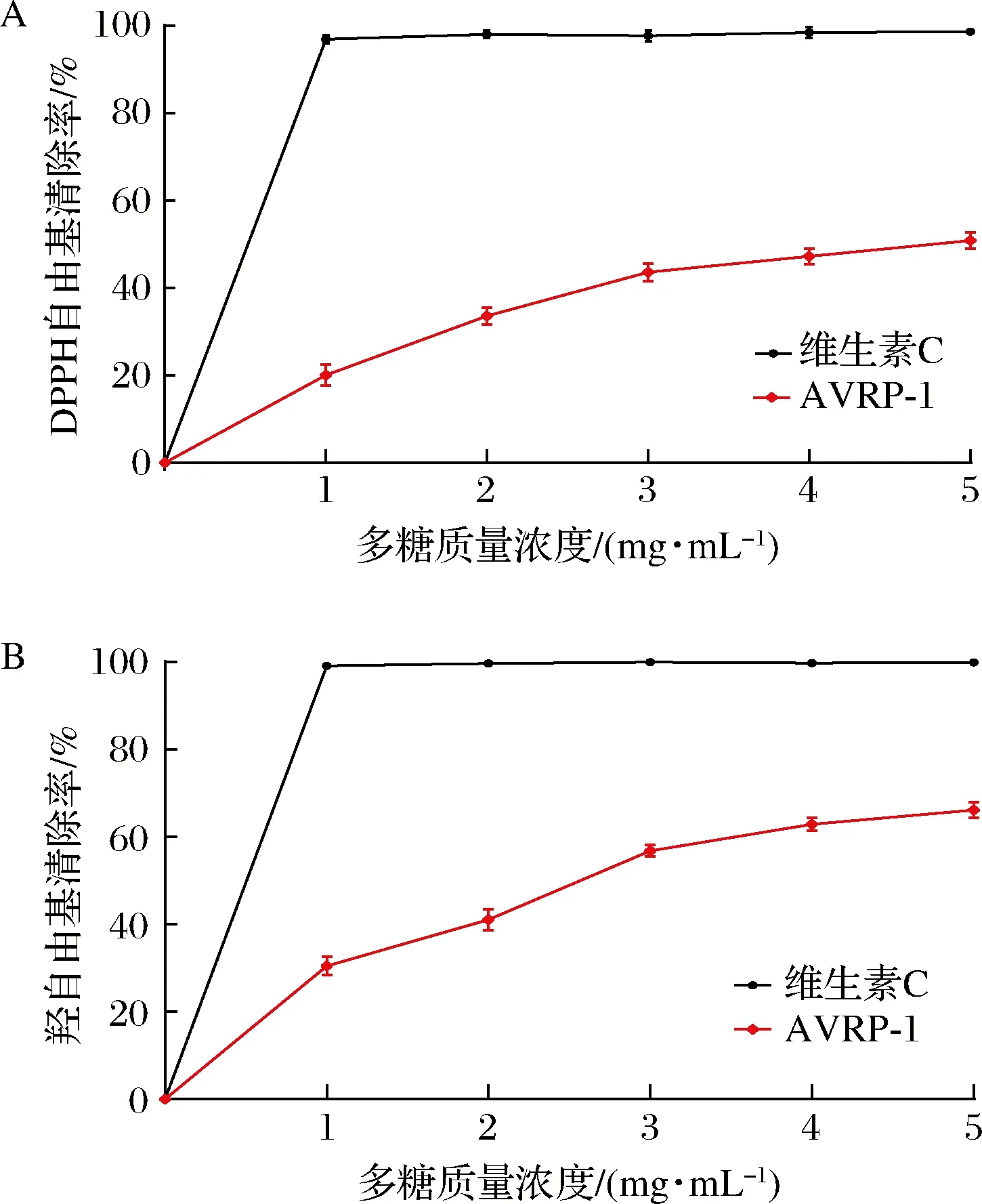
A-DPPH自由基;B-羟自由基图6 AVRP-1抗氧化活性Fig.6 Antioxidant activity of AVRP-1
3 结论
本研究成功从阳春砂根茎中分离纯化了一种主要的多糖组分AVRP-1,并对其结构和抗氧化活性进行了初步研究。结果表明,AVRP-1的总糖含量为90.34%,蛋白质含量为0.64%,糖醛酸含量为43.59%;HPGPC结果显示AVRP-1是纯化多糖,分子质量为3 372.01 kDa;由Man、Rha、GlcA、GalA、Glc、Gal和Ara这7种单糖组成,摩尔比为4.14∶4.98∶5.10∶23.77∶17.30∶28.51∶16.19。AVRP-1具有抗氧化活性,对DPPH自由基和羟自由基的EC50分别为4.50和2.47 mg/mL。本研究可为AVRP的结构及其活性研究提供技术支持,为进一步开发利用阳春砂提供理论依据。
