兔体外循环模型心肌代谢组学研究
2021-08-31邹丽华刘晋萍
邹丽华,刘晋萍
体外循环(extacorporeal circulation, ECC)期间主动脉阻断与开放难以避免心肌缺血再灌注损伤(ischemia reperfusion injury, IRI)),可能促进线粒体通透性转换孔开放、免疫系统激活、活性氧簇释放、心肌细胞水肿等[1],因此 ECC 期间心肌保护策略需关注ECC 前的心肌代谢准备,改善ECC 诱发的炎症反应,调节心肌氧耗并进行心肌的“训练”[1]。 其中,代谢状态作为心肌能量供应及功能状况的反映,可能在ECC 期间发生复杂变化,目前临床常用的心肌保护液-HTK 液,具有酸缓冲能力、含有酮戊二酸可补充能量代谢底物、色氨酸可稳定细胞膜等优良特性。 前期研究发现HTK 液可降低主动脉开放后心肌氧耗[2],但未全面分析心肌代谢变化。 代谢组学利用分析检测技术,如气相色谱-质谱联用(gas chromatography-mass spectrometer,GC-MS)、液相色谱-质谱联用,可对小分子代谢产物进行全面分析,有助于疾病诊断和发病机制研究[3]。 本研究旨在利用兔 ECC 模型,采用主动脉阻断与开放、HTK 液心肌灌注,模拟临床实际,对ECC期间心肌进行代谢组学分析。
1 资料与方法
1.1 实验动物 实验经动物伦理委员会批准(2012-4-10-GZR),选择 15 ~20 周龄的新西兰白兔,体重 2~3.5 kg,随机分为对照组(C 组,n = 6)、缺血组(I 组,n =6)、缺血再灌注组(IR 组,n = 6)。 12 只新西兰白兔作为I 组、IR 组献血兔用于ECC 管道预充和术中输血,具体方法同前期研究[4]。 实验动物术前禁食6 h,禁饮2 h。
1.2 耗材与试剂 ECC 模型采用16 F 静脉插管、婴儿型膜肺(Terumo Capiox FX05)、双头滚压泵,心肌灌注管采用20 G 中心静脉插管。 代谢组学分析采用气相色谱仪(Agilent 7890A,美国)、质谱仪(Ag⁃ilent 5975C,美国)、30 m×250 μm×0.25 μm 毛细管柱(Agilent DB-5MS,美国)。 代谢组学内标采用 L-2-氯苯丙氨酸,衍生化试剂采用N,O-双(三甲基硅烷基)三氟乙酰胺。
1.3 ECC 模型建立 入室开通耳缘静脉,麻醉诱导依次采用芬太尼(3 μg/kg)、戊巴比妥钠(30 mg/kg)、维库溴铵(0.1 mg/kg),经口气管插管机械通气。 麻醉维持采用戊巴比妥钠、芬太尼、维库溴铵。右腋动脉置入16 G 套管针,正中开胸,充分暴露心脏和升主动脉,右心耳置入16 F 静脉插管。 左腋动脉置入20 G 中心静脉导管入主动脉根部作为心肌灌注。 ECC 管道预充排气后开放静脉引流管、腋动脉插管,开始ECC 转流,肛温降至30℃阻断主动脉,灌注 HTK 液 40 ml/kg。 ECC 期间维持肛温 28℃ 左右,平均动脉压为40 ~60 mmHg。 主动脉开放前肛温复温至30℃,主动脉阻断120 min 后松开阻断带,恢复心肌灌注、心脏复跳,继续复温至35℃,血流动力学平稳后停机。 I 组主动脉阻断120 min 后取心肌组织,IR 组主动脉阻断120 min 开放,心肌恢复灌注120 min 后取心肌组织。 C 组正中开胸、ECC 插管后取左室心肌组织,心肌标本-80℃冰箱保存,用于代谢组学检测。
1.4 代谢组学GC-MS 检测 取100 mg 心肌组织,加入 L-2-氯苯丙氨酸(50 μl)、体积比 3 ∶1 的甲醇氯仿混合液(0.5 ml),55 Hz 研磨 7 min 后离心 15 min(4℃,12 000 rpm),取上清行真空浓缩器干燥处理,与80 μl 甲氧胺盐试剂混匀,37℃孵育 2 h 后加入 100 μl BSTFA,70℃孵育 1 h,冷却后上机检测。采用 GC-MS 分析,进样量为1 μl,气载为氦气,气体入口流速设为3 ml/min,毛细管柱气体流速1 ml/min。 初始温度 80℃ 1 min,以 10℃ /min 提升至290℃,并维持 290℃15 min。 选择单纯内标(L-2-氯苯丙氨酸)、单个样本进行预实验,内标保留时间标准差为0.00531,表明系统稳定性良好。
1.5 代谢组学多元数据分析 质谱峰预处理去除噪音数据,采用最小值二分之一法缺失值模拟,内标归一法数据标准化处理。 采用主成分分析法(prin⁃cipal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal projections to latent structuresdiscriminant analysis,OPLS-DA)对数据进行多元分析,应用得分图评估样本分类。 PCA 采用对数转换及CTR 格式化处理的数据标度换算方式,对数据进行建模分析。 OPLS-DA 滤除代谢物中不相关的正交变量,对非正交变量和正交变量分别分析,最大化凸显模型内部与预测主成分间的差异。 OPLS-DA采用对数转换及UV 格式化处理的数据标度换算方式,对第一、二主成分进行建模分析。 采用7 折交叉验证检验模型质量,R2Y(Y 变量的可解释性)及Q2(模型的可预测性)评估模型有效性,排列实验随机200 次改变Y 的排列顺序获得Q2值进一步检验模型有效性。
1.6 差异物代谢通路及统计学分析 所有数据使用 SIMCA-P 13.0 进行分析,计算 OPLS-DA 第一主成分的变量重要性投影值(variable importance in the projection,VIP)的阈值,采用 LECO/Fiehn 代谢组学对代谢物质进行鉴定[5]。 所有数据采用 SPSS 16.0进行统计分析,计量资料采用均数±标准差()表示,组间比较采用t检验。 VIP 值>1 及t检验P<0.05 鉴定差异代谢物。 差异代谢物以 Pearson 相关系数进行聚集获得热图,采用MeV 软件作载荷图。将差异物在京都基因与基因组百科全书数据库(kyoto encyclopedia of genes and genomics database,KEGG)中进行映射,确定代谢通路。
2 结 果
2.1 代谢组学多元分析
2.1.1 预处理结果 三组心肌组织GC-MS 检测获得608 个质谱峰,对数据进行过滤,去除噪音数据,保留583 个峰值(图1)。
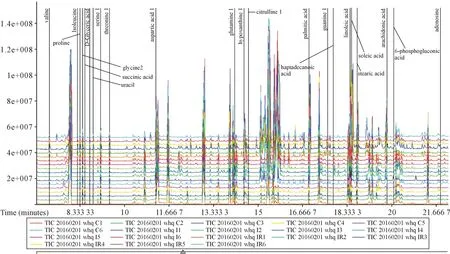
图1 GC-MS 总离子流图
2.1.2 PCA 分析结果 所有样本处于 95%置信区间内,I 组与C 组PCA 得分图部分重叠区分不显著,R2X=0.384,Q2=-0.102。 IR 组与 I 组分布于 T1 两侧,互不重叠具有聚类趋势,表明再灌注期间的心肌代谢物质可能发生显著改变,PCA 模型R2X =0.535,系统稳定性和实验可控性良好,数据可进一步分析(图 2~3)。
2.1.3 OPLS-DA 分析结果 所有样本处于 95%置信区间内,OPLS-DA 得分图示I 组与C 组无重叠,R2X=0.313,R2Y=0.987,Q2= 0.357。 I 组与 IR 组显著区分,表明ECC 可引起心肌代谢状态的显著改变(图 2~3),OPLS-DA 模型 R2X=0.403,R2Y =0.991,Q2= 0.714。
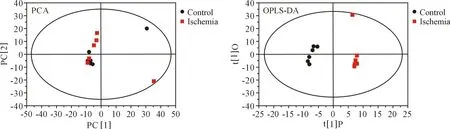
图2 C 组与 I 组 PCA 及 OPLS-DA 得分图
OPLS-DA 模型行 7 折交叉验证,I 组与 C 组比较发现置换检验截距分别为 R2=0.904,Q2=0.0165,IR 组与 I 组比较发现置换检验截距分别为R2=0.914,Q2=-0.0841,OPLS-DA 模型的稳健性良好,不存在过拟合现象,OPLS-DA 模型可解释两组样本之间的差异。 缺血期间及再灌注期间代谢物载荷图见图4,载荷图左右两端物质为潜在的差异代谢物。
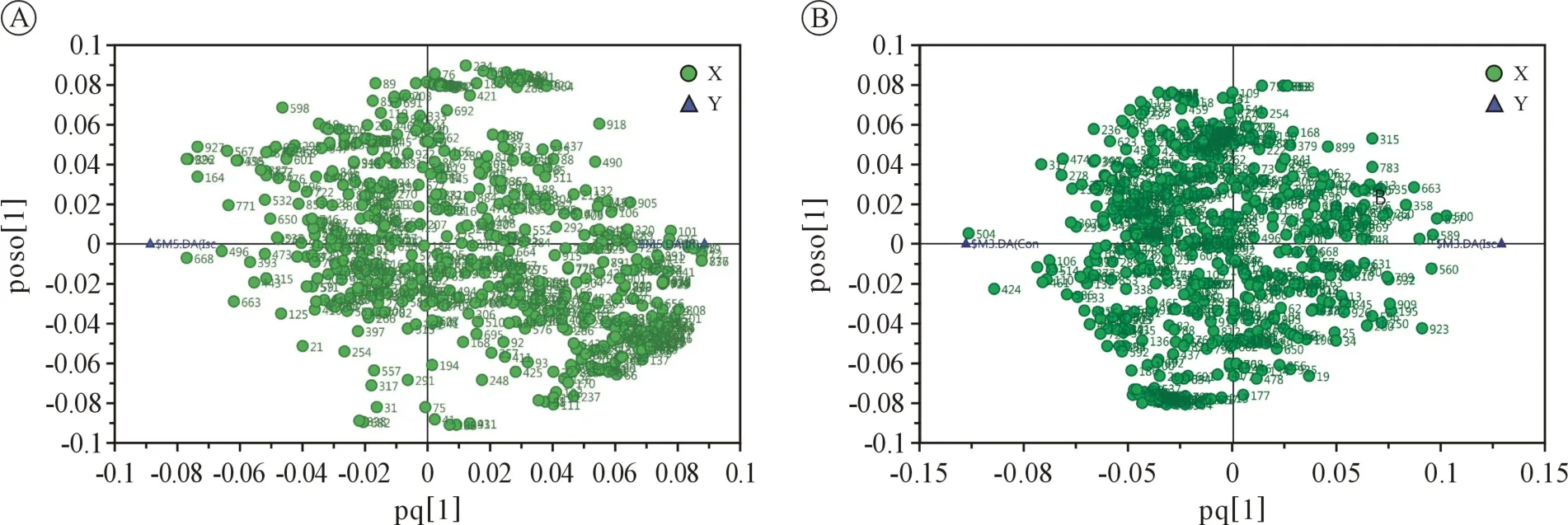
图4 缺血再灌注期间代谢物载荷图
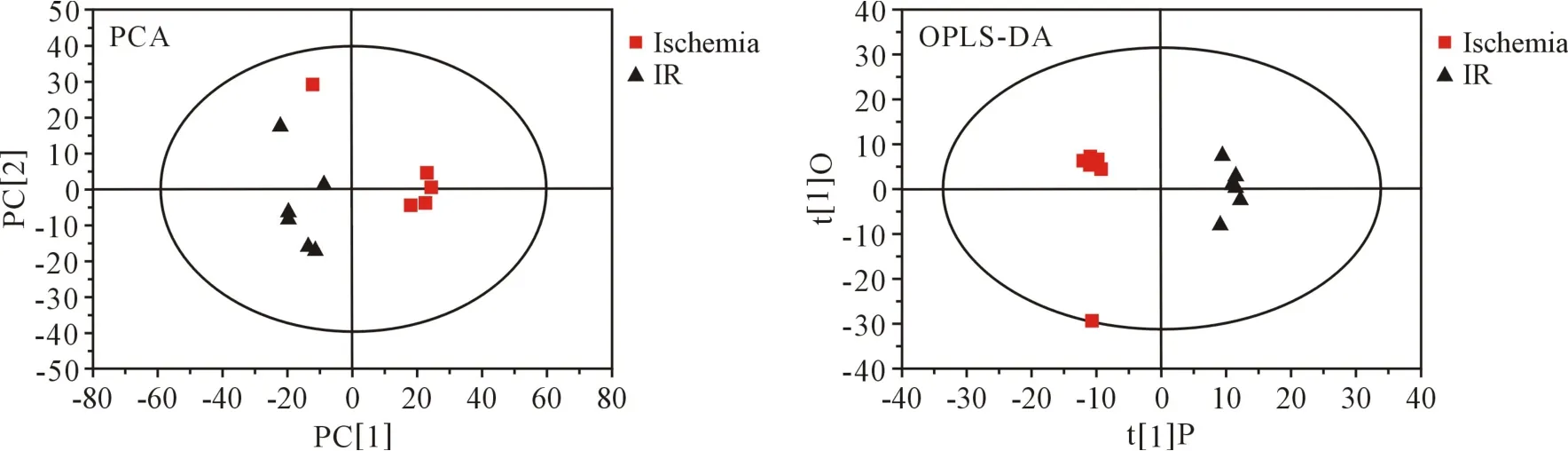
图3 R 组与 I 组 PCA 及 OPLS-DA 得分图
2.2 差异代谢物鉴定及代谢通路确定 差异代谢物热图表明,缺血期间代谢变化不显著,仅发现13个差异物质(图5A),再灌注期间代谢发生明显改变,共筛选出82 个差异代谢物(图5B)。 KEGG 分析发现缺血期间不饱和脂肪酸油酸代谢上调,尿嘧啶代谢下调,包括尿嘧啶核苷、5,6-二氢尿嘧啶生成减少。 尿素循环相关产物瓜氨酸、肌酐生成减少,差异代谢物主要参与嘧啶代谢、尿素循环以及不饱和脂肪酸代谢。 再灌注期间主要涉及氨基酸代谢、不饱和脂肪酸代谢、核苷酸代谢。 再灌注期间上调的差异氨基酸主要为缬氨酸、异亮氨酸、天冬氨酸、瓜氨酸、肌氨酸、苏氨酸、脯氨酸、甘氨酸、丝氨酸。参与氧化应激的氨基酸上调,包括丝氨酸、甘氨酸、脯氨酸、苏氨酸,鸟氨酸循环激活,谷氨酰胺在再灌注期间生成减少。 再灌注期间脂肪酸代谢中十五酸、棕榈酸(十六酸)、十七酸、硬脂酸(十八烷酸)、茉莉酸甲酯、甘油酸、双甘油、花生四烯酸、油酸、亚油酸生成增加,其中不饱和脂肪酸花生四烯酸、油酸、亚油酸、茉莉酸甲酯代谢上调。 再灌注期间核苷酸代谢中尿嘧啶、胞嘧啶核苷、鸟嘌呤、次黄嘌呤、尿酸、黄嘌呤核苷生成增加,羧酸尿嘧啶、胞苷酸、尿苷酸生成减少。 核苷酸代谢产物增加,与黄嘌呤氧化酶系统相关的产物次黄嘌呤、黄嘌呤核苷均增加,而参与了ADP 合成的底物腺苷及三羧酸循环琥珀酸生成减少(图6)。
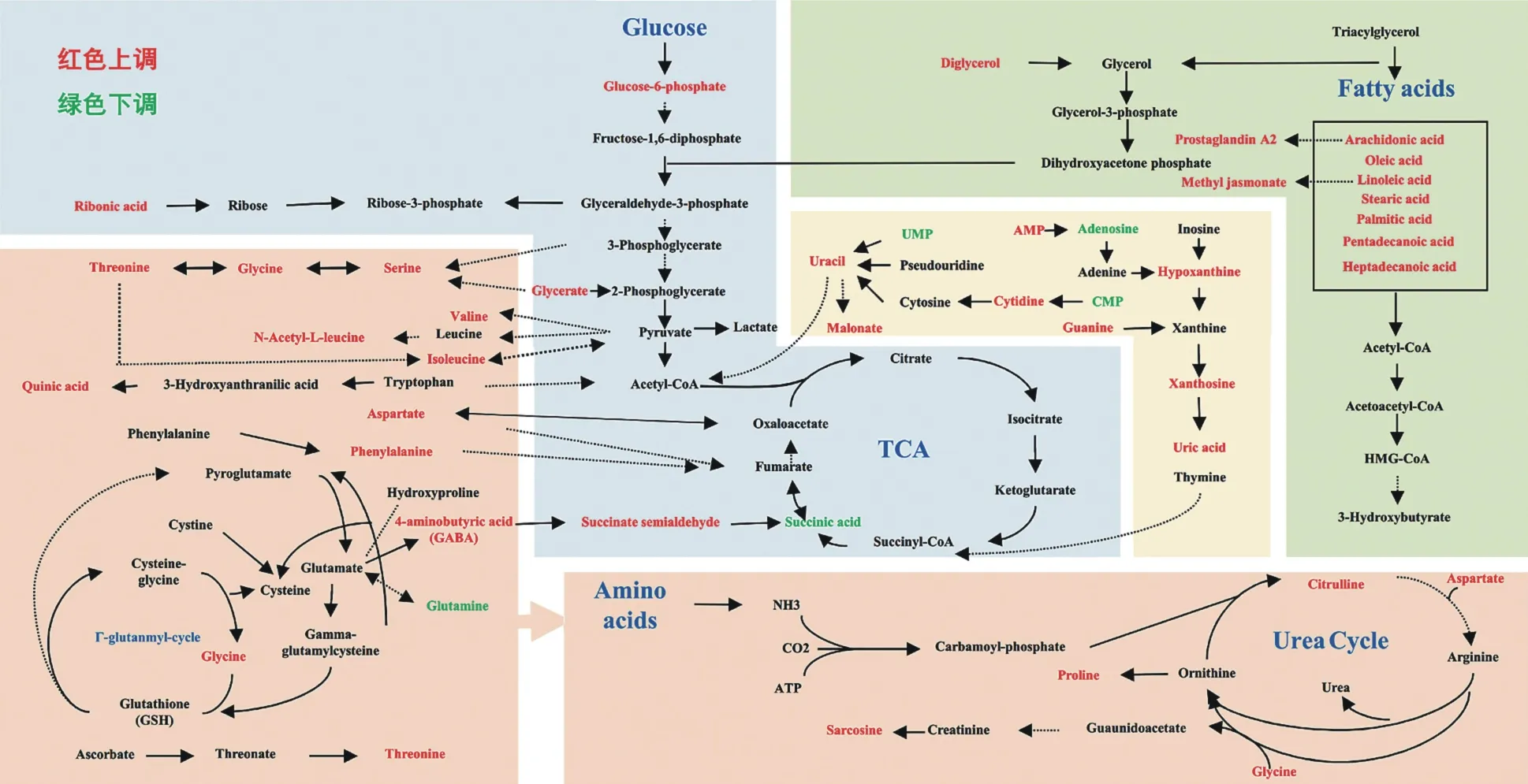
图6 再灌注期间主要差异物代谢通路
3 讨 论
ECC 期间受人工管道、低温等因素的影响,缺血再灌注期间心肌代谢可能发生显著改变。 HTK液诱导新陈代谢暂停、维持有利的代谢环境,防止细胞代谢物的丢失、维持合理的酸碱平衡,防止细胞毒性损伤[6],但围术期心功能紊乱仍常见于临床,而从心肌代谢角度阐释可能的机制仍需进一步探索。研究证实ECC 期间心肌腺苷酸发生显著改变,ECC可能诱发了能量受损及恢复延迟,有学者采用丙酮酸改善心肌能量代谢[7]。 Mantovani 应用微透析技术发现,ECC 缺血期间能量代谢(葡萄糖、丙酮酸)下调,再灌注期间逐渐恢复。 目前代谢检测方法由血浆代谢物检测发展为微透析检测,近年来代谢组学的兴起为全面的代谢分析提供了新思路[6,8],因此本研究采用GC-MS 全面反映ECC 心肌代谢变化特点。 本研究 OPLS-DA 分析发现经 HTK 液灌注后缺血期间心肌代谢改变不显著,再灌注期间代谢发生显著差异,KEGG 代谢通路分析发现,ECC 再灌注早期氨基酸代谢、核甘酸代谢及不饱和脂胞酸代谢明显上调,但同时参与了氧化应激的氨基酸、不饱和脂肪酸、黄嘌呤系统均上调,与腺苷相关代谢产物及琥珀酸等能量代谢物明显下调。
与缺血期相比,心肌再灌注后氨基酸代谢产物明显增加,可能与ECC 期间能量代谢物相对缺乏、促进白质分解有关。 既往研究发现在缺血等病理状态下,心肌代谢重构,氨基酸可作为能量底物的直接来源,参与葡萄糖代谢酶的活性,同时氨基酸摄取增加以抵消氧利用率降低对细胞的有害影响[9],本实验中采用HTK 液及低温进行心肌保护,未检测到缺血期间氨基酸代谢显著下调,表明缺血期间HTK液、低温等因素可能具有较好心肌保护效果。 此外,氨基酸可改善氧化应激,抵消氧自由基的作用,氧自由基是谷胱甘肽合成的前体,或一氧化氮生物合成的底物[9],其中丝氨酸、甘氨酸、脯氨酸、苏氨酸被证实参与氧化应激,再灌注期间显著增加,参与抗氧化应激的谷氨酰胺明显下降,与既往研究一致,因此改善ECC 再灌注期间心肌保护可能仍需进一步降低氧化应激损伤。
核苷酸代谢与心肌能量代谢、氧自由基的产生密切相关,其中黄嘌呤氧化酶系统是参与心肌IRI机制中的氧自由基主要来源[10]。 缺血期间ATP 分解,产生大量次黄嘌呤和黄嘌呤,再灌注血供和氧供的恢复促进黄嘌呤氧化酶生成尿酸,同时释放大量O2
-产生氧化应激损伤[11],本研究中再灌注期间次黄嘌呤、尿酸、黄嘌呤核苷显著上调,推测氧自由基可能是兔ECC 模型再灌注损伤重要机制。 此外,腺苷代谢物及琥珀酸明显下调,证实ECC 期间心肌可能存在能量转移、利用以及生成障碍。
ECC 期间不饱和脂肪酸代谢上调,其上调可能与ECC 期间交感神经兴奋激活β 受体有关。 本研究发现,油酸在缺血期间增加、再灌注期间进一步增加。 油酸分解耗氧较多,缺血期间心肌氧供骤减使得油酸分解下降,且心肌缺血期间对脂肪酸利用减少进而引起油酸的相对升高。 花生四烯酸为脂质过氧化物的主要来源,前期研究发现,脂质过氧化物终产物不饱和醛参与了ECC 期间的心肌损伤,醛类在心肌缺血期间堆积,再灌注期间水平降低但再灌注早期显著高于术前,因此不饱和脂肪酸的上调可能参与了ECC 期间醛类堆积及心肌损伤的重要机制,与前期研究结果一致[12]。 既往研究结果证实,心肌缺血再灌注期间脂肪酸β 氧化的增强,但脂肪酸β氧化增强与心肌能量代谢改善不呈正相关,可能的机制为脂肪酸β 氧化加速使ATP 产生增多,但同时再灌注期间耗氧增加,因此心肌能量仍处于失衡状态,与本研究结果一致,本研究观察到再灌注期间腺苷相关代谢物及琥珀酸显著下调。
综上所述,本研究全面分析了ECC 期间心肌组织的代谢特点,发现ECC 再灌注期间氨基酸代谢上调、不饱和脂肪酸生成增加、黄嘌呤氧化酶系统活化,本研究从心肌代谢角度探索可能心肌IRI 机制,将有助于减轻缺血再灌注损伤策略改进。
