K2FeO4降解微污染苯酚及中间体效能及动力学分析
2021-08-31畅彤崔建国张峰
畅彤,崔建国*,张峰
(1. 太原理工大学 环境科学与工程学院,山西 晋中 030600;2. 山西省市政工程研究生教育创新中心,山西 晋中 030600)
0 引言
随着经济的快速发展,我国水资源遭受污染的情况时有发生,水质情况不容乐观[1],饮用水水源地突发污染事故的风险不断增加。因此,微污染水源水的处理依然是目前水质安全研究的热点。苯酚是酚类化合物中有毒害难降解的物质,其在水体中的生物毒性极强,会危害人的神经中枢及内脏功能[2]。而苯酚降解的过程中,中间体如二酚类及醌类具有比苯酚更加剧烈的毒性和危害[3-5]。但是目前对水中苯酚降解的研究多数仅着眼于苯酚降解效果,而忽视了对降解过程中会产生比苯酚毒性更大的有机中间体[6]。由于苯酚的结构与化学性质相对稳定,目前采用的生物去除法[7]、光催化法[8]、活性炭吸附[9]、高锰酸钾氧化法[10]等由于氧化性较弱等原因,即使苯酚达标,但有毒有机中间体还是大量存在于处理后的水中。因此,寻找一种高效安全的苯酚降解药剂与降解工艺刻不容缓。
高铁酸钾(K2FeO4)作为可工业化利用的绿色高效水处理剂,具有方便简单、效果优良、适用性广等 特 点[11-14]。在 适 当 的 条 件 下,K2FeO4具 有 高 达2.20 V 氧化还原电位[15],极强的氧化性对于苯酚的处理比起传统工艺应当有更优的效果[16],基于此,本文针对0.002~0.1 mg/L(GB3838-2002 的II 类至V 类水质)低浓度苯酚的处理,考查采用K2FeO4处理时,是否能表现出良好的降解性,并且降解苯酚达标后水中存在有毒有机中间体是否较少,并初步探求其作用机理。
1 材料与方法
1.1 试剂与仪器
主要试剂:无水苯酚、K2FeO4(质量分数92%)、乙酸乙酯、无水硫酸钠、硫酸铵、氨水(体积分数25%)、硫酸等药品均为分析纯,甲醇为色谱纯,由Millipore Milli-Q 超纯水系统配制所需溶液。
主要仪器:THZ-82B 数显恒温振荡器;DHG-9070B电热恒温鼓风干燥箱;LC-100 液相色谱仪;C18色谱柱(5 μm×4.6 mm×150 mm);FE28 pH 计;LD-4 台式离心机;50 mL离心管;DCY-SY12 型水浴氮吹仪;1 mL 微量注射器;JY 0002 电子天平等。
1.2 处理水质
用超纯水配制pH 值为7~9,模拟《地表水环境质量标准》(GB3838-2002)[17]Ⅴ类水的标准,即苯酚浓度为0.1 mg/L 的原水。
1.3 实验方法
1.3.1 液相色谱条件
流动相选择甲醇:水=40:60,检测波长确定为260 mm,流动相流速0.8 mL/min,柱温选取30 ℃,进样量20.0 μL。
1.3.2 反应处理流程
取0.1 mg/L 的苯酚溶液100 mL 置于150 mL 锥形瓶中,经氨水和硫酸调节pH后加入适量的200 mg/L K2FeO4溶液。将锥形瓶置于磁力搅拌器上,调节磁力搅拌转速120 r/min,控制反应温度,反应时间视实验需求所定。在苯酚和K2FeO4反应后的液体中加入过量亚硫酸钠溶液终止氧化,试液再静置20 min 之后用快速滤纸过滤,再将滤后试液经乙酸乙酯-硫酸铵盐析萃取,氮气浓缩至1 mL后通过有机滤头进行测样作为苯酚降解和中间体生成规律的计算依据。
1.3.3 实验安排
单因素实验考查了不同K2FeO4与苯酚质量比、温度、原水pH 值、反应时间对苯酚降解过程中对苯二酚、对苯醌两种有毒中间体浓度变化。实验中每个条件进行3 次重复,每次实验同条件检测3 次。经检测,3 组实验数据RSD 均小于15%,实验重复性良好。
1.4 分析方法
采用液相色谱外标法测定溶液中苯酚、对苯二酚、对苯醌的含量。先使用色谱级甲醇配制100 mg/L 的苯酚、对苯二酚、对苯醌混合标准储备液,通过逐级稀释得到3 种物质在该液相色谱条件下的标线。之后利用峰面积法经计算得到最终滤液中3种物质具体含量。
2 结果与讨论
2.1 K2FeO4投加量对苯酚及中间体的去除效果
反应液中在苯酚初始浓度为0.1 mg/L,pH 值7.0,反应时间为30 min(不包含静置时间),反应温度控制在25 ℃的情况下,得到K2FeO4投加量与苯酚去除率的关系(图1(a)),与中间体浓度的关系(图1(b))。
从图1(a)可知,苯酚浓度在质量比为5~10 时下降程度明显,质量比到10 时其质量去除率可达到90% 以上;质量比在10 以上后,降解速率放缓,并在其达到20 时基本平稳,苯酚去除率达到96.96%以上(图中未显示质量比30 时的数据,因为对苯二酚和对苯醌的量低于方法检测限)。由图1(b)可见,随着质量比不断提高,对苯二酚浓度在质量比为5~10 时迅速下降,之后缓慢降低,而对苯醌的数据表明其浓度在质量比5~10 时存在一个先短暂上升后下降的趋势。结合对苯二酚降解浓度变化情况可认为,在质量比较低的情况下,FeO42-更倾向与酚羟基发生反应。据文献报道[18],高铁酸盐对苯酚的降解过程中,对苯醌先于对苯二酚出现,对苯二酚实际是苯氧基与Fe(Ⅴ)反应产生的对苯醌得到H+形成(图2)。

图1 高铁酸钾与苯酚不同质量比对苯酚及其中间体的影响(a)苯酚去除率;(b)中间体浓度的影响情况Fig.1 Effect of potassium ferrate and phenol on the mass ratio of phenol and its intermediate(a)Removal rate of phenol;(b)Concentration of intermediate
2.2 反应时间对苯酚及中间体去除效果影响
反应液中在苯酚初始浓度为0.1 mg/L,pH 值7.0,K2FeO4与 苯 酚 质 量 比 为20:1,反 应 温 度 在25 ℃时,得到反应时间与苯酚去除率之间的关系(图3(a)),与中间体浓度的关系如(图3(b))。
从图3(a)看,苯酚去除率在15 min 之前变化速度明显,之后趋于平稳,15 min 苯酚去除率可以达到96.57%。 当30 min 反应结束后,去除率达到96.91%,说明实验精度较好,误差波动较小。从图3(b)中可以看出,随着反应时间加长,对苯二酚浓度在15 min 之前迅速下降,之后下降速率放缓;对苯醌浓度在5 min 之前略微上升,随后大幅降低,直到15 min 之后趋于平稳。这主要是K2FeO4降解苯酚效果主要来源于Fe(Ⅵ)对苯酚强烈的氧化作用和FeO42-还原生成的Fe3+水解生成的氢氧化铁胶体起到的絮凝作用[19],反应前期起主要作用的是氧化作用;15 min 之后随着FeO42-浓度迅速降低,氧化作用减弱,絮凝作用的影响起主要作用。

图3 不同反应时间对苯酚及其中间体的影响(a)苯酚去除率(b)中间体浓度的影响Fig. 3 Effects of different reaction times on phenol and its intermediates(a)Removal rate of phenol;(b)Concentration of intermediate
2.3 溶液初始pH对苯酚及中间体去除效果影响
在苯酚初始浓度为0.1 mg/L 时,反应时间为30 min,K2FeO4与苯酚质量比为20:1,反应温度控制在25 ℃的情况下,得到反应初始溶液pH 与苯酚去除率之间的关系如图4(a)。中间体浓度的关系如图4(b)。
从图4(a)可以看出,苯酚去除率在pH 从3~9 时呈抛物线上升,之后有所下降;当pH=9 时,去除率可接近98%。这是因为在酸性条件下,K2FeO4的氧化还原电位很高(E0FeO42-/Fe3+=2.20 V)达[20],可有效地降解苯酚。碱性条件时,FeO42-氧化还原电位降低(E0FeO42-/Fe(OH)3=0.72 V),但稳定性大大增强,在足够的氧化反应时间条件支持下能更好地分解污染物[21]。FeO42-被还原为Fe3+在碱性条件下生成Fe(OH)3胶体,对剩余苯酚具有吸附作用。这部分被吸附的苯酚及中间体在絮凝阶段完成后会随着氢氧化铁胶体沉降从而在过滤步骤被去除。因此虽然高pH值时苯酚的降解程度稍稍下降,但仍保持较高的去除率。Graham等研究认为最佳降解pH可能在8~10 之间[22],实验结果也证明了这一点。
从图4(b)可以看出,随着溶液pH 逐渐增大,对苯二酚浓度在pH 为3~9 时呈下降趋势且降低速度很快,对苯醌浓度在酸性条件下降速度很快。这是因为pH 较低时FeO42-的高氧化性使苯酚降解所生成的中间体进一步氧化分解;而当pH 为9 左右时,FeO42-还原生成的Fe(OH)3胶体对这些中间体也进行了吸附。但是当pH 大于9 时,两种中间体浓度下降速度放缓。这主要是当pH 大于9 时FeO42-的氧化性大大降低,单靠生成的Fe(OH)3胶体吸附降解中间体的能力较为有限。至于两种中间体浓度在不同pH 条件下有明显差异的原因,可能是pH 小于5 时对苯醌更易还原产出对苯二酚[23],而当pH 大于5,或者更偏碱性条件下,苯酚降解产物顺序更容易生成对苯醌。

图4 不同溶液初始pH 对苯酚及中间体的影响(a)苯酚去除率;(b)中间体浓度的影响Fig. 4 Effect of initial pH of different solution on phenol and its intermediate(a)Removal rate of phenol;(b)Concentration of intermediate
在降解过程中,FeO42-被还原主要生成Fe3+和Fe2+仅在苯醌开环形成顺丁烯二酸时生成。实际上大多数Fe2+是Fe3+被氧化阶段结束后添加的亚硫酸钠还原生成。Fe2+和Fe3+的浓度在初始pH 值较小时均处于下降趋势,Fe2+浓度下降速度高于Fe3+浓度下降速度。总铁浓度在溶液初始pH 值3~9 时一直下降,之后趋于稳定,在pH 值为9 时达到最低点。对溶液初始pH 为9 条件下最终滤液中铁离子的含量做研究,结果表明,此时絮凝沉淀效果较强。因此多数Fe3+以沉淀的形式去除,最终溶液中剩余总铁含量为0.82 mg/L,略高于国家标准线即0.3 mg/L。故实际生产中需要考虑在其处理后对水中多余的Fe2+、Fe3+进行消除。
2.4 反应环境温度对苯酚及中间体去除效果影响
反应液中在苯酚含量为0.1 mg/L,反应时间为30 min,K2FeO4与苯酚质量比为20:1,反应pH 为9的情况下,得到反应温度与苯酚去除率的关系如图5(a)。与中间体浓度的关系如图5(b)。
从图5(a)和(b)可看出,反应温度对K2FeO4的降解作用似乎并无太大影响,苯酚去除率基本稳定在98%左右。中间体浓度也变化不明显,这可能是误差所致。故反应温度对K2FeO4降解苯酚的行为并非主要影响因素,这对于工程上以K2FeO4作为新的苯酚污染药剂非常有利。意味着如果采用K2FeO4作为处理药剂可以忽略环境温度对其影响,利于推广应用并可有效节约生产成本。

图5 不同反应温度对苯酚及中间体降解的影响(a)苯酚去除率;(b)中间体浓度的影响Fig. 5 Effect of reaction temperature on degradation of phenol and its intermediate(a)Removal rate of phenol;(b)Concentration of intermediate
2.5 K2FeO4降解苯酚的动力学研究
由2.1 中数据得出3 种物质的剩余浓度C。进行拟合可以发现,K2FeO4与苯酚质量比M和3 种待测物质剩余浓度有较好的代数关系,其中苯酚剩余浓度C1(μg/L)符合对数公式,公式为:

对苯二酚和对苯醌剩余浓度C1和C2与M分别符合多项式:


对式(1)做分析可知,lnC和质量比之间存在线性相关,可以看出K2FeO4相对苯酚浓度越大,苯酚去除率提高效果越显著。
将式(2)、(3)相加得到式(4):
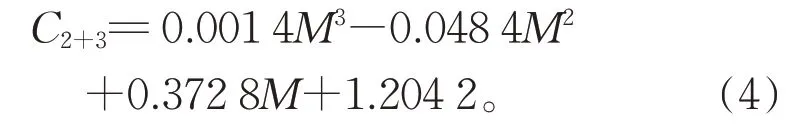
从(4)可知,在M=18.16 时得到极小值,且此时C2+3最小。由此知两式在M=18.16 时,C1和C2之和最小,降解效果最优。因此,质量比在18~19时对两种中间体能起到良好处理效果同时最为节省高铁酸钾用量。将M=18.16 分别代入式(1)、(2)、(3),结果相加可知当前反应条件下三种剩余物质之和C1+2+3=2.65,此时处理效果基本满足国家标准地表II 类水(不大于0.002 mg/L)要求,但与2.3 中条件最优时相比还存在差距。
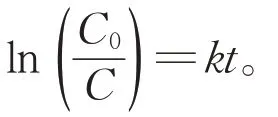

图6 反应时间同苯酚lnC 的关系Fig.6 Relationship between the reaction time and the phenol’s lnC
对对苯二酚浓度C5、对苯醌浓度C6分别和反应时间t做拟合,发现对苯二酚在反应体系中2 min 之后浓度降低过程近似符合一级动力学模型。如图7所示,反应动力学常数为0.094 min-1。

图7 反应时间同对苯二酚lnC 的关系Fig.7 Relationship between the reaction time and the hydroquinone’s lnC
对苯醌浓度与反应时间关系可用二级反应动力学方程描述[24]。满足式(5):

其中,Ca为高铁酸钾初始浓度;Cb为苯酚初始浓度。
在0 min~5 min 时为第一阶段的反应动力学方程,此时生成速率大于降解速率;在5 min~30 min时为第二阶段反应动力学方程,此时降解速率大于生成速率。两阶段动力学方程如表2-1 所示。
分析图6-7 及表1 可知,K2FeO4降解苯酚及其中间体的过程较为复杂,中间体在反应开始时以极大的速率达到最高峰,在降解速率持平后又快速被K2FeO4氧化降解。这个过程中包含苯酚降解为对苯醌,对苯醌得[H]生成对苯二酚,中间体一经生成即被K2FeO4飞速氧化开环等过程。从两种中间体的反应速率常数可以看出,中间体在反应体系中都比苯酚容易氧化降解,这说明K2FeO4作为水处理剂能起到很好的抑制强毒性中间体生成及保留的作用。
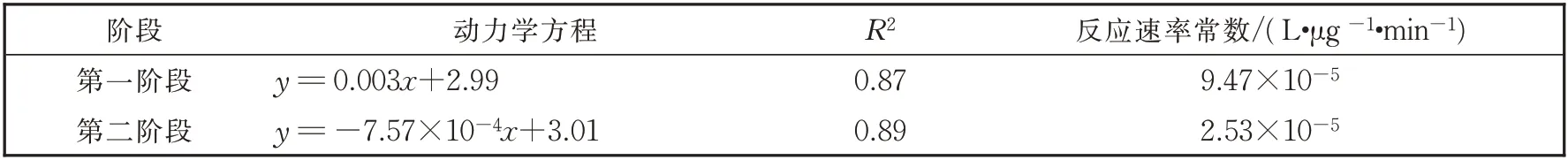
表1 对苯醌两阶段二级反应动力学方程表Table1 Table of kinetics of p-benzoquinone two-stage secondary reaction
3 结论
K2FeO4高效氧化降解苯酚及其有毒中间体的研究主要结论如下:
氧化降解Ⅴ类水浓度苯酚的最优工作条件是:K2FeO4与苯酚质量比为20:1、反应时间30 min、反应pH 为9、环境温度25 ℃。此时苯酚去除率可以达到98.20%,同时苯酚、对苯二酚、对苯醌等有毒物质总浓度基本满足国家地表水Ⅱ类水对于挥发酚的标准,即不超过0.002 mg/L,这说明K2FeO4是一种高效安全的微污染苯酚原水处理工艺。
K2FeO4去除苯酚及其有毒中间体的过程是高铁酸钾的强氧化性和还原产物Fe(OH)3的絮凝吸附性协同作用的结果。除K2FeO4的投加量外,反应初始pH 值是主要影响因素,而温度的敏感性较差。酸性条件有利于苯酚的降解,而碱性条件更有利于有毒中间体的降解。中间体在降解条件不利时总量大于国家标准线,危害饮用水安全。K2FeO4高效安全降解水中苯酚(0.1 mg/L)的最优条件是:K2FeO4与苯酚质量比为20:1、反应时间30 min、反应pH 为9。
K2FeO4氧化去除苯酚的过程符合一级反应动力学模型,反应速率常数为0.055 min-1。对苯二酚在反应体系中2 min 之后浓度降低过程近似符合一级动力学模型,反应动力学常数为0.094 min-1。对苯醌浓度与反应时间关系可用二级反应动力学方程描述。两种中间体在反应体系中一经生成就快速被氧化降解,其反应速率常数间接说明了高铁酸钾作为水处理剂的优异性。
