细胞衰老诱导的抑制性细胞因子累积对DLBCL细胞功能的影响
2021-08-31易浏颖王极宇陶千山完颜智翔朱凤凤王会平王芝涛翟志敏
易浏颖,王极宇,陶千山,完颜智翔,朱凤凤,王会平,王芝涛,翟志敏
弥漫大B 细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是成人淋巴瘤最常见的一种类型,是一组在临床表现和预后等方面具有高度异质性的淋巴造血系统恶性肿瘤。目前,应用以利妥昔单抗为基础的免疫化疗方案(R-CHOP)完全缓解率可达75%~80%。但是,仍有超过半数的患者接受R-CHOP方案治疗后复发。
细胞衰老是一种稳定的细胞周期停滞状态,机体在应对严重的细胞损伤时启动基因重编程诱导受损细胞进入衰老状态,使其分裂停止,防止潜在的有害细胞进一步增殖。细胞衰老过去一直被认为是机体防御肿瘤细胞无限增殖的重要屏障,近些年的研究却显示,肿瘤细胞衰老与肿瘤进展密切相关。该研究旨在探讨细胞衰老在DLBCL细胞抵抗化疗中的作用及机制。
1 材料与方法
1.1 材料
人DLBCL细胞株(LY8)购自上海细胞所;RPMI-1640培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;人外周血淋巴细胞分离液购自天津灏洋华科生物科技公司;细胞衰老β-半乳糖苷酶染色试剂盒购自上海碧云天公司;ELISA试剂盒购自北京四正柏生物科技有限公司;盐酸阿霉素(doxorubicin hydrochloride,DOX)购自北京索莱宝科技有限公司;CCK-8细胞增殖及细胞毒性检测试剂盒购自上海贝博生物科技有限公司;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自上海贝博生物科技有限公司。1.2 方法
1.2.1
病例资料 选择2018年9月—2020年7月在安徽医科大学第二附属医院血液科确诊的DLBCL患者16例,其中DLBCL初诊(newly diagnosed,ND)患者6例,男4例,女2例,年龄46~69(56.67±10.40)岁;完全缓解(complete remission,CR)的DLBCL患者4例,男3例,女1例,年龄33~53(45.75±9.22)岁;复发/难治(relapsed/refractory,r/r)的DLBCL患者6例,男4例,女2例,年龄46~85(61.83±13.29)岁,反应性淋巴结增生患者4例,男1例,女3例,年龄31~63(48.00±13.52)岁,性别及年龄差异均无统计学意义(P
>0.05)。DLBCL患者的诊断及疗效评估均依据《中国弥漫大B细胞淋巴瘤诊断与治疗指南》(2013年版)判定。1.2.2
淋巴结组织HE染色 淋巴结组织由多聚甲醛固定后酒精梯度脱水,后在二甲苯中进行透明化处理,经浸蜡、包埋、切片、脱蜡与染色、漂洗、复染和封藏等一系列常规处理后,制作组织切片。光学显微镜下观察淋巴结组织形态特点。1.2.3
淋巴结组织β-
半乳糖苷酶染色 将淋巴结组织置于手工研磨器中,加入2 ml PBS溶液充分研磨,研磨完毕后过滤取上清液,用PBS洗涤1次,加入1 ml β-半乳糖苷酶染色固定液,室温固定15 min后离心吸除细胞固定液,用PBS洗涤细胞3次后吸除PBS,加入适当量的染色工作液,37 ℃、无二氧化碳、避光条件下染色过夜。普通光学显微镜下观察各组蓝染细胞数。1.2.4
外周血单个核细胞形态学观察及β-
半乳糖苷酶染色 收集患者外周血5 ml,经等体积生理盐水稀释后缓慢加入淋巴细胞分离液中,离心,收集中间白膜状细胞层,经生理盐水洗涤后,离心去除上清液,留取细胞沉淀,于倒置显微镜下观察细胞的大小和形态,用细胞衰老β-半乳糖苷酶染色试剂盒进行衰老检测,具体方法为:用PBS洗涤1次,加入染色固定液室温固定15 min后离心吸除细胞固定液,用PBS洗涤细胞3次后吸除PBS,加入适当量的染色工作液,37 ℃、无二氧化碳、避光条件下染色过夜。普通光学显微镜下观察蓝染细胞数。1.2.5
ELISA检测患者血清中白细胞介素(interleukin, IL)-2、IL-6、IL-8、IL-10、IL-35、转化生长因子β1(transforming growth factor-β1,TGF-β1)含量 取患者外周血于抗凝管内,3 000 r/min 离心10 min,分装血清,-80 ℃保存备用。按照ELISA试剂盒说明书检测患者血清中IL-2、IL-6、IL-8、IL-10、IL-35、TGF-β1含量。1.2.6
DOX构建LY8细胞衰老模型 将DOX以双蒸水配制成10 mmol/L储存液,再用含2% FBS的RPMI-1640稀释至最终浓度为10、20和40 nmol/L,DOX处理组分别用10、20或40 nmol/L DOX体外诱导LY8细胞2 h,诱导2 h结束后更换正常含10% FBS的RPMI-1640培养基,隔天诱导一次,共诱导6次。对照组依照同样频次和方式,以含2% FBS的RPMI-1640处理6次。1.2.7
细胞衰老β-
半乳糖苷酶染色 离心收集上述对照组及各浓度DOX诱导组细胞至1.5 ml离心管内,用PBS洗涤1次,加入染色固定液,室温固定15 min后离心吸除细胞固定液,用PBS洗涤细胞3次后吸除PBS,加入适当量的染色工作液,37 ℃、无二氧化碳、避光条件下染色过夜。普通光学显微镜下观察各组蓝染细胞数。1.2.8
细胞增殖检测 取上述对照组及各浓度DOX诱导组细胞,按5 000个细胞/孔的密度接种在96孔板中,每孔加入10 μl CCK-8溶液,37 ℃孵育2 h后上机检测450 nm各孔吸光度值(optical density,OD)。同时设置空白孔,且每组设立5个复孔。1.2.9
细胞凋亡检测 DOX诱导细胞衰老6代结束更换正常培养基后24 h,收集悬浮细胞于流式检测管中,1 500 r/min,离心5 min,加入预冷PBS 500 μl洗涤细胞2次,加入100 μl Binding Buffer悬浮细胞,细胞浓度约为1×10个/ml,再按照Annexin V-FITC/PI双染细胞凋亡试剂盒说明书使用流式细胞仪检测细胞凋亡。1.2.10
ELISA检测各组细胞培养上清液中细胞因子含量 通过离心去除沉淀收集各组细胞培养上清液,-80 ℃保存备用。按照ELISA试剂盒说明书检测上述各组细胞培养上清液中IL-2、IL-6、IL-8、IL-10、IL-35、TGF-β1含量。
2 结果
2.1 淋巴结组织HE 染色及衰老染色情况
各组淋巴结组织HE染色结果显示,淋巴结反应性增生组织中,可见大量淋巴细胞增生,未见异形细胞,r/r组DLBCL患者淋巴结组织中可见瘤细胞明显增大,空泡增多,细胞核呈卵圆形,胞质淡染均匀,符合衰老细胞特征。见图1。各组淋巴结组织制成的细胞悬液β-半乳糖苷酶衰老染色结果显示,r/r组DLBCL患者淋巴结组织中可见大量蓝绿色细胞,而反应性增生淋巴结组织中未见明显阳性细胞。见图2。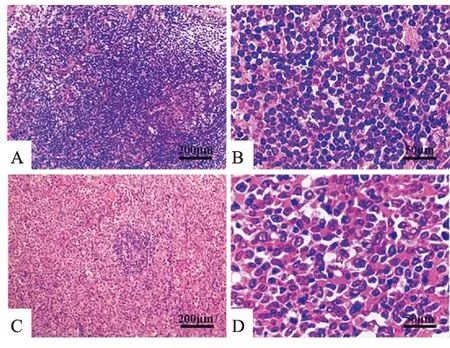
图1 各组淋巴结组织HE染色A:淋巴结反应性增生组 ×100;B:淋巴结反应性增生组 ×400;C:r/r DLBCL组 ×100;D:r/r DLBCL组 ×400

图2 各组淋巴结组织β-半乳糖苷酶染色A:淋巴结反应性增生组 ×100;B:淋巴结反应性增生组 ×400;C:r/r DLBCL组×100;D:r/r DLBCL组 ×400
2.2 外周血中细胞衰老染色情况
对DLBCL患者外周血单个核细胞形态学观察及β-半乳糖苷酶染色结果显示:DLBCL患者外周血中有淋巴瘤细胞浸润;同时与ND组DLBCL患者比较,r/r组DLBCL患者外周血中的衰老细胞明显增多。见图3。
图3 DLBCL患者外周血单个核细胞形态学观察和β-半乳糖苷酶染色情况 ×400A:ND组DLBCL患者外周血单个核细胞形态学观察;B、C:r/r组DLBCL患者外周血单个核细胞形态学观察;D:ND组DLBCL患者外周血单个核细胞β-半乳糖苷酶染色情况;E、F:r/r组DLBCL患者外周血单个核细胞β-半乳糖苷酶染色情况
2.3 各组DLBCL患者血清中衰老相关细胞因子表达情况
应用ELISA试剂盒对ND、CR、r/r三组DLBCL患者血清中的细胞因子进行检测,结果显示,与CR组比较,r/r组患者血清中IL-6、IL-8、IL-10、IL-35、TGF-β1的含量均升高;与CR组比较,ND组患者血清中IL-6、IL-10、IL-35、TGF-β1的含量升高;与ND组比较,r/r组患者血清中IL-2、IL-6、IL-8含量均升高。见图4。
图4 各组DLBCL患者血清细胞因子比较A:IL-2;B:IL-6;C:IL-8;D:IL-10;E:IL-35;F:TGF-β1;与ND组比较:*P<0.05
2.4 DOX诱导LY8细胞衰老
对照组细胞形态均一且未见衰老细胞,与对照组比较,DOX干预明显影响了细胞的生长,衰老的LY8细胞具有扩大的核,不规则的形状和生长团块,且随着DOX浓度的升高,LY8细胞中β-半乳糖苷酶阳性细胞比例也随之升高。见图5。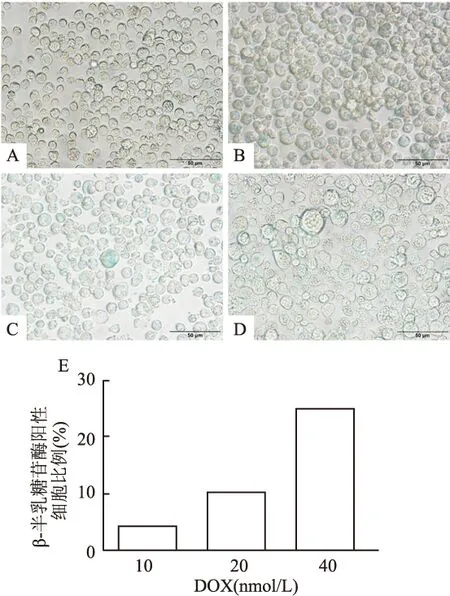
图5 各浓度DOX诱导衰老的LY8细胞SA-β-gal染色 ×400A:对照组;B:10 nmol/L DOX组;C:20 nmol/L DOX组;D:40 nmol/L DOX组;E:各浓度DOX诱导组β-半乳糖苷酶染色阳性细胞比例
2.5 DOX诱导LY8细胞衰老对细胞功能的影响
与对照组比较,经DOX诱导衰老后的LY8细胞凋亡率增高,40 nmol/L DOX组LY8细胞凋亡率高于对照组差异有统计学意义(P
<0.01);在DOX诱导组中随着DOX浓度的升高,LY8细胞的凋亡率逐渐降低,40 nmol/L DOX组LY8细胞凋亡率低于10 nmol/L DOX组,差异有统计学意义(P
<0.01)。见图6。同时,为了进一步探讨DOX对LY8细胞的增殖能力的影响,分别对对照组及各浓度DOX诱导组LY8细胞进行CCK-8检测,结果显示,四组细胞的增殖率差异有统计学意义(χ=16.969,P
<0.01),与对照组比较,经DOX诱导衰老后的LY8细胞增殖率降低,40 nmol/L DOX组LY8细胞增殖率低于对照组,差异有统计学意义(P
<0.01);在DOX诱导组中,随着DOX浓度的升高,LY8细胞的增殖率逐渐增高,40 nmol/L DOX组LY8细胞增殖率高于10 nmol/L DOX组,差异有统计学意义(P
<0.01)。见图7。
图6 流式检测各浓度DOX诱导LY8细胞的凋亡a:对照组;b:10 nmol/L DOX组;c:20 nmol/L DOX组;d:40 nmol/L DOX组;与对照组比较:**P<0.01;与10 nmol/L DOX组比较:##P<0.01
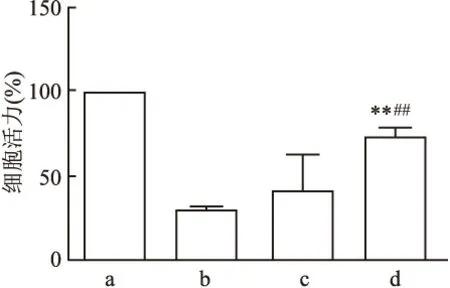
图7 CCK-8检测各浓度DOX诱导衰老对LY8细胞增殖率的影响a:对照组;b:10 nmol/L DOX组;c:20 nmol/L DOX组;d:40 nmol/L DOX组;与对照组比较:**P<0.01;与10 nmol/L DOX组比较:##P<0.01
2.6 各浓度DOX诱导后的LY8细胞衰老相关细胞因子分泌情况
应用ELISA试剂盒对各组LY8细胞分泌的细胞因子进行检测,结果显示,各组IL-2、IL-6、IL-8、IL-10、TGF-β1分泌量差异有统计学意义(F
=6.442、24.986、138.517、494.126、34.847,P
=0.016、0.000、0.000、0.000、0.000)。与对照组比较,40 nmol/L DOX组IL-2、IL-6、IL-8、IL-10、IL-35、TGF-β1分泌量增高,其中IL-2、IL-6、IL-8、IL-10分泌量差异有统计学意义(P
<0.05);与10 nmol/L DOX组比较,40 nmol/L DOX组,IL-2、IL-6、IL-8、IL-35分泌量增高,其中IL-6、IL-8分泌量差异有统计学意义(P
<0.05)。见图8。
图8 各浓度DOX诱导后LY8细胞分泌细胞因子比较A:IL-2;B:IL-6;C:IL-8;D:IL-10;E:IL-35;F:TGF-β1;a:对照组;b:10 nmol/L DOX组;c:20 nmol/L DOX组;d:40 nmol/L DOX组;与对照组比较:*P<0.05,**P<0.01;与10 nmol/L DOX组比较:#P<0.05,##P<0.01;与20 nmol/L DOX组比较:△P<0.05,△△P<0.01
3 讨论
近年来,肿瘤微环境对于癌症发病机制和患者生存的影响受到了广泛关注,在DLBCL中,肿瘤微环境成分影响淋巴样克隆进展和DLBCL患者的预后,这种影响基于肿瘤细胞与基质成分,细胞外基质、炎性细胞和免疫细胞之间的相互作用。尽管周期停滞是细胞衰老的典型特征,但是衰老对微环境的影响是巨大的。过去认为衰老是防御肿瘤无限增殖的重要屏障,但越来越多的研究显示,衰老也可以促进肿瘤进展。衰老细胞分泌的生长因子、细胞因子和蛋白酶等构成的衰老相关分泌表型(senescence-associated secretory phenotype,SASP)能够引起周围免疫微环境的广泛应答,并且与衰老诱导剂的形式,经历衰老的细胞类型,衰老的肿瘤细胞所处阶段紧密相关。衰老通过诱导肿瘤发生,免疫抑制,化学耐药性和转移而促进肿瘤进展。SASP最致瘤的作用之一是促进上皮细胞的增殖。目前在淋巴瘤中,仅有IL-6是较为公认的SASP因子,而在本研究中,DLBCL中SASP因子包括IL-6、IL-8、IL-10、IL-35、TGF-β1,在r/r组DLBCL患者中和体外DLBCL衰老模型中均呈现不同程度的上调。同时,体外使用DOX反复诱导的衰老DLBCL细胞具有更强的抗凋亡能力,这可能是衰老参与淋巴瘤复发的重要因素之一。化疗应激诱导的衰老DLBCL细胞在体内或体外均可促进各种促炎和免疫抑制性细胞因子分泌,形成独特的SASP。这种独特的SASP在机体对抗DLBCL免疫应答中起负性调控作用,诱导DLBCL细胞凋亡抵抗。
综上所述,本研究结果初步提示细胞衰老通过诱导抑制性细胞因子累积促进DLBCL细胞凋亡抵抗,这项研究仍有一些局限性。首先,由于临床病例有限,未进一步比较不同阶段和类型患者的衰老细胞比例和SASP水平;其次,在体外仅使用LY8细胞进行实验,该DLBCL细胞系OCI-LY8起源于生发中心型,不能代表非生发中心型来源;同时,细胞衰老促进DLBCL细胞凋亡抵抗在分子水平上的确切机制仍有待进一步研究。
