抑制p38MAPK信号通路对尿源性脓毒血症兔肾组织细胞凋亡的影响及其作用机制
2021-08-31唐亚纯许武军吴孝斌
唐亚纯,许武军,陈 仙,吴孝斌,符 浩
脓毒症是一种常见的由感染引起的全身炎症反应综合征,可导致机体重大脏器功能障碍。在多种感染途径中,尿路感染约占严重脓毒症病例的9%,常见于与临床医疗相关的尿路感染,包括因尿路干预和前列腺活检导致的尿源性脓毒症。研究发现,上尿路感染的患者发生患肾功能衰竭的风险更高。肾组织细胞凋亡是尿源性脓毒症的病理生理学的核心表现,因此抑制肾细胞凋亡对保护尿源性脓毒症患者肾功能尤为重要。p38丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)是一种应激激活蛋白激酶,对细胞存活和增殖具有负性调节作用。前期研究显示,HS能够通过抑制肾组织中p38 MAPK蛋白的磷酸化激活而减少尿源性脓毒血症兔肾组织细胞凋亡,但p38 MAPK信号通路的抑制又是如何介导尿源性脓毒血症兔肾组织细胞凋亡目前还未知。作为抑癌基因,p53可通过参与诱导细胞凋亡、阻滞细胞周期进程等生物学过程发挥作用。有研究显示,p38 MAPK能够通过介导小鼠双微体扩增(murine double minute 2,MDM2)蛋白降解而促进p53表达,而p53介导的细胞凋亡途径是细胞凋亡的重要途径之一。因此,该研究通过观察p38 MAPK抑制剂SB203580对尿源性脓毒症新西兰兔肾功能以及肾组织凋亡情况的影响,探讨p38 MAPK介导肾细胞凋亡的可能机制。
1 材料与方法
1.1 实验动物
60只健康雄性新西兰兔购自湖南太平生物科技有限公司,体质量2.0~2.4 kg,实验动物生产许可证:SCXK(湘)2015-0004。标准颗粒饲料及纯净水喂养,铁笼边放饲料槽及自由饮水管,湿度 50%~60%,室温 20~25 ℃。1.2 主要试剂与仪器
大肠埃希菌菌液购自美国ATCC(25922),由南华大学附属第二医院检验科保存。p53激活剂Nutlin-3购自美国Selleckem公司;p38 MAPK抑制剂SB203580购于美国MedChemExpress公司;血清白细胞介素1β(interleukin-1β,IL-1β)、白细胞介素6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)含量检测ELISA试剂盒购自南京森贝伽生物科技公司;TUNEL细胞凋亡检测试剂盒(绿色FITC标记荧光)购自江苏凯基生物技术股份有限公司;PrimeScript RT试剂盒和TB Green® Premix Ex TaqⅡ试剂盒购自日本TaKaRa公司;鼠抗人MDM2抗体、鼠抗人p53抗体、鼠抗人PUMA抗体购自美国Santa Cruze Biotechnology公司;兔抗人Cleaved caspase-3抗体、兔抗人Bax抗体、兔抗人Bcl-2抗体、兔抗人p-p38MAPK(Thr180/Tyr182) 抗体、兔抗人p38MAPK抗体和兔抗人GAPDH抗体购自英国Abcam公司;480荧光定量PCR仪购自美国罗氏公司;Gel Doc XR凝胶成像仪购自美国Bio-Rad公司;全自动血细胞分析仪购自深圳库贝尔生物科技股份有限公司;全自动生化分析仪购自德国西门子公司。1.3 方法
1.3.1
尿源性脓毒血症模型构建与动物分组 采用30 mg/kg戊巴比妥静脉注射麻醉新西兰兔,取左肋缘最低点作切口(3 cm),在后腹腔找到左肾及输尿管,游离输尿管上段,用1号丝线结扎输尿管远端,按0.5 ml/kg在输尿管近端注入10cfu/ml大肠埃希菌菌液,制备尿源性脓毒血症兔模型,术后正常喂养。采用随机数字表法将60只新西兰兔分成4组,每组15只。假手术组(sham):按尿源性脓毒血症模型构建的步骤,游离输尿管上段后,立刻缝合切口,术后正常喂养;尿源性脓毒血症组(Model):按尿源性脓毒血症模型构建步骤进行处理;p38MAPK抑制剂SB203580处理组(SB203580):在尿源性脓毒血症组的基础上,造模前30 min给予30 μg/kg SB203580溶液静脉注射,1次/d,干预3 d;SB203580+p53激活剂Nutlin-3组(SB203580+Nutlin-3):在注射SB203580溶液同时,给予128 mg/kg Nutlin-3溶液腹腔注射,1次/d,干预3 d。1.3.2
大体观察 分别记录造模后24、48 和72 h 时各组新西兰兔的肛温、呼吸频率、心率等情况变化。1.3.3
血清指标检测 在造模后72 h取新西兰兔的耳动脉血,利用全自动血液细胞分析仪进行白细胞计数(white blood cell,WBC);全自动生化分析仪检测肾功能指标血肌酐、尿素氮的水平;利用ELISA试剂盒检测血清IL-1β、IL-6和TNF-α含量。1.3.4
TUNEL染色观察肾组织细胞凋亡水平 造模后72 h取肾组织进行常规石蜡切片,经脱蜡至水,根据TUNEL染色试剂盒操作步骤进行染色后,置于荧光显微镜下观察肾组织细胞凋亡情况。1.3.5
qRT-PCR法检测肾组织MDM2和p53 mRNA表达水平 造模后72 h取适量肾组织,使用TRIzol试剂提取总RNA。用PrimeScript RT试剂盒将总RNA逆转录成cDNA,再利用TB Green® Premix Ex TaqⅡ试剂盒进行PCR扩增检测。目的基因相对表达量用2公式计算得出。PCR引物序列MDM2-F:5′-CCTGGCGTCGTGATTAGTGAT-3′,MDM2-R:5′-AGACGTTCAGTCCTGTCC ATAA-3′;p53-F:5′-ACAGAAACACCTTCCGACAC-3′,p53-R:5′-CCTGGGCATC CTTTAGCT-3′;GAPDH-F:5′-ACGGATTTGGTCGTATTGGG-3′,GAPDH-R:5′-CGCTCCTG GAAGATGGTGAT-3′。1.3.6
Western blot法检测肾组织凋亡、p38MAPK信号通路和p53凋亡途径相关蛋白表达水平 造模72 h后取适量肾组织,加入液氮后充分研磨,RIPA细胞裂解液溶解,置冰上30 min,4 ℃ 13 000 r/min离心10 min,取上清液。用BCA测定蛋白质浓度,取30 μg总蛋白,于12%聚丙烯酰胺凝胶上进行电泳分离,转移到PVDF膜上,加入5%脱脂奶粉室温封闭1 h,分别加入Cleaved caspase-3(1 ∶2 000)、Bax(1 ∶2 000)、Bcl-2(1 ∶1 000)、p38 MAPK(1 ∶1 000)、p-p38 MAPK(1 ∶4 000)、MDM2(1 ∶500)、p53(1 ∶200)、PUMA(1 ∶100)和GAPDH(1 ∶1 000)抗体,4 ℃孵育过夜,用TBST缓冲液洗涤3次,每次10 min,加入相应的辣根过氧化物酶标记的第二抗体,室温孵育2 h,ECL试剂显色,曝光成像,扫描图像。用Quantity One V6.42软件对每个条带的灰度值进行分析,以同一样本中每个靶带的灰度值与GAPDH条带灰度值之比作为目标蛋白的定量结果。
2 结果
2.1 抑制p38MAPK信号通路对兔大体观察的影响
与sham组比较,Model组造模后24、48和72 h兔肛温、呼吸频率和心率均上升(P
<0.05);与Model组比较,SB203580组造模后24、48和72 h兔肛温、呼吸频率和心率降低(P
<0.05);与SB203580组比较,SB203580+Nutlin-3组造模后24、48和72 h兔肛温、呼吸频率和心率上升(P
<0.05)。见表1。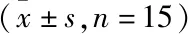
表1 各组兔肛温、呼吸频率和心率比较
2.2 抑制p38MAPK信号通路对兔血WBC和炎症因子指标变化的影响
与sham组比较,Model组兔血WBC、血清IL-1β、IL-6和TNF-α水平均上升(P
<0.05);与Model组比较,SB203580组兔血WBC、血清IL-1β、IL-6和TNF-α水平降低(P
<0.05);与SB203580组比较,SB203580+Nutlin-3组兔血WBC、血清IL-1β、IL-6和TNF-α水平上升(P
<0.05)。见表2。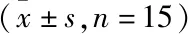
表2 各组兔血白细胞计数和细胞炎症因子水平比较
2.3 抑制p38MAPK信号通路对兔肾功能的影响
与sham组比较,Model组兔肌酐和尿素氮水平均上升(P
<0.05);与Model组比较,SB203580组兔肌酐和尿素氮水平降低(P
<0.05);与SB203580组比较,SB203580+Nutlin-3组兔肌酐和尿素氮水平上升(P
<0.05)。见表3。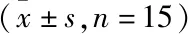
表3 各组兔肾功能指标血清比较
2.4 抑制p38MAPK信号通路对兔肾组织凋亡情况的影响
4组兔肾组织细胞凋亡蛋白Cleaved caspase-3(F
=531.70,P
<0.01)、Bax(F
=254.51,P
<0.01)和Bcl-2(F
=471.40,P
<0.01)表达水平有变化,差异有统计学意义。与sham组比较,Model组兔肾组织细胞凋亡水平,Cleaved caspase-3和Bax蛋白表达水平上升,Bcl-2蛋白表达水平降低(P
<0.05);与Model组比较,SB203580组兔肾组织细胞凋亡水平,Cleaved caspase-3和Bax蛋白表达水平降低,Bcl-2蛋白表达水平增加(P
<0.05);与SB203580组比较,SB203580+Nutlin-3组兔肾组织细胞凋亡水平,Cleaved caspase-3和Bax蛋白表达水平上升,Bcl-2蛋白表达水平降低(P
<0.05)。见图1、2。
图1 TUNEL染色观察兔肾组织凋亡情况 ×2001:sham组;2:Model组;3:SB203580组;4:SB203580+Nutlin-3组
2.5 抑制p38MAPK信号通路对兔肾组织p38MAPK蛋白表达的影响
4组兔肾组织p-p38MAPK蛋白表达水平有变化,差异有统计学意义(F
=245.10,P
<0.01),而p38MAPK蛋白表达水平无变化(F
=0.20,P
=0.89)。与sham组比较,Model组兔肾组织p-p38MAPK蛋白表达水平升高(P
<0.05);与Model组比较,SB203580组兔肾组织p-p38MAPK蛋白表达水平降低(P
<0.05);与SB203580组比较,SB203580+Nutlin-3组兔肾组织p-p38MAPK蛋白表达水平无差异(P
>0.05)。见图3。
图2 兔肾组织凋亡相关蛋白表达水平比较1:sham组;2:Model组;3:SB203580组;4:SB203580+Nutlin-3组;与sham组比较:*P<0.05;与Model组比较:#P<0.05;与SB203580组比较:&P<0.05

图3 兔肾组织p38MAPK蛋白表达水平比较1:sham组;2:Model组;3:SB203580组;4:SB203580+Nutlin-3组;与sham组比较:*P<0.05;与Model组比较:#P<0.05
2.6 抑制p38MAPK信号通路对兔肾组织p53介导的凋亡途径的影响
4组兔肾组织MDM2 mRNA和蛋白表达水平有变化,差异有统计学意义(F
=303.30,P
<0.01;F
=223.75,P
<0.01);p53 mRNA和蛋白表达水平有变化,差异有统计学意义(F
=2 092.05,P
<0.01;F
=469.62,P
<0.01);PUMA蛋白表达水平有变化,差异有统计学意义(F
=122.80,P
<0.01)。与sham组比较,Model组兔肾组织MDM2 mRNA和蛋白表达水平降低,p53 mRNA和蛋白表达水平,PUMA蛋白表达水平升高(P
<0.05);与Model组比较,SB203580组兔肾组织MDM2 mRNA和蛋白表达水平升高,p53 mRNA及p53、PUMA蛋白表达水平降低(P
<0.05);与SB203580组比较,SB203580+Nutlin-3组兔肾组织MDM2 mRNA和蛋白表达水平无变化(P
>0.05),p53 mRNA及p53、PUMA蛋白表达水平升高(P
<0.05)。见图4。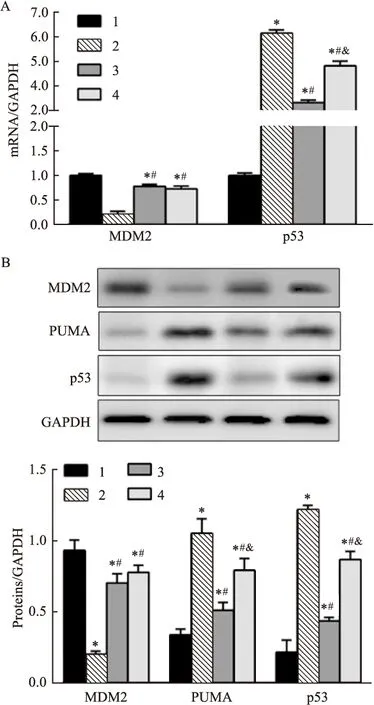
图4 兔肾组织p53介导的凋亡途径相关mRNA和蛋白表达水平比较A:qRT-PCR检测肾组织中p53和MDM2 mRNA表达水平;B:Western blot检测肾组织中MDM2,PUMA和p53蛋白表达水平;1:sham组;2:Model组;3:SB203580组;4:SB203580+Nutlin-3组;与sham组比较:*P<0.05;与Model组比较:#P<0.05;与SB203580组比较:&P<0.05
3 讨论
脓毒症综合征是机体对感染的复杂炎症反应,病死率高,是非心脏重症监护患者死亡的主要原因之一。但在日常临床体检中常常无法及时监测到早期脓毒症。尿源性脓毒症是一种严重的、危及生命的泌尿系感染并发症,死亡率非常高,因此,迅速发现尿源性脓毒症并开始适当的治疗十分重要。当外界感染刺激机体免疫系统如Toll样受体等,会导致大量促炎性细胞因子(如IL-1和IL-6)分泌。在初始促炎阶段之后,会出现一个反调节的抗炎反应,导致免疫抑制状态。目前,尿源性脓毒症所致的肾损伤机制尚不清楚,大多数普遍认为,血流动力改变、炎症介质、免疫抑制和细胞凋亡与机体功能紊乱密切相关,其中炎症介质是核心因素。因此本研究从炎症介质和细胞凋亡探讨尿源性脓毒症所致肾损伤的可能机制理论上可行。本研究结果表明,尿源性脓毒症新西兰兔肛温、呼吸频率、心率、血WBC、血清IL-1β、IL-6和TNF-α水平均升高,说明尿源性脓毒症兔体内炎症反应加剧。已有研究证实,尿源性脓毒症后出现的肾损伤并发症可能是通过炎症因子诱导肾细胞凋亡引起的。本研究结果表明,尿源性脓毒症兔血肌酐、尿素氮含量、肾组织细胞凋亡水平增加,说明尿源性脓毒症兔出现严重肾损伤。与之前的研究结果一致,提示尿源性脓毒症新西兰兔动物模型构建成功。
MAPK包括三大类:p42/44细胞外信号调节D激酶(ERK),c-Jun氨基末端激酶(JNK)和p38激酶。p38MAPK信号通路作为MAPK家族中的重要组成部分,在炎症、细胞应激、凋亡和细胞周期等多种生理病理过程中具有重要作用。已有研究证明,山楂叶总黄酮通过下调糖尿病肾病大鼠肾组织p38MAPK信号通路活性,改善氧化应激对肾组织的损伤。另有研究发现,p38MAPK通路在脓毒症新生大鼠脑组织中异常激活,诱导脑组织炎症、氧化应激和细胞凋亡。采用p38MAPK信号通路抑制剂SB203580干预后,脑组织炎症、氧化应激和细胞凋亡情况均被逆转。SB203580是p38MAPK的一种有效抑制剂,广泛应用于各种实验动物模型。SB203580通过与p38MAPK上的ATP结合位点结合抑制p38MAPK活性,阻止下游靶点磷酸化,但不能改变p38MAPK的表达水平。本研究结果表明,SB203580能逆转尿源性脓毒症兔各检测指标,并且有效抑制肾组织磷酸化p38MAPK水平,但对p38MAPK本底蛋白表达水平无影响,验证了p38MAPK抑制剂SB203580对p38MAPK磷酸化的抑制作用。
p53作为肿瘤抑制蛋白,通过转录调控下游靶基因参与细胞周期和凋亡过程。p53激活后,通过激活促凋亡基因(如Bax)诱导细胞凋亡,同时,还能与抗凋亡线粒体蛋白(如Bcl-2)结合直接诱导细胞凋亡。研究发现,脓毒症大鼠肾组织细胞凋亡率升高,细胞促凋亡蛋白Bax和Cleaved caspase-3相对表达量升高,抗凋亡蛋白Bcl-2相对表达量降低。脓毒症肾损伤通过caspase-3诱导细胞凋亡,且呈时间依赖性。研究证明,脓毒血症组的肾组织凋亡细胞集中成团,凋亡细胞布满整个视野,凋亡指数高于假手术组。这些研究说明,脓毒症诱导肾组织细胞凋亡。已有研究证实,调节p53蛋白降解的分子是MDM2。MDM2是p53的典型E3泛素连接酶,也是p53靶基因之一。p38MAPK诱导p53磷酸化导致其与MDM2脱节,从而避免泛素蛋白酶体降解,表明p38MAPK以翻译后方式调节MDM2和p53表达。目前,没有研究清楚阐明p38MAPK如何介导MDM2的降解。p38MAPK可能直接磷酸化MDM2,导致其通过蛋白酶体途径降解。另外,p38MAPK可能与其他分子相互作用来调节MDM2的稳定性。研究发现,MDM2活性的抑制提高了p53的稳定性,通过增强MDM2-E3连接酶活性促进p53降解。本研究结果表明,SB203580能上调MDM2表达水平,抑制p53和PUMA表达水平,加入p53激活剂Nutlin-3干预后,能逆转SB203580干预后尿源性脓毒症兔的各项检测指标,但Nutlin-3只能上调肾组织PUMA 和p53的表达水平,无法调控MDM2和p-p38MAPK的表达水平,这是由于p53激活剂Nutlin-3的作用原理是与MDM2结合,进而抑制MDM2对p53蛋白的降解,与p53蛋白是竞争关系,因此无法调控其结合蛋白MDM2的表达水平,也对上游p-p38MAPK蛋白表达水平无影响。
综上所述,在尿源性脓毒症兔中,抑制p38MAPK信号通路能促进MDM2蛋白表达,诱导p53蛋白降解,进而抑制p53介导的肾细胞凋亡,缓解尿源性脓毒症引起的肾损伤。
