超高效液相色谱-串联质谱法快速测定豆芽中12种植物生长调节剂的含量
2021-08-29林守二郑仁锦华永有黄丽英
林守二,郑仁锦,华永有,黄丽英
(1.福建省疾病预防控制中心 福建省人兽共患病研究重点实验室,福州 350001;2.福建医科大学 药学院,福州 350004)
豆芽具有健脾养肝、清热解毒等作用,同时含有蛋白质、维生素、糖类以及多种矿物质[1-2]。然而,一些不法商贩为牟取高额利润,在豆芽生产过程中滥用植物生长调节剂(PGRs),企图增加豆芽产量、改变外观、缩短生长周期等,以致“毒豆芽”事件频出[3]。人体摄入PGRs短期内影响不大,但长期食用可能导致各种疾病,轻者刺激黏膜、恶心、呕吐等,重者引起肢端肥大、骨质疏松、非霍奇金淋巴瘤等[4]。
豆芽中PGRs种类较多,残留量低,基质复杂,检测难度较大。目前,用于PGRs检测的前处理方法主要包括液液萃取、加速溶剂萃取、超声波提取、微波辅助萃取及固相萃取等[5],其中基质分散固相萃取试剂Qu ECh ERS已成为农药残留快速前处理技术的首选[6]。PGRs的检测方法主要有气相色谱法、气相色谱-质谱联用法、液相色谱法、离子色谱法、液相色谱-质谱联用法、液相色谱-串联质谱法、毛细管电泳色谱法及酶联免疫法等[7-13]。其中超高效液相色谱-串联质谱法(UHPLC-MS/MS)在测定植物中农药残留时,检出限低,受基质干扰小,快速且准确[14-15]。
目前采用UHPLC-MS/MS测定豆芽中PGRs的含量已有报道[16-18],但各文献所用前处理方法及所检测目标组分皆有差异,且由于PGRs类化合物各目标组分间性质差异较大,在多组分同时检测时选用合适的前处理及检测方法尤为重要。本工作以市售32份豆芽为样本,应用QuECh ERS快速前处理方法,同时对样品中12种不同类的PGRs,包括植物生长促进剂类(生长素类)的吲哚乙酸、吲哚丁酸、2,4-二氯苯氧乙酸(2,4-D)和4-氯苯氧乙酸,细胞分裂素类的6-苄氨基嘌呤、噻苯隆、氯吡脲、赤霉素,植物生长延缓剂类的矮壮素、抗倒酯、烯效唑、多效唑进行净化;结合UHPLC-MS/MS检测技术,对质谱条件的参数进行科学设定,实现了电喷雾离子源(ESI)正负离子的快速切换,一次进样同时完成ESI正、负检测,建立了同时测定豆芽中12种PGRs的方法,可用于市售豆芽的快速检测,易于普及应用,为建立其他食品基质中相关化合物残留检测提供参考。
1 试验部分
1.1 仪器与试剂
XEVO TQ-XS型超高效液相色谱-三重四极杆质谱联用仪(Waters I-class 型液相色谱系统,UPLC-XEVO TQ-XS 型质谱系统);Heidolph Multi Reax 型自动涡旋混合器;Beckman Coulter Allegra X-30型离心机;QuECh ERS 试剂管(内含150 mg无水硫酸镁和50 mg C18)。
单标准储备溶液:1.00 g·L-1,分别称取10.00 mg 12种PGRs标准品,用乙腈配制成质量浓度各为1.00 g·L-1的标准储备溶液。
单标准溶液:10.0 mg·L-1,移取单标准储备溶液适量,用乙腈稀释配制成质量浓度为10.0 mg·L-1的单标准溶液。
混合标准溶液:500μg·L-1,移取各单标准溶液适量,用乙腈稀释,混匀,配制成质量浓度为500μg·L-1的混合标准溶液,于4 ℃冰箱中保存,使用时用乙腈稀释至所需质量浓度。
12种PGRs标准品矮壮素、吲哚乙酸、吲哚丁酸、6-苄氨基嘌呤、抗倒酯、烯效唑、多效唑、4-氯苯氧乙酸、噻苯隆、2,4-D、氯吡脲、赤霉素的纯度均大于98%;甲酸、乙腈为色谱纯;甲酸铵为优级纯;无水硫酸镁为分析纯。
豆芽样品采集于福州的某超市及农贸市场,所有样品匀浆后于-18 ℃以下保存备检。
1.2 仪器工作条件
1)色谱条件 Waters Acquity UPLCⓇHSS T3色谱柱(50 mm×2.1 mm,1.8μm);柱温30 ℃;流量0.3 mL·min-1;进样量2μL;流动相A 为含0.1%(体积分数,下同)甲酸的5 mmo L·L-1甲酸铵溶液,B为乙腈。梯度洗脱程序:0~5.0 min时,B由20%升至90%,保持1.0 min;6.0~6.5 min时,B由90%降至20%,保持1.5 min。
2)质谱条件 ESI源,离子源温度150 ℃;毛细管电压2.4 k V;脱溶剂气温度500 ℃,脱溶剂气流量800 L·h-1;锥孔电压22 V;多反应监测(MRM)模式;矮壮素、吲哚乙酸、吲哚丁酸、6-苄氨基嘌呤、抗倒酯、烯效唑、多效唑在电喷雾正离子(ESI+)模式下检测;4-氯苯氧乙酸、噻苯隆、2,4-D、氯吡脲、赤霉素在电喷雾负离子(ESI-)模式下检测,一次进样同时完成ESI(±)模式的检测。12种PGRs的其他质谱参数见表1,其中“∗”为定量离子。
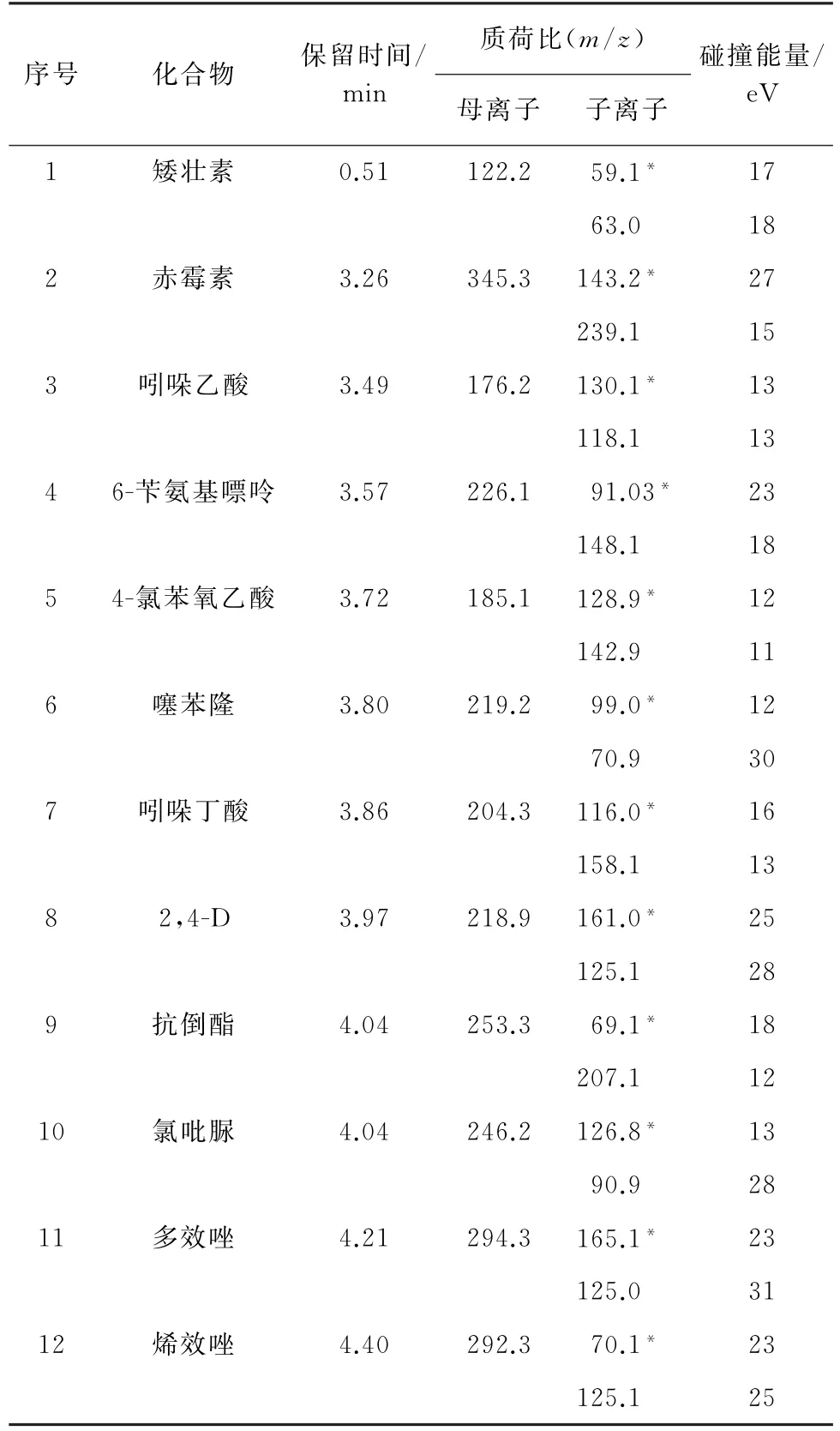
表1 12种PGRs的质谱参数Tab.1 MS parameters of 12 PGRs
1.3 试验方法
称取5.00 g经匀浆后的样品于50 mL 离心管中,加入体积比1∶99的乙酸-乙腈混合液10 mL,自动涡旋振荡2 min,超声15 min,以转速6 000 r·min-1离心5min。取上清液1.0mL,加至QuEChERS试剂管内,涡旋后离心5 min,上清液过0.22μm 微孔滤膜,按仪器工作条件测定。
2 结果与讨论
2.1 色谱行为
在仪器工作条件下,12种PGRs的混合标准溶液的MRM 色谱图见图1。
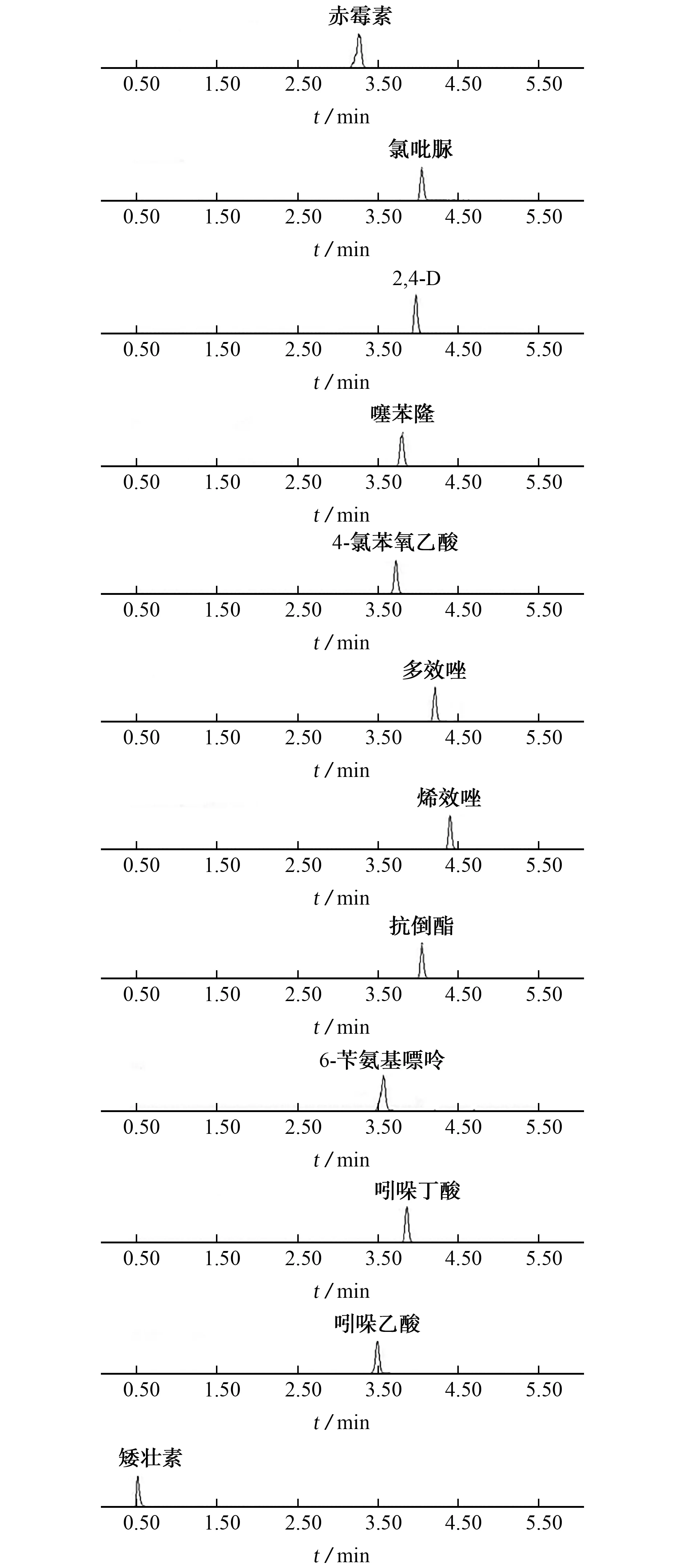
图1 12种PGRs的MRM 色谱图Fig.1 MRM chromatograms of 12 PGRs
2.2 提取剂的选择
PGRs的常用提取剂有甲醇、乙腈、丙酮、乙酸乙酯、二氯甲烷等,在提取过程中加入少量酸[19]可提高提取效率。试验考察了上述常用提取剂对12种PGRs提取效果的影响。结果表明:使用乙腈作为提取剂,各组分均能得到较好的回收率;赤霉素、2,4-D、4-氯苯氧乙酸、吲哚乙酸和吲哚丁酸结构中均含有羧基,酸性溶液抑制羧基在溶液中电离,从而提高提取效率,而乙酸酸性适中,因此最终选用体积比1∶99的乙酸-乙腈混合液作为提取剂。
2.3 净化剂的选择
试验比较了N-丙基乙二胺(PSA)、石墨化炭黑(GCB)和C18等QuECh ERS 试剂的净化效果。结果发现:加入PSA 使得极性较强的矮壮素以及含有羧基的赤霉素、2,4-D、4-氯苯氧乙酸、吲哚乙酸和吲哚丁酸的回收率降低,与文献[14,20]报道相符,其原因可能是因为PSA 为碱性,对含有羧酸类的PGRs有吸附作用,故不适合极性较强和含有羧基的PGRs的净化,适合植物生长延缓剂类抗倒酯、烯效唑、多效唑的净化;GCB的加入使得氯吡脲、多效唑和烯效唑的回收率明显降低;而单独加入C18,所有组分的回收率均大于70.0%。因此,试验最终选择C18作为QuECh ERS试剂管内的净化剂。
2.4 色谱柱的选择
试验比较了Waters Acquity UPLCⓇBEH C18色谱柱(100 mm×2.1 mm,1.7 μm)、Acquity UPLCⓇBEH C18色谱柱(50mm×2.1 mm,1.7μm)和Waters Acquity UPLCⓇHSS T3色谱柱(50 mm×2.1 mm,1.8μm)对待测组分的分离效果。结果表明,12种PGRs在Waters Acquity UPLCⓇHSST3色谱柱(50 mm×2.1 mm,1.8μm)上的峰形对称,响应较好,因此试验选用Waters Acquity UPLCⓇHSS T3色谱柱。
2.5 质谱条件的选择
配制100μg·L-1的12 种PGRs混合标准溶液,分别在ESI(±)模式下寻找母离子,并调试各自最佳锥孔电压及碰撞能量,寻找各组分的二级离子,最终选取丰度较高的2个子离子分别作为定量及定性离子,优化后的具体参数见1.2节中的质谱条件。
2.6 工作曲线和检出限
12种PGRs均采用基质匹配外标曲线法定量分析,以空白基质配制基质匹配的混合标准溶液。以PGRs的质量分数为横坐标,对应的定量离子峰面积为纵坐标绘制工作曲线。所得12种PGRs的线性参数见表2。
以3倍信噪比(S/N)计算检出限(3S/N),10倍信噪比计算测定下限(10S/N),结果见表2。
由表2可知:所得相关系数均大于0.990 0;检出限为0.60~6.0μg·kg-1。
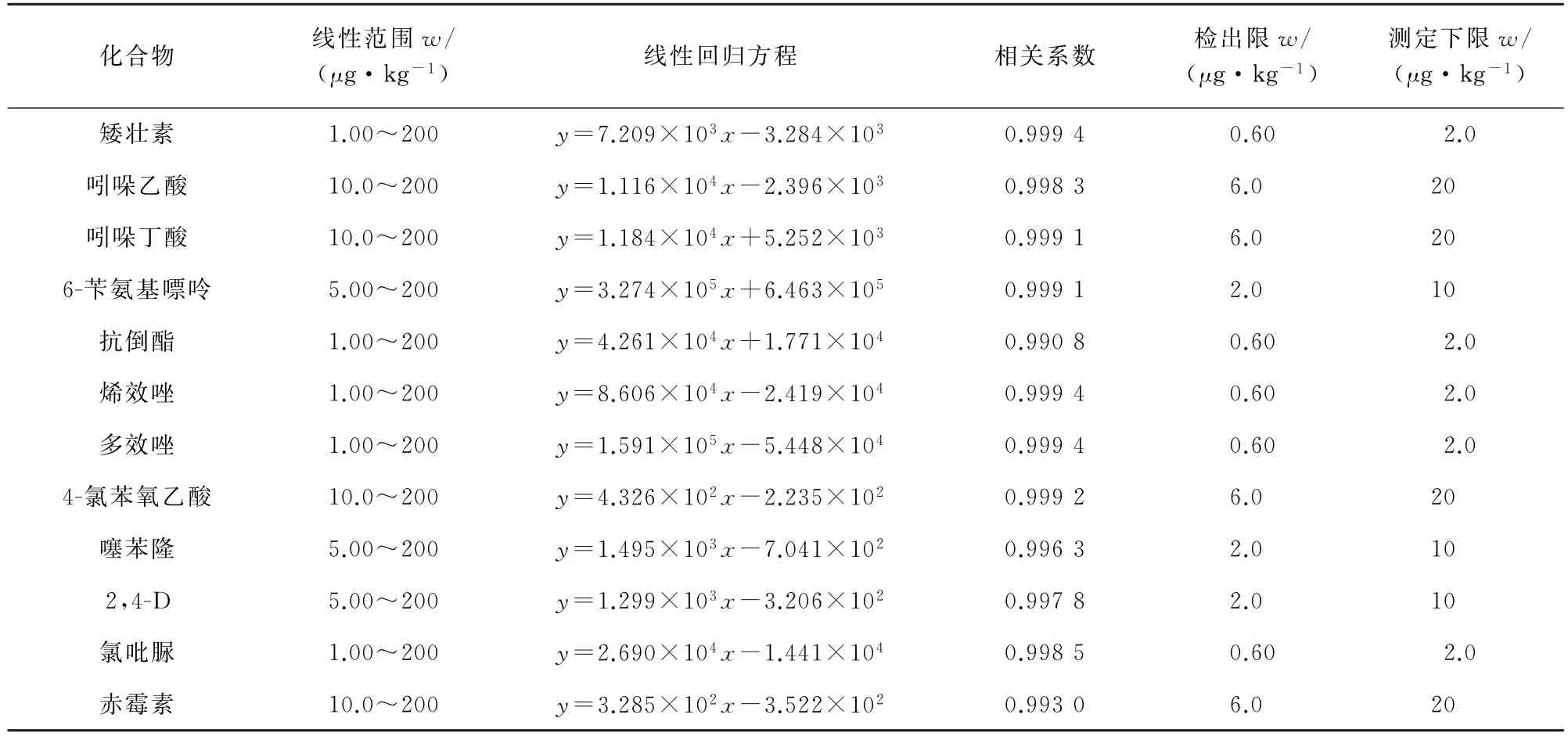
表2 线性参数、检出限和测定下限Tab.2 Linearity parameters,detection limits and lower limits of determination
2.7 精密度和回收试验
分别选择不含目标化合物的黄豆芽和绿豆芽的空白样品,加入低、中、高等3个浓度水平的混合标准溶液,使得矮壮素、6-苄氨基嘌呤、抗倒酯、烯效唑、多效唑、噻苯隆、2,4-D 和氯吡脲的浓度水平为5.00,10.0,50.0μg·kg-1,吲哚乙酸、吲哚丁酸、4-氯苯氧乙酸、赤霉素的浓度水平为10.0,50.0,100μg·kg-1,按试验方法测定,每个浓度水平平行测定6次,计算回收率和测定值的相对标准偏差(RSD),结果见表3。由表3可知,测得的回收率为70.0%~110%,RSD 为0.21%~9.8%。
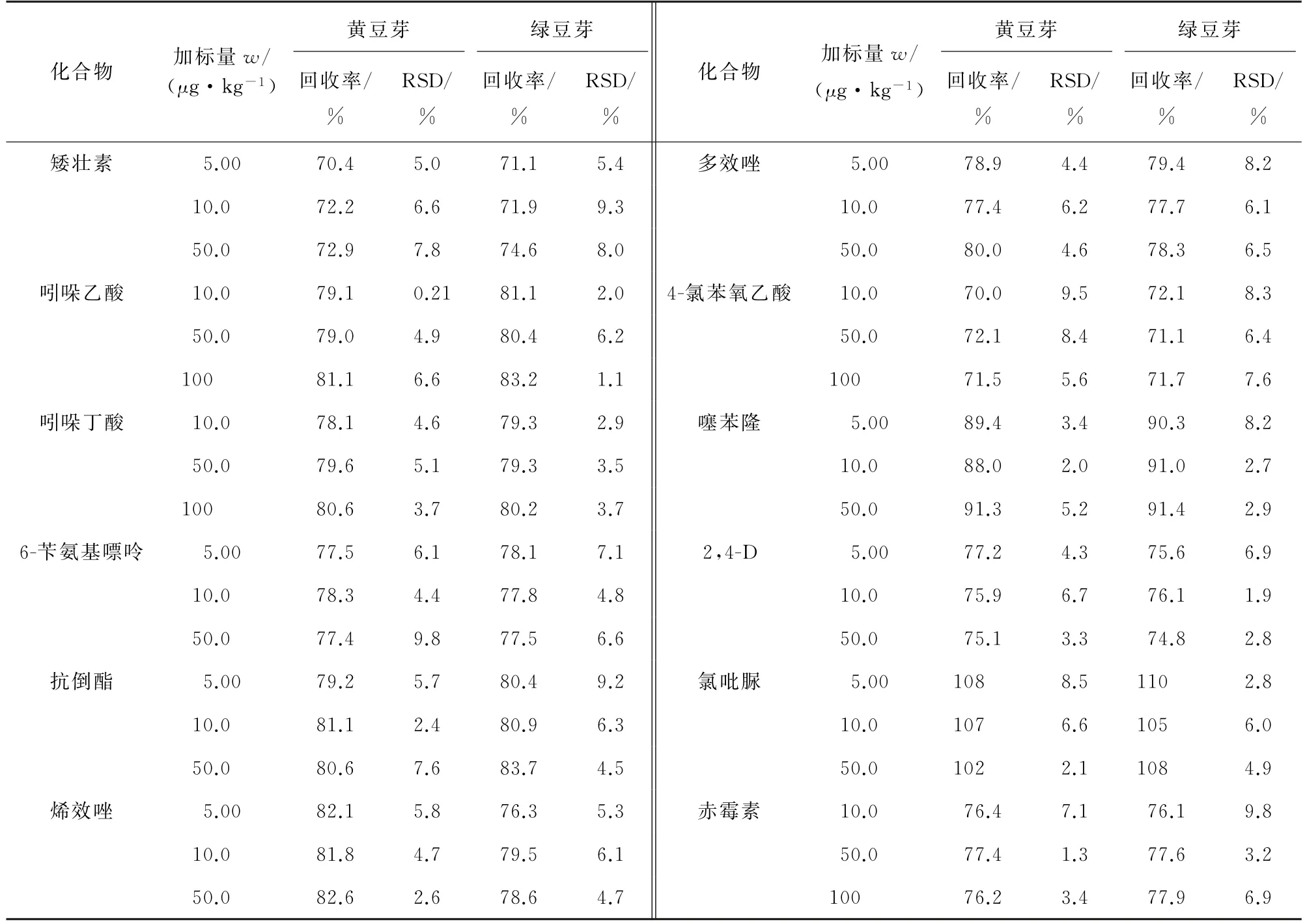
表3 精密度和回收试验结果(n=6)Tab.3 Results of tests for precision and recovery(n=6)
2.8 样品分析
按试验方法对市售32份豆芽样品进行快速检测,10 份豆芽样品中检出PGRs,总检出率为31.25%,其中检出组分为吲哚乙酸、6-苄氨基嘌呤、4-氯苯氧乙酸、2,4-D 和氯吡脲,具体详见表4。吲哚乙酸是植物内源性生长素之一,其检出量较高,但尚未见豆芽中吲哚乙酸含量的报道。样品总检出率相比于其他文献报道稍低,但含量范围与文献[16-18]测定值相当,表明近些年市售豆芽中PGRs的使用控制良好,但仍需持续监测。
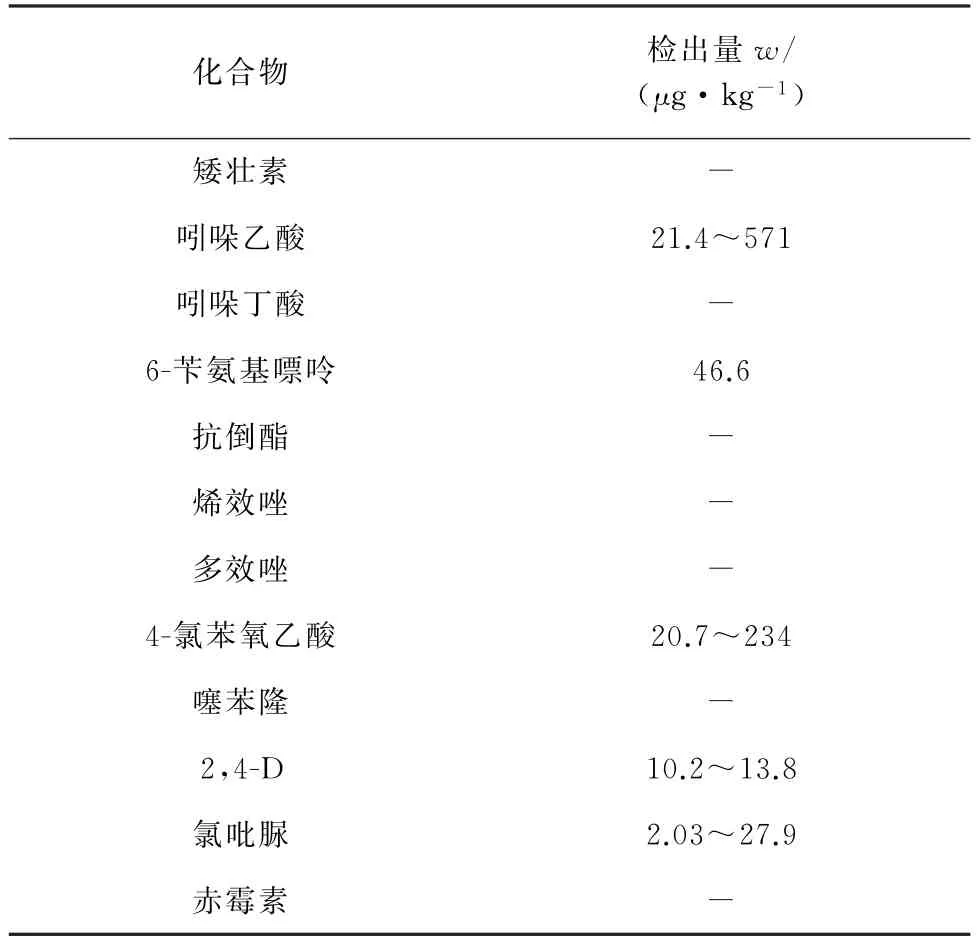
表4 12种PGRs在豆芽中的检出结果Tab.4 Results of detection of 12 PGRs in bean sprouts
本工作以体积比1∶99的乙酸-乙腈混合液提取豆芽中12种PGRs,并优化选择以无水硫酸镁和C18作为Qu ECh ERS净化剂对提取后的样品进行净化,通过调试质谱参数和色谱条件,建立UHPLCMS/MS同时快速测定豆芽中12种PGRs的方法。QuEChERS前处理方法操作简便、试剂消耗量小、净化效果好;UHPLC-MS/MS的检测方法与传统液相色谱法相比,极大缩短了分析时间,适合于大批量样品的多组分快速筛查与测定。该方法为快速筛查市场中的“毒豆芽”提供参考。
