杀鲑气单胞菌溶血素和菌毛蛋白的重组表达及其免疫保护效果研究*
2021-08-28于晓清王晓璐王友红叶海斌吴海一
李 乐,刁 菁,于晓清,王晓璐,王友红,叶海斌,吴海一
(山东省海洋科学研究院,山东省海水养殖病害防治重点实验室,山东青岛 266104)
0 引言
杀鲑气单胞菌是鱼类养殖过程中危害比较严重的一种细菌性病原,包括杀鲑亚种Aeromonassalmonicidasubsp.salmonicida、无色亚种A.salmonicidasubsp.achromogenes、杀日本鲑亚种A.salmonicidasubsp.masoucida(ASM)、史氏亚种A.salmonicidasubsp.smithia和溶果胶亚种A.salmonicidasubsp.pectinolytica[1],其中杀鲑亚种能引起冷水鱼的“疖疮病”,发病率和死亡率高,其他亚种致病力相对较弱,但是具有更广泛的宿主范围,能感染鲤鱼、河鲈、六线鱼、大菱鲆、大西洋鳕、裸盖鱼等多种重要养殖鱼类[2,3],并且可与其他气单胞菌属混合感染,对我国鱼类养殖业造成严重的经济损失,并对我国冷水鱼类养殖业的健康可持续发展造成重大的潜在威胁,因此有关该病的防治技术研究亟待开展。在养殖鱼类病害防控方面,以疫苗免疫技术为基础的综合防控技术体系是目前被国际上认可、接受并积极推广的病害防治技术[4],挪威、美国等发达国家均有商品化的杀鲑气单胞菌疫苗,该疫苗的使用大大降低了抗生素的使用,并有效控制疾病的发生[5]。目前,我国杀鲑气单胞菌疫苗的研制大多仍处于实验室研究阶段,而且主要以福尔马林灭活的灭活疫苗为主[6],虽然能使鱼体获得一定的免疫保护力,但在安全性方面存在一定的隐患,随着对该菌病原特性和致病机理的深入研究以及蛋白体外重组表达技术的成熟,研发安全高效的亚单位疫苗也越来越受到重视和推进。
生物信息学技术的不断发展,使基于反向疫苗学开发杀鲑气单胞菌基因工程亚单位疫苗具备了理论基础和技术手段[7],迄今已有多株杀鲑气单胞菌的全基因组被系统解析,并对其重要的毒力相关基因与蛋白进行了生物信息学预测[8-10],通过对重要候选靶标蛋白进行原核重组表达和免疫保护性试验,筛选到多个具有较高免疫保护率的亚单位候选蛋白,其中溶血素型钙结合区蛋白表现出较高的潜在开发价值[11]。本课题组前期也针对多个杀鲑气单胞菌外膜蛋白研究筛选具有免疫保护效果的亚单位候选蛋白,结果显示重组外膜蛋白C可以有效诱导鱼体产生特异免疫应答,并提供最佳的免疫保护效果[12]。因而,基于反向疫苗学研究筛选杀鲑气单胞菌亚单位疫苗切实可行。
溶血素(Hemolysin)是一类具有溶血活性的蛋白质,是气单胞菌重要的毒力因子,而菌毛(Pilin)在细菌的侵染和定植过程中也发挥重要作用。因此,本研究拟利用体外重组表达技术,对杀鲑气单胞菌两个潜在毒力相关蛋白溶血素和菌毛蛋白进行重组表达,以虹鳟为研究对象检测其免疫保护效果,并分析其对虹鳟免疫应答的诱导作用,以期为鱼类细菌亚单位疫苗的研究提供重要参考。
1 材料与方法
1.1 材料
1.1.1 菌株及试验动物
致病性杀鲑气单胞菌杀日本鲑亚种Aeromonassalmonicidasubsp.masoucida由山东省海水养殖病害防治重点实验室从患病虹鳟中分离保存[13];健康虹鳟购自潍坊某养殖场,体长(13±2) cm,体质量为(60±5)g,实验前循环水暂养15 d,养殖水温为(17±1)℃。
1.1.2 试剂和耗材
重组表达试剂盒pDE2 Directional Expression Kit Ver.2购自北京擎科生物科技有限公司;DNA提取试剂盒MiniBEST Bacteria Genomic DNA Extraction Kit Ver.3.0、RNA提取试剂盒MiniBEST Universal RNA Extraction Kit、反转录试剂盒High Capacity cDNA Reverse Transcription Kit、cDNA合成试剂盒High Capacity cDNA Reverse Transcription Kit及荧光定量PCR试剂SYBRⒸ Premix Ex Taq Mix均购于TaKaRa公司;碱性磷酸酶标记的羊抗鼠IgG和PVDF膜购自德国Merk Millipore;虹鳟抗灭活A.salmonicida血清由本实验室制备;鼠抗虹鳟IgM单克隆抗体购自Aquatic Diagnostics;异丙基-β-D-硫代吡喃半乳糖苷购自南京建成生物工程研究所;SDS-PAGE等其它试剂购自上海生工生物工程有限公司。
1.2 方法
1.2.1 溶血素和菌毛蛋白的原核重组表达与纯化
采用试剂盒TaKaRa MiniBEST Bacteria Genomic DNA Extraction Kit方法提取杀鲑气单胞菌总DNA,以此为模板,依据Genbank库中杀鲑气单胞菌溶血素及菌毛的基因序列,设计特异性扩增引物(表1),对目的基因扩增并进行测序。序列验证无误后将2种蛋白基因扩增产物切胶回收进行纯化,利用pDE2 Directional Expression Kit分别构建pET28-hly及pET28-Pln表达载体,并将表达载体转化至感受态细胞(DH5α),于不含卡纳霉素的LB液体培养基中复苏并转接于LB平板培养,挑取单菌落进行T7和T7ter双向测序比对序列,将序列正确的重组载体转化感受态大肠杆菌E.coli细胞(BL21,DE3),涂布含卡那霉素的平板培养过夜。挑取单菌落进行菌落PCR并对阳性菌落进行测序确认。将经测序鉴定正确的阳性菌用异丙基-β-D-硫代吡喃半乳糖苷(IPTG)进行诱导表达,以Ni2+亲和层析柱(GE)分别纯化重组溶血素和重组菌毛蛋白,将纯化蛋白以0.01 mol/L的磷酸盐缓冲液(PBS,pH值为7.2)重悬并以Bradford法测定蛋白浓度,将浓度调整至1 mg/mL冻存备用。同时,利用SDS-PAGE分析蛋白重组表达及纯化结果。
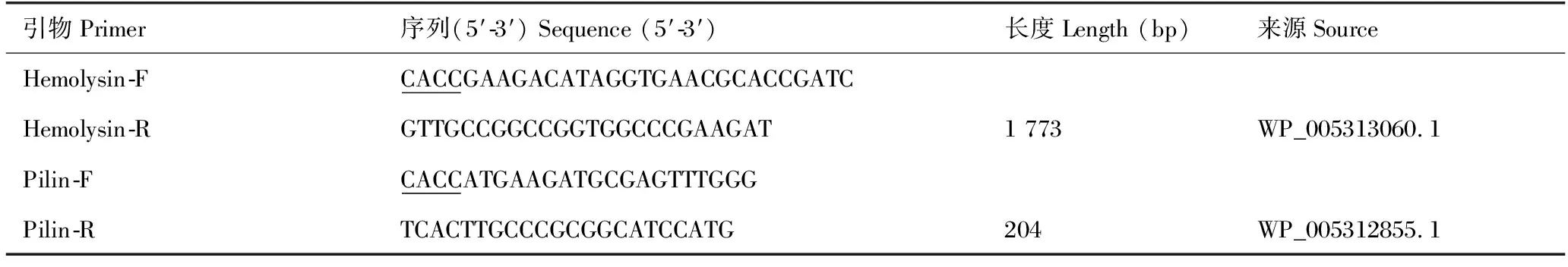
表1 溶血素及菌毛蛋白基因扩增引物信息
1.2.2 重组溶血素和重组菌毛蛋白的免疫原性测定
利用Western-blotting分析重组蛋白的免疫原性。将上述纯化后的重组溶血素和重组菌毛蛋白进行SDS-PAGE,电转移到PVDF膜,然后浸泡于含4%牛血清白蛋白的PBS溶液中,4℃封闭过夜,用PBST(含0.05%Tween-20的PBS溶液)洗涤3次后,分别用虹鳟抗灭活ASM血清和健康虹鳟血清(1∶50)于37℃孵育1 h,洗涤后加入鼠抗虹鳟IgM单克隆抗体(1∶50)于37℃孵育1 h,洗涤后加入碱性磷酸酶标记的羊抗鼠IgG (1∶5 000)于37℃孵育1 h,最后将PVDF膜置于NBT-BCIP发色液中发色,以去离子水洗涤终止反应,观察并拍照。
1.2.3 重组溶血素和重组菌毛蛋白的免疫保护效果测定
将健康虹鳟随机分为5组,每组30尾鱼,用上述纯化后的重组溶血素、重组菌毛蛋白及两者1∶1(W∶W)混合物、甲醛灭活的杀鲑气单胞菌全菌分别与弗氏完全佐剂1∶1(V∶V)混合后,免疫健康虹鳟,以注射PBS和佐剂混悬液作为阴性对照,每尾腹腔注射100 μL。免疫6周后,依据前期毒力实验结果[13],选择浓度为5×107CFU/mL杀鲑气单胞菌进行攻毒,每尾腹腔注射100 μL,连续观察21 d并记录攻毒后鱼体的死亡情况,计算免疫组的相对免疫保护率(Relative Percentage Survival,RPS)。
1.2.4 虹鳟对重组溶血素和重组菌毛蛋白的免疫应答特性
1.2.4.1 免疫、攻毒及取样
将健康虹鳟随机分为4组,每组20尾鱼,分别用上述纯化后的重组溶血素、重组菌毛蛋白及两者1∶1 (W∶W)混合物、PBS与弗氏完全佐剂等体积混合后,免疫健康虹鳟。在免疫后2,4,6周,每组每个时间点取3尾鱼制备抗血清用于特异性抗体水平检测,血清的取样方式为尾静脉取血,室温放置2 h后,转入4℃过夜,次日于4℃下3 000 g离心15 min,取上清-20℃保存备用。同时,在免疫后6周用杀鲑气单胞菌对虹鳟进行攻毒,方法同1.2.3节。攻毒后24 h,每组取样6尾鱼,用无菌剪刀剪下脾脏并切成0.5 cm小块置于RNA later中-80℃保存,用于免疫相关基因表达特性研究。
1.2.4.2 ELISA检测虹鳟外周血特异性抗体水平变化
分别将重组溶血素和重组菌毛蛋白包被于96孔酶标板中,每孔50 μg,4℃静置过夜,次日用含4%牛血清白蛋白的PBS溶液于37℃封闭1 h,PBST洗涤3次后,分别加入100 μL免疫后不同时间点收集的虹鳟血清(1∶100),37℃孵育1 h,每个样品设置3个重复,洗涤后依次加入100 μL鼠抗虹鳟IgM单克隆抗体(1∶50)和100 μL碱性磷酸酶标记的羊抗鼠IgG (1∶5 000),孵育条件均为37℃,1 h,最后加入100 μL pNPP底物发色液室温避光发色30 min,每孔加入50 μL 2 mol/L NaOH终止反应,置于酶标仪(Tecan) 405 nm处读取OD值。以PBS免疫组血清作为阴性对照,吸光值P/N>2时的待测血清最大稀释度作为各时间点血清样品的效价。
1.2.4.3 荧光定量PCR检测虹鳟脾脏免疫相关基因表达情况
利用荧光定量PCR (RT-qPCR)检测各免疫组虹鳟在杀鲑气单胞菌攻毒后24 h,脾脏中9种免疫相关基因表达情况。9种免疫相关基因白介素1β (IL-1β)、白介素6(IL-6)、白介素8(IL-8)、干扰素(TNFα)、主要组织相容复合物Ⅱα(MHC-Ⅱα)、免疫球蛋白M重链(IgM)、T淋巴细胞受体α链(TCRα)、T细胞CD4分子和CD8分子以及内参基因18S rRNA的引物信息如表2所示。利用MiniBEST Universal RNA Extraction Kit,提取虹鳟脾脏组织的总RNA,以High Capacity cDNA Reverse Transcription Kit参照说明书反转录合成cDNA第一链,qPCR反应体系为SYBRⒸ Premix Ex Taq Mix,反应在CFX96TM实时荧光定量PCR系统(Bio rad,USA)中进行,以各免疫组攻毒前脾脏样品作为参照,按照2-ΔΔCt法分析各基因在攻毒后24 h的相对表达情况。

表2 荧光定量PCR所用引物信息
1.2.5 数据分析
运用SPSS软件进行数据分析(Version 20.0,IBM),通过单因素方差分析(ANOVA)分析差异性,实验结果以平均数±标准误(Mean±SEM)表示,在所有情形中,若P<0.05,则认为存在显著性差异。
2 结果与分析
2.1 溶血素和菌毛蛋白的原核重组表达与纯化结果
将扩增获得的A.salmonicida溶血素和菌毛蛋白基因分别插入表达载体pET28,构建了pET28-hly及pET28-Pln表达载体,通过转化至E.coliBL21(DE3),最终筛选获得表达工程菌各4株,通过IPTG诱导表达,最终获得分子量分别为70,10 kDa的目的蛋白,与理论分子量大小相符。经镍离子亲和层析柱纯化后,获得了高纯度的重组溶血素和重组菌毛蛋白(图1,泳道1,2),可用于后续免疫。
2.2 重组溶血素和重组菌毛蛋白的免疫原性分析
为了验证2种重组蛋白的免疫原性,利用Western-blotting实验分析了重组溶血素和重组菌毛蛋白与虹鳟抗ASM血清的反应,结果发现制备的虹鳟抗灭活ASM血清可与两种重组蛋白发生阳性反应(图1,泳道3,4),说明这两种重组蛋白具有良好的免疫原性和反应原性,能有效诱导鱼体分泌产生特异性抗体。
2.3 重组溶血素和重组菌毛蛋白的免疫保护效果比较分析
免疫保护试验结果显示,在攻毒后4 d PBS对照组鱼体开始死亡,死亡率在两周内迅速升高,累积死亡率于16 d达到最高96%,而免疫组与对照组相比死亡率显著降低,注射重组溶血素、重组菌毛蛋白及两者1∶1 (W∶W)混合物、甲醛灭活全菌鱼体的最终累积死亡率分别为34%、60%、24%和20%,其对虹鳟的相对免疫保护率分别为64.6%、37.5%、75.0%和79.2%(图2),其中重组溶血素对虹鳟的免疫保护效果显著高于重组菌毛蛋白,将两者混合共免疫虹鳟的免疫保护效果最高。

M:蛋白质Marker;1:纯化的重组溶血素;2:纯化的重组菌毛蛋白;3:虹鳟抗灭活ASM血清与重组溶血素的反应结果;4:虹鳟抗灭活ASM血清与重组菌毛蛋白的反应结果

图2 不同免疫组对虹鳟抗杀鲑气单胞菌感染的免疫保护效果
2.4 ELISA检测免疫后特异性抗体水平变化
ELISA结果显示,与PBS对照组相比,重组溶血素和重组菌毛蛋白单独免疫组虹鳟均能有效诱导抗各自抗原的特异性抗体水平,在免疫后2周两者的特异性抗体水平均显著高于对照组(P>0.05),其水平在免疫后6周内逐渐升高;重组溶血素和重组菌毛蛋白共免疫组虹鳟血清中抗重组溶血素或重组菌毛蛋白特异性抗体水平在免疫后6周内也呈现出逐渐升高的趋势,其中抗重组菌毛蛋白抗体水平与重组菌毛蛋白单独免疫组不存在显著性差异变化,但抗重组溶血素抗体水平显著高于重组溶血素单独免疫组(图3)。

不同字母标注代表组间存在显著性差异(P<0.05)
2.5 重组溶血素和重组菌毛蛋白诱导虹鳟的免疫相关基因表达特性
荧光定量PCR检测结果显示,3个免疫组中IL-6、IL-8、TCR及CD4基因的表达水平均高于PBS对照组,其中重组溶血素与重组菌毛蛋白共免疫组中IL-6、CD4、MHC-Ⅱ及IgM基因表达水平显著高于其他免疫组,另外发现重组菌毛蛋白免疫组中IL-6和IL-8基因表达水平显著高于重组溶血素免疫组(图4)。

*代表表达水平显著高于PBS对照组(P<0.05),不同字母代表各免疫组组间表达水平存在显著性差异(P<0.05),水平基线表示将PBS对照组各基因的表达水平设定为1
3 讨论
亚单位由于其抗原组分特异单一,可诱导宿主针对关键靶标抗原产生特异性抗体,且具有安全性高、毒副作用小的优点,已成为疫苗研究重要方向之一[14]。利用生物信息学分析病原微生物的毒力相关因子,结合运用反向疫苗学技术研究筛选具有免疫保护效果的候选靶标抗原,已成为亚单位疫苗研发的重要技术途径[15,16]。目前,在该技术的应用下已针对弧菌、迟缓爱德华氏菌、链球菌、气单胞菌等水产动物重要病原菌,研究筛选到一大批具有较好免疫保护效果与开发应用价值的亚单位候选抗原[17-20]。本研究基于杀鲑气单胞菌全基因组信息,分别克隆表达了与菌体毒力相关的溶血素蛋白和菌毛蛋白,通过免疫保护性试验验证了两者的免疫保护力,其中重组溶血素蛋白表现出较高的免疫保护效果,且能诱导鱼体产生较高的特异性抗体水平。溶血素作为病原菌的重要毒力因子之一,可通过与红细胞膜表面的受体结合,使细胞膜的通透性发生改变,进而使红细胞破裂溶解,同时能够引起鱼体明显的细胞免疫和体液免疫[21,22]。与本研究相似,对斑点叉尾免疫接种重组嗜水气单胞菌溶血素蛋白也可诱导鱼体产生显著的免疫保护效果[23]。另外,利用无乳链球菌的重组溶血素蛋白免疫罗非鱼也能诱导鱼体产生70%的免疫保护率,免疫鱼体在28 d后血清抗体效价高达1∶4 096[24]。以上结果均表明,杀鲑气单胞菌溶血素蛋白具有较强的免疫原性,可诱导鱼体产生较强的体液免疫应答和免疫保护效果,是亚单位疫苗研发的重要候选抗原之一。
亚单位疫苗由于其组分单一,单独免疫往往难以取得高效的免疫效果,需要辅以一定的佐剂分子以提升其免疫保护效果[25]。菌毛作为菌体重要表面抗原,参与细菌的粘附定植,与致病力有直接的相关性[26]。本研究利用杀鲑气单胞菌重组菌毛蛋白免疫虹鳟后,能有效刺激鱼体产生体液免疫应答,说明其具有一定的免疫原性,同时也能诱导鱼体产生一定的免疫保护效果,这与前期有关嗜水气单胞菌菌毛蛋白的研究相似[27],但是对比重组溶血素来说,重组菌毛蛋白诱导的免疫保护率相对较低。本研究还发现,以重组菌毛蛋白与重组溶血素混合免疫鱼体后,可诱导鱼体产生更高水平的免疫保护效果,以及更高水平抗溶血素特异性抗体,表明重组菌毛蛋白具有一定的佐剂效应。前期研究显示,菌毛蛋白可激活Toll样受体信号通路,从而影响机体免疫应答水平[28]。本研究发现,当重组菌毛蛋白与重组溶血素共免疫时,不仅可诱导产生较高的抗体水平和免疫保护效果,IL-6、CD4、MHC-Ⅱ等多个参与炎症响应和抗原递呈的免疫相关基因表达水平也显著高于其他免疫组,结果表明共免疫菌毛蛋白可有效提升亚单位疫苗的免疫效果。但是,本研究对两种重组蛋白仅采用1∶1的比例进行混合免疫,未能进一步细化不同配比研究,以获得更佳的免疫保护效果,这方面仍有待进一步研究。
4 结论
杀鲑气单胞菌杀日本鲑亚种的重组溶血素对虹鳟具有较好的免疫保护效果,是具有亚单位疫苗开发应用前景的潜在靶标抗原。重组菌毛蛋白与重组溶血素蛋白共免疫鱼体可显著提升免疫保护效果及鱼体的免疫应答强度,提示菌毛蛋白具有开发成为佐剂分子的潜在价值。研究结果将为杀鲑气单胞菌亚单位疫苗的研究提供重要参考。