并发癫痫的多系统朗格汉斯细胞组织细胞增生症1例并文献复习
2021-08-28林丽王丽红王陶然谷翠红张志华
林丽,王丽红,王陶然,谷翠红,张志华
朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)为少见的病理性CD1a+、CD207+髓样树突状细胞异常增殖并浸润组织器官的炎症性髓系肿瘤。临床表现具有异质性。中枢神经系统受累少见,合并癫痫罕见。本文探讨治疗过程中并发癫痫的LCH 1例。
1 临床资料
患者,女,57岁,主因“间断发热1年余,腹痛、腹胀5月余”于2018年7月10日第1次就诊于我院感染科。1年前患者无明显诱因出现发热,每周发热2~3次,体温波动于38.0℃~39.0℃,伴乏力及胸闷,伴四肢关节酸痛,物理降温后体温可自行下降,未重视;5个月余前无明显诱因出现腹痛、腹胀,位于全腹部,为胀痛,进食后加重,伴皮疹,位于前胸部及腰部,为暗棕色,大小不一,无瘙痒及脱屑;就诊于外院,完善胸部及腹部CT显示多浆膜腔积液,肿瘤标记物示CA125稍升高,淋巴细胞培养+干扰素升高,IgG1、IgG2、IgG3升高,考虑不除外结核杆菌感染,患者为诊治就诊于我院。既往5年前因“无汗”于我院诊断为“垂体瘤”,后于北京三博医院行“垂体瘤微创手术”,术后症状无好转;2年前于我院复诊查垂体激素6项、电解质未见异常。23个月前于我院眼科门诊行“眼底黄瘤手术”;22个月余前因“双耳疼痛1周、加重伴流脓1 d”在我院耳鼻喉科诊断为“中耳胆脂瘤(双侧)”,行“双侧改良乳突根治、双侧中耳、乳突肿物切除、左侧外耳道成形术”,术后病理示(左侧乳突)送检为少量炎性纤维及肉芽组织伴多量嗜酸性粒细胞浸润;否认高血压病、脑血管病病史,家族史无特殊。
入院后查体,前胸部及腰部可见多发暗棕色皮疹,不凸出皮面,表面无瘙痒及脱屑,见图1;双腋下可触及肿大淋巴结,大小约2.0 cm×1.5 cm;腹部饱满,全腹压痛,移动性浊音阳性,双下肢重度水肿。

图1 患者前胸部及腰部皮疹
入院后完善辅助检查。常规检查:血常规白细胞10.08×109/L↑,血红蛋白89 g/L↓,血小板388×109/L↑,中性粒细胞84.5%↑,淋巴细胞11.5%↓,平均红细胞体积82.3 f L,平均红细胞血红蛋白量24.7 pg↓,平均血红蛋白浓度300.0 g/L↓。C反应蛋白218.0 mg/L↑。疑难血涂片:中性分叶核粒细胞85%(核右移),单核细胞4%,淋巴细胞11%。生化全项:白蛋白27.5 g/L↓,r-谷氨酰转移酶197.0 U/L↑,碱性磷酸酶609 U/L↑,肌酸激酶24.00 U/L,肌酸激酶同工酶29.00 U/L↑,尿素氮8.82 mmol/L↑,肌酐121.70µmol/L,尿酸458.40µmol/L↑。凝血7项:凝血酶原时间12.30 s,部分活化凝血酶原时间28.60 s↓,纤维蛋白原5.53 g/L↑,D-二聚体4.89µg/mL,纤维蛋白降解产物23.63µg/mL。尿便常规大致正常。N端脑钠肽前体586 pg/mL↑。乳酸2.6 mmol/L↑。血气分析:PH 7.5,PCO238.00 mmHg,PO260.00 mmHg↓,HCO3 28.60 mmol/L↑,剩余碱5.20 mmol/L↑。淋巴细胞亚群免疫分型:CD3+T细胞占淋巴细胞86.75%↑,CD19+B细胞占淋巴细胞6.32%,CD3+CD4+T细胞占淋巴细胞71.89%↑,CD3+CD8+T细胞占淋巴细胞13.71%,CD3-CD56+NK细胞占淋巴细胞6.08%,CD3+CD4+T细胞/CD3+CD8+T细胞为5.24%。血清铁2.75µmol/L↓。贫血5项:FA8.96 nmol/L,铁蛋白256.90 ng/mL↑,转铁蛋白878.00 mg/L↑,可溶性转铁蛋白受体0.79 mg/L,维生素B12225.90 pmol/L。
感染相关指标:血沉103 mm/h↑。降钙素原0.38 ng/mL。呼吸道病原体联合检测:阴性。结核分支杆菌DNA定量(胸水):阴性。腹水及胸水培养及鉴定:经5 d培养无菌生长。腹水常规:李瓦他实验:阴性,总蛋白定量<20 g/L,葡萄糖定量5.09 mmol/L,白细胞计数226×109/L↑,分类:淋巴细胞70%↑,单核细胞18%↑,中性粒细胞9%↓,间皮细胞3%。腹水白蛋白10.00 g/L,腹水及胸水ADA+LDH正常。胸水涂片:未找到抗酸菌。胸水常规:李瓦他实验阳性,总蛋白定量38.00 g/L↑,白细胞计数742×106/L↑,分类:淋巴细胞60%↑,单核细胞25%↑,中性粒细胞12%↓,间皮细胞3%。胸水ADA+LDH正常。肝炎筛查:均阴性。G试验及GM试验均阴性。布鲁氏菌抗体测定:阴性。血培养(2018-7-10):经5 d培养均无致病菌生长。EB病毒抗体定量:EA(D)IgG 44.2 U/mL,VCA>750.0 U/mL,EBNA IgG>600 U/mL。EB病毒DNA定量检测:阴性。结核菌干扰素释放试验:阴性,对照反应水平:2.8 pg/mL,结核特异抗原刺激水平:27.3 pg/mL,阳性对照反应水平24.6 pg/mL,结核感染T细胞检测判读:阳性。结核分枝杆菌DNA定量(胸水):阴性。
免疫相关指标:自身免疫性肝病:阴性。系统性血管炎相关抗体检测:阴性。直接抗人球蛋白试验阴性。类风湿3项:阴性。抗核抗体谱15项:阴性。免II:IgG 415.30 g/L↑,IgA 3.63 g/L,IgM 0.75 g/L,C30.848 g/L,C40.242 g/L。
肿瘤相关指标:血CEA+AFP+CA199均正常,CA125154.5 U/mL↑。胸水CEA、CA199正常,CA125925.70 U/mL↑。腹水、CEA、CA199阴性,CA125292.60 U/mL↑。
激素相关指标:性激素+垂体激素:孕酮4.55 nmol/L↑,睾酮1.02 nmol/L,雌二醇283.00 pmol/L↑,促卵泡生成激素0.81 mIU/mL↓,泌乳素815.12 ng/mL↑,促黄体生成素0.24 mIU/mL↓,生长激素0.75 ng/mL,促肾上腺皮质激素14.39 pg/mL,促甲状腺激素3.02 mIU/L。皮质醇665.30 noml/L。人附睾蛋白4:298.70 pmol/L↑。甲状腺功能3项:游离三碘甲状腺原氨酸2.58 pmol/L,游离甲状腺素7.95 pmol/L↓,促甲状腺素3.28 mIU/L。
骨髓相关指标:骨髓像:增生明显活跃,G=74.00%、E=5.5%、G/E=13.5∶1。粒、巨两系增生,红系增生减低骨髓像。小组化3项:有核红细胞糖原阴性,中性粒细胞碱性磷酸酶染色阳性率:53%,积分:55分。骨髓染色体:外铁:++,内铁:21%。骨髓活检:HE及PAS染色示骨髓增生大致正常(40%~50%),粒红比例大致正常,粒系各阶段细胞可见,以中幼及以下阶段细胞为主;红系各阶段细胞可见,以中晚幼红细胞为主,巨核细胞数量大致正常;少量淋巴细胞散在分布,未见异常组织细胞增生。网状纤维(MF-1级)。免疫组化:CD68少数+,S-100-、CD1a-、Langerin-、CD21-、CD30-、CD20少数+,CD3少数+。融合基因BRAF-V600E:阴性。基因重排:-IGH、IGK、IGH(DH-JH)、IGL、TCRβγ均阴性。流式免疫分型:成熟淋巴细胞群12.54%,髓系原始细胞群0.28%,幼稚及成熟粒细胞群76.28%,成熟单核细胞群3.92%,幼稚红细胞群2.85%,嗜酸细胞群0.20%,嗜碱细胞群0.09%。提示骨髓未受累。
影像学检查:胸部CT:考虑肺水肿,肺内炎症,双侧胸腔积液,双肺下叶膨胀不全,心包积液,部分胸椎及椎间隙高密度。全腹CT:不除外右侧囊实性结节,胆囊炎,双肾多发低密度,腹盆腔大量积液,右侧髂骨及坐骨骨质破坏。胸椎磁共振平扫:胸2椎体病变,倾向于肿瘤,双侧胸腔积液。盆腔及肾脏磁共振平扫及增强:子宫宫腔积液,宫腔内异常信号,结合超声考虑子宫内膜息肉可能;双肾轻度积水,多发骨质异常信号,考虑侵袭性病变,恶性肿瘤待除外;腹、盆腔积液,考虑侵袭性病变,恶性肿瘤待除外;腹膜增厚,提示肝脏及脾脏无受累,见图2、图3。

图2 胸腹部CT(多浆膜腔积液)
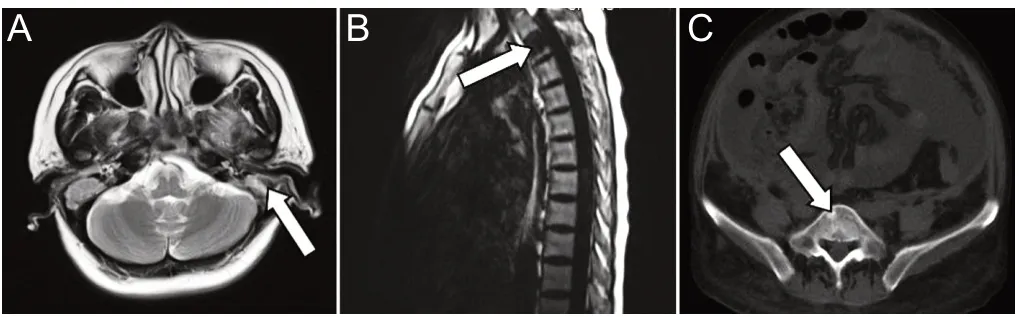
图3 头部、脊髓MRI(多发骨质破坏)
患者临床表现为发热、腹痛及腹胀,查体示前胸部及腰部可见皮疹,影像学检查可见多浆膜腔积液,多发骨质破坏。乳突病理回报:镜下所见(双侧乳突)送检组织结构破坏,可见多量组织细胞样细胞浸润,细胞偏大,核卵圆形或不规则形,部分可见核沟及核仁,染色质空亮,胞浆丰富,背景可见小淋巴细胞、嗜酸性粒细胞及浆细胞,见图4。免疫组化示:CD20灶状+,CD3-、Ki67+10%,S-100+、Langerin+、CD1a+、CyclinD1+、CK-、CD163散在+。病理诊断:(双侧乳突)朗格汉斯细胞组织细胞增生症。形态学结合免疫组织化学结果符合LCH诊断。最终诊断:多系统LCH(皮肤、骨、淋巴结)。
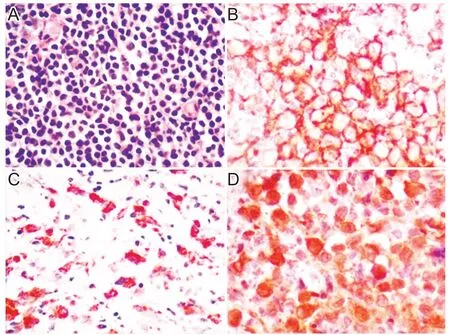
图4 组织病理结果(HE染色)
于2018-07-30予以化疗,具体方案为醋酸泼尼松片65 mg,1次/日,口服,疗程为4周,第5~6周减量;长春地辛4 mg D1、8、15、22、29、36静脉推注;甲氨蝶呤注射液800 mg D1、15、29静脉滴注。化疗第14天,患者诉腹痛及腹胀较前好转,查体示前胸部及腰部皮疹较前减少;复查胸部及腹部CT,与2018-07-29次检查比较,肺水肿好转,肺内炎症略吸收;部分胸椎及椎间隙高密度;双肾多发低密度,胆囊炎,腹盆腔积液较前减少,腹膜增厚;右侧髂骨及坐骨骨质破坏;较前相仿。化疗第36天,患者诉四肢间断不自主运动,无意识障碍,完善血糖、甲状腺功能、离子及肾功能正常。化疗第37天,患者突发意识丧失,伴双眼上吊,牙关紧闭,右上肢屈曲,右下肢伸直,完善24 h动态脑电图示睡眠期:睡眠波及睡眠周期基本完整;异常波:醒睡期双中央顶区可见散在性中高幅2.08~2.27棘慢综合波放电,可波及枕区。结论:中度异常脑电图。颅脑CT平扫未见明确异常,双耳及乳突术后改变;头颅磁共振平扫及增强未见明显异常,双侧中耳乳突改变,强化后脑内未见明确异常强化。诊断症状性癫痫,结合患者无癫痫家族史,既往无癫痫发作,可除外原发性癫痫。关于其病因,结合患者头颅CT及磁共振平扫及增强,可除外先天性异常、头颅损伤、脑血管病所致癫痫;结合患者既往无低血糖、肝病病史,甲状腺功能大致正常,可除外代谢及内分泌障碍所致癫痫;患者既往无心血管疾病及近期无特殊药物应用,可除外心血管疾病及药物所致癫痫。综上所述,诊断为LCH侵犯中枢神经系统。先后予以丙戊酸钠、地西泮及左乙拉西坦片治疗,患者仍间断癫痫发作,且出现幻觉、联想障碍及记忆力减退。于2020-09-07予以CHOP联合重组人II型肿瘤坏死因子受体抗体融合蛋白治疗,具体剂量为环磷酰胺1.0 g D1、长春地辛4 mg D1、多柔比星70 mg D1、地塞米松15 mg D1-5,重组人II型肿瘤坏死因子受体抗体融合蛋白25 mg,2次/周皮下注射。停疗第13天,患者前胸部及腰部皮疹较前增多,双侧颞部及鼻梁处可见多发软组织包块,最大位于左颞部,大小约3.0 cm×2.0 cm,腹胀较前加重,腹部CT示腹盆腔积液较前明显增多,评估疾病进展。于2018-09-29予以克拉屈滨联合阿糖胞苷治疗(克拉屈滨10 mg D1-4、阿糖胞苷1.4 g D1-4)。停疗第3天,监测患者腹围较前缩小,皮疹较前略减少,双侧颞部及鼻梁处包块较前缩小,考虑患者对上述化疗方案敏感。骨髓抑制期患者出现大肠埃希菌、屎肠球菌败血症,于2019-10-09抢救无效死亡。
2 讨论
LCH为起源于骨髓单核巨噬系统,以组织细胞异常聚集和浸润为特征的罕见克隆性疾病,由于持续的免疫刺激导致CD1α+/CD207+树突状细胞增殖失控,浸润组织和器官,导致器官功能障碍[1-3]。儿童发病率为3-5/1000000,好发于2~5岁,成人发病率为1-2/10000,以21~77岁男性多见[4]。男∶女为1.2-1.4∶1。北欧国家发病率高于亚洲和非洲[2]。
LCH患者临床表现异质性大,可表现为自发消退、慢性复发或类似于急性髓系白血病的快速进展及危及生命的多系统病变[5]。骨受累最常见(57%~75%),局部骨痛为常见表现,其他部位还包括皮肤(36.9%~39%)、淋巴结(19%)、肝脏(16%)、脾脏(13%)、口腔粘膜(13%)、肺(10%~14%)、中枢神经系统(5%)等。中枢神经系统被侵犯时的临床表现取决于受累的部位及类型,常见中枢性尿崩症(25%~50%)、生长激素缺乏(10%)、神经退行性变(1%~3%)等,脑膜和脉络丛受累罕见,上述部位受累可导致头痛、癫痫和其他局灶性症状[6,7]。
LCH缺乏特征性的病因、临床及影像学检查,诊断主要取决于组织病理切片发现异常LCH细胞。LCH细胞胞体呈圆形或卵圆形,细胞核不规则,有核沟,呈沟槽状、卷曲状或分叶状,核膜薄;染色质细,呈线性凝聚;核仁不清楚,核分裂像少见,这些细胞与T细胞、巨噬细胞、嗜酸性粒细胞、中性粒细胞、B细胞、浆细胞及多核巨细胞一起组成LCH微环境[1,8];特征性免疫组化标记为S-100+,Langerin+,CD1α+。本例患者为57岁中年女性,存在骨、皮肤及淋巴结多系统受累表现。外送乳突病理可见多量组织细胞样细胞浸润,免疫组化证实为朗格汉斯细胞,诊断多系统LCH明确。
有文献报道诊断时存在颌面部(如眼眶、乳突、颞骨、蝶骨)受累或危险器官(如骨髓、肝脏及脾脏)受累的患者中枢神经系统发病率明显增加[9]。本例患者为57岁中年女性,为LCH好发年龄,存在乳突、眼眶受累,为中枢神经系统侵犯高危人群。LCH中枢神经系统的发病机制有文献报道为LCH细胞通过血液、淋巴、邻近骨病变直接侵犯所致。关于血液途径,研究发现,大脑中涉及LCH的区域不是随机分布的,而是在解剖学上定位在靠近CVO(circumventricular organs)的区域。虽然CVO只允许小分子进入大脑,但是在某些情况下,免疫细胞也可通过CVO进入大脑。关于淋巴途径,有研究发现,大脑的淋巴系统以功能性脑膜淋巴管的形式排列在硬脑膜窦上,并与颈深淋巴结相连接,使得LCH细胞通过淋巴循环进入中枢神经系统。病理上表现为CD1a+阳性细胞及CD8+反应性淋巴细胞浸润,浸润的T细胞与激活的小胶质细胞相互作用,致使促炎细胞因子、活性氧中间体、蛋白酶和补体蛋白释放增加,导致神经元及轴突变性、消失,脱髓鞘,胶质增生[10]。有文献报道,CVO<2 mm时头颅磁共振无异常表现[7]。本例患者在治疗过程中出现癫痫发作,并出现幻觉、联想障碍及记忆力减退,头颅磁共振平扫及增强无异常影像学表现,除外其他原因,诊断为LCH侵犯中枢神经系统。关于其可能机制,一方面为乳突病变直接侵犯,另一方面为LCH细胞通过CVO进入中枢神经系统。
由于少见,目前还没有成人LCH的标准治疗方案,且无前瞻性临床实验。治疗原则取决于受累器官及严重程度[11-14]。
MS-LCH治疗:治疗原则为既要提高生存率,又要预防晚期尿崩症和其他晚期并发症。针对该类型,推荐全身治疗。长春新碱联合泼尼松的方案为标准治疗方案,但有文献报道,该方案的有效率为50%。对于合并中枢神经系统病变、原发难治、复发患者,毒性和后遗症成为次要考虑因素,多篇文献报道克拉屈滨联合阿糖胞苷的方案为二线标准治疗方案,该方案在儿童患者中2疗程的总有效率为92%,5年总缓解率为85%[15],对于成人患者,有研究表现,该方案的ORR率为92%,5年OS为85%[16]。
针对本例患者,经过标准的长春新碱及泼尼松治疗,病情无好转,且出现症状性癫痫,除外其他原因,评估为LCH中枢神经系统侵犯,后予以CHOP联合重组人II型肿瘤坏死因子受体抗体融合蛋白治疗,患者仍间断癫痫发作,且双侧颞部及鼻梁处包块无缩小。结合文献报道,加用挽救治疗方案,即克拉屈滨联合阿糖胞苷治疗,化疗第3天,患者双侧颞部及鼻梁部包块明显缩小,治疗有效。但该患者最终死于感染。
有文献报道,LCH的误诊率高达72.7%,临床上应重视LCH合并不典型中枢神经系统表现时的诊治,做到早识别、早诊断,尽早进行高强度化疗,但应用该方案时需谨慎。
