结合珠蛋白基因型预测动脉瘤性蛛网膜下腔出血患者脑血管痉挛和临床预后可行性分析
2021-08-28郭江
郭江
脑血管痉挛(cerebral vasospasm,CV)是动脉瘤性蛛网膜下腔出血(aneurysmal subarachnoid hemorrhage,aSAH)常见的并发症之一,是一种特殊类型的脑动脉收缩。目前学界将CV定义为aSAH后脑内大动脉出现的延迟性狭窄,常常伴有受累血管远端分布区灌注减少,这种持续性血管收缩会导致迟发型脑梗死(delayed cerebral ischemia,DCI),是aSAH预后不良的重要原因[1]。学界提出许多假设去解释aSAH相关性CV,其中血红蛋白(Hb)降解产物刺激导致血管痉挛的目前认可度最高[2,3]。结合珠蛋白(haptoglobin,Hp),又称触珠蛋白,是急性期绑定游离Hb的一种酸性糖蛋白,在出血或溶血性损伤后结合并中和细胞外的游离Hb,形成Hp-Hb复合物,避免Hb的病理刺激,具有极其重要的生理意义[4]。Leclerc等[5]发现不同基因型的Hp与CV的发生率有明显相关性,但该研究样本量偏小,结果可信度较低。为进一步探索Hp基因型与CV的相关性,本研究纳入部分aSAH患者进行对比分析,现报告如下。
1 资料与方法
1.1 一般资料
选择2012年1月~2015年12月在寿光市人民医院就诊的aSAH患者。入选标准:①年龄18~65周岁,性别不限;②经脑数字减影血管造影(DSA)、CT血管成像(CTA)或磁共振血管成像(MRA)明确aSAH临床诊断[6];③aSAH首次发作,且病程不超过3 d;④入院时头颅CT未发现急性脑积水或直径超过2 cm的脑内血肿。排除标准:①既往脑卒中、脑外伤、癫痫、脑肿瘤、偏头痛等神经疾病史;②出现意识模糊、谵妄等神经系统功能障碍;③出现与脑血管造影相关并发症;④合并溶血状态、明显的肝肾功能不全、自身免疫性疾病、恶性肿瘤、血红蛋白<80 mg/L等。
1.2 检测指标
①血浆Hp基因型测定:抗凝血离心后去除上层血浆,生理盐水洗涤红细胞6次后加入蒸馏水剧烈震荡5~6 min,高速离心即可分离出Hb溶液,取Hb溶液5μL与分离出的含Hp的上层血浆混合后37℃温育静置10 min即可形成Hp-Hb复合物;蛋白电泳采用EPS-300稳压稳流电泳仪(上海天能科技有限公司生产),由于在血浆中的蛋白构型不同,Hp-Hb复合物在电泳时可形成不同的条带,形成的复合物有氧化特性,当遇到四甲基联苯胺时显示蓝色条带:Hp1-1型:迁移速度最快,紧靠阳极侧;Hp2-2型:由数条谱带组成,迁移速度最慢;Hp2-1型:靠近阴极侧呈逐渐递减趋势。采用序列特异性引物聚合酶链反应(PCR-SSP)进行HP基因分型检测。②一般情况:收集3组Hp-Hb复合物基因型患者年龄、性别、既往史等人口学资料,同时记录动脉瘤最大直径(mm)、格拉斯哥昏迷量表(Glasgow coma scale,GCS)评分、aSAH的Fisher分级、治疗方法。③CV分级:入院3 d内DSA术后利用工作站自带测量软件,分别测量大脑前动脉、大脑中动脉、大脑后动脉发生CV的情况。分级标准为4级:无CV(直径减少0%~10%)、轻度CV(减少11%~33%)、中度CV(减少34%~66%)、重度CV(减少67%~100%)[7]。④临床预后:记录并且比较入院14 d 3组患者发生迟发型脑梗死和死亡的例数。
1.3 统计学处理
2 结果
2.1 SDS-PADE电泳检测Hp-Hb复合物基因型
241例aSAH患者血浆Hp基因型检测显示,通过SDS-PAGE电泳后,经四甲基联苯胺时显示蓝色条带:Hp1-1型36例(14.94%),为一条光亮的条带,靠近阳极;Hp2-1型128例(53.11%),数条蓝色条带,向阴极条带逐渐变暗;Hp2-2型77例(31.95%),数条蓝色条带,靠近阴极,见图1。分布比例与国内外研究基本相同[5]。
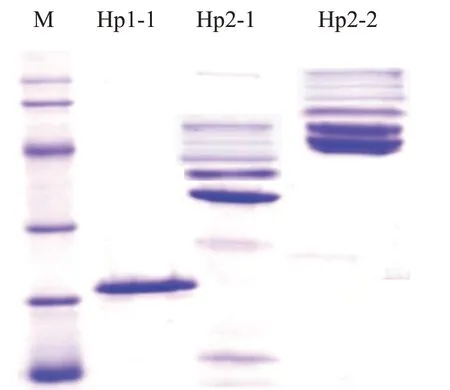
图1 SDS-PADE电泳检测3组Hp-Hb复合物基因型
2.2 3组Hp-Hb复合物基因型患者一般情况比较
3组患者年龄、性别、既往史、动脉瘤最大直径、GCS评分、Fisher分级和治疗方法组间比较差异均无统计学意义(均P>0.05),见表1。
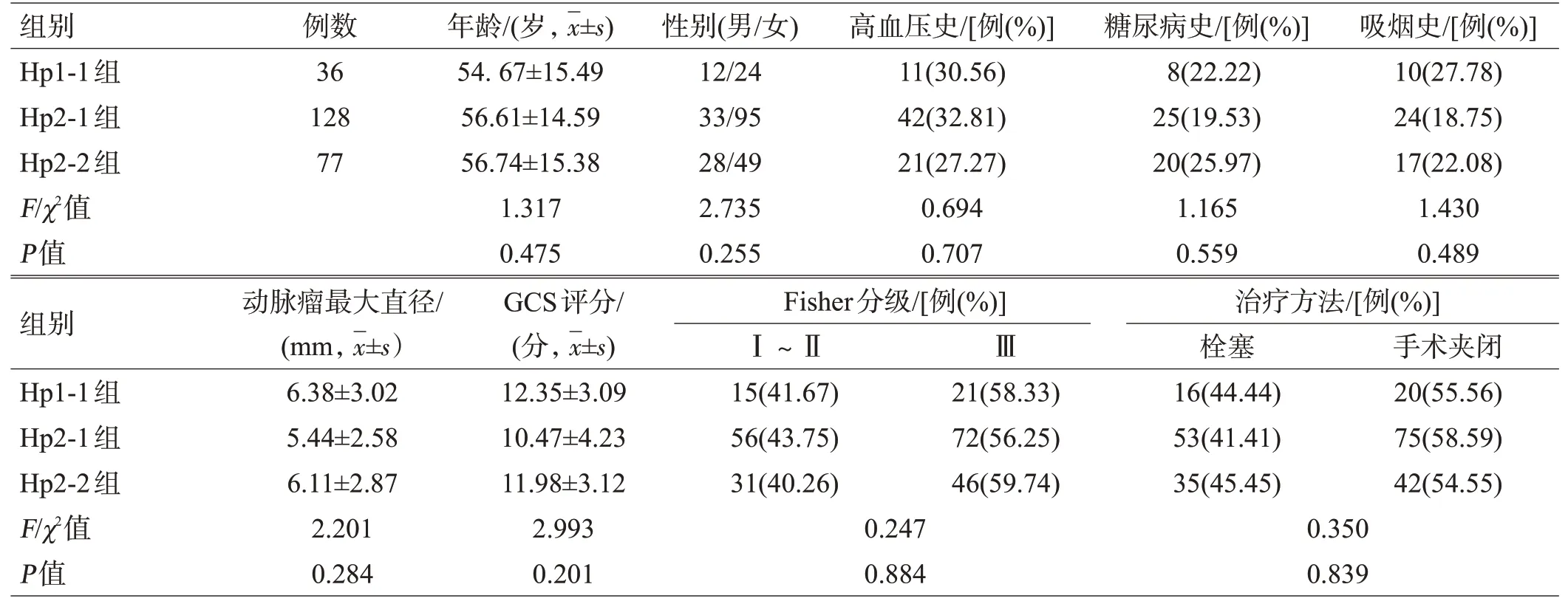
表1 3组Hp-Hb复合物基因型患者一般情况比较
2.3 3组Hp-Hb复合物基因型患者CV及临床预后比较
Hp2-2组CV总数、中度和重度CV数量均高于Hp1-1组和Hp2-1组(均P<0.05),而轻度CV组间比较差异无统计学意义(P>0.05);共74例和36例患者发生迟发型脑梗死和死亡,分割卡方检验表明Hp2-2组两者发生率均高于Hp1-1组和Hp2-1组(均P<0.05),见表2。
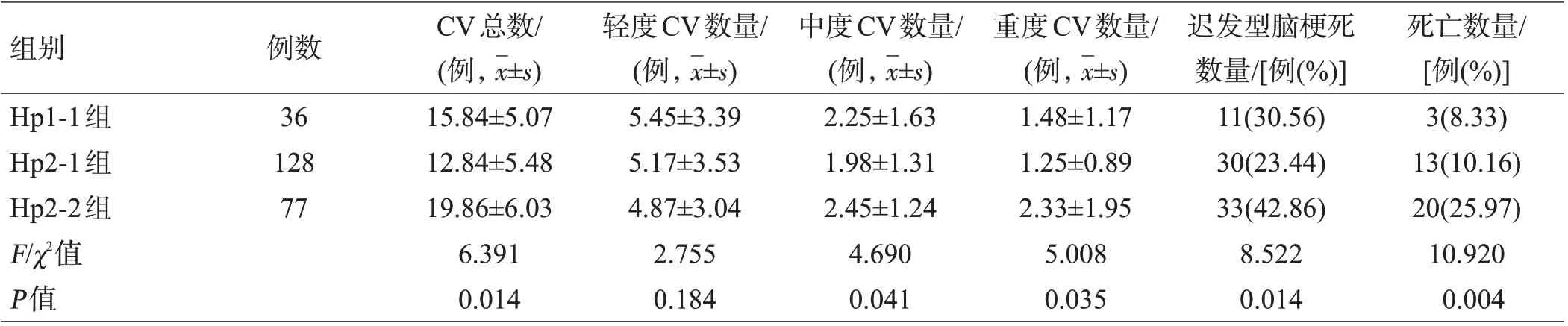
表2 3组Hp-Hb复合物基因型患者CV及临床预后比较
将Hp1-1/Hp2-1合并为一组,Hp2-2组CV总数、中度和重度CV数量同样高于Hp1-1/Hp2-1联合组(均P<0.05),而轻度CV组间比较差异无统计学意义(P>0.05);迟发型脑梗死和死亡发生率组间比较差异均无统计学意义(均P>0.05),见表3。
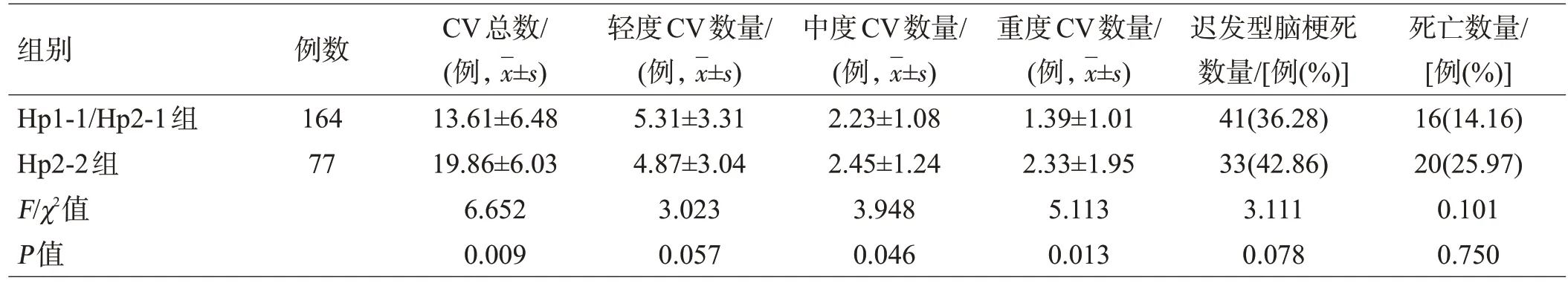
表3 Hp1-1/Hp2-1联合组与Hp2-2组患者CV及临床预后比较
3 讨论
aSAH后出现CV的危害极大,国内外大量研究表明早期发现CV高危患者并予以积极干预,可以减少CV的发生,减轻远期神经功能障碍,改善临床预后[8]。CV已知的病理机制包括炎症机制、内皮因子、氧合Hb、NO、蛋白激酶、通道活性改变、血管壁结构功能改变、白细胞介素(IL)及血管周围神经的损伤等。目前对aSAH的研究侧重于CV的预测和早期干预,已有的研究发现aSAH患者出血量为CV的重要危险因素,其他因素包括患者的年龄和既往吸烟史,年轻患者和吸烟者均较易出现CV,同时aSAH发生次数也可能与CV相关[9]。Froehler等[4]认为蛛网膜下腔的血液和红细胞崩解产物——Hb是CV发生的始动因子,可能与游离Hb直接引起血管壁炎症反应、血管平滑肌氧化性损伤、产生自由基及细胞膜脂质过氧化、NO生成减少及IL的增加有关。近年来,国内外的学者已经开始注意到Hp不同基因型可能与CV的发生率和严重程度呈正相关[5,10],但确切的联系还有很多因素值得探讨。
Hp广泛分布于人类和哺乳动物的血浆及其他体液,分子结构类似免疫球蛋白,是由两条β链和两条α链组成四聚体,Hp的多态性是α链的遗传变异造成而且是人类独有的特征。α链有α 1和α2二种,分别由一对等位基因Hp1和Hp2编码,因此有三种基本基因型:Hp1-1型为Hp1/Hp1,Hp2-1型为Hp2/Hp1,Hp2-2型为Hp2/Hp2[11],其基因多态性与感染性疾病、动脉粥样硬化、自身免疫性疾病等炎症性疾病的发生及发展有关。有研究证实,不同基因型的Hp生物学功能不同,多数研究认为Hp1-1型在结合游离Hb的功能方面是最强的,Hp2-1型次之,而Hp2-2型最弱,Hb与Hp一旦结合即可迅速从血液中被清除,而游离Hb一旦被氧化,就不能再与Hp结合。另一方面,分子量大的Hp2-2-Hb复合体比分子量小的Hp1-1-Hb复合体或游离Hb更不易于通过细胞膜,因此更难被单核-巨噬系统清除[12]。Nonaka等[13]根据该理论对SAH患者蛛网膜下腔注入Hp,表现出一定的抗CV效果。
本研究的数据进一步表明,Hp2-2型患者的CV发生率、严重程度和临床预后均高于Hp1-1型和Hp2-1型,与既往研究结果相近。但也有研究认为SAH后迟发型CV只与血浆Hp水平有关,而与Hp的基因型无明显关联,因为每一个Hp单体可以结合一个Hb二聚体,而血浆Hp和Hb分别1 mg/mL和12 mg/mL(即Hp的水平远低于Hb,而且血浆Hp水平较高者其脑脊液中Hp也较高),蛛网膜下腔中Hp不足以中和Hb时,Hp可随脑脊液不断进入蛛网膜下腔结合Hb,因此学者认为Hp水平在其中发挥了一定的作用[14],Hp与CV的确切关系仍需要大量的基础和临床研究证实。
综上所述,Hp2-2基因型是aSAH患者发生CV的高危因素,对指导早期治疗和预测临床预后有重要意义。
