肢体脂肪肉瘤组织中沉默信息调节因子2相关酶1的表达及其与预后的关系*
2021-08-27徐凤周吴宏增刘永强张进明何红艳
徐凤周,吴宏增,刘永强,张进明,何红艳
(1.石家庄市人民医院,河北 石家庄050000;2.河北医科大学第四医院,河北 石家庄050011)
软组织肉瘤(soft tissue sarcoma,STS)属于恶性肿瘤,占成人实性恶性肿瘤的1%[1]。而脂肪肉瘤是最常见的STS 之一,亦可见于儿童和青少年。脂肪肉瘤主要起源于原始间充质细胞,占恶性软组织肿瘤的16%~18%[2],好发于深部软组织,通常见于肢体和腹膜后等位置,其中肢体脂肪肉瘤约占肢体STS 的24%。手术根治性切除是目前肢体脂肪肉瘤最有效的治疗手段,但由于缺乏有效的术后辅助治疗,肢体脂肪肉瘤的长期疗效欠佳。不断复发和多次手术不仅使患者身心承受着极大的痛苦,同时也给患者家庭和社会带来沉重的经济负担[3]。因此加强对肢体脂肪肉瘤的临床和基础研究,积极寻找新的治疗靶点具有重要意义。沉默信息调节因子2 相关酶1(silencing information regulator 2-associated enzyme 1,SIRT1)是一种组蛋白去乙酰化酶,可通过对组蛋白去乙酰化修饰,实现调控细胞生长、分化与新陈代谢等生物学功能[4-6]。既往研究表明[7-9],SIRT1 在多数恶性肿瘤组织中均有异常表达,且与肿瘤恶性程度相关。SIRT1 既有癌基因作用,又有抑癌基因作用,对癌基因与抑癌基因平衡关系起着重要调控作用。目前随着医学界对SIRT1研究的不断深入,SIRT1 可能作为治疗恶性肿瘤的靶点逐渐受到临床重视。本研究通过分析SIRT1 在肢体脂肪肉瘤组织中的表达及其对患者预后的影响,为肢体脂肪肉瘤的临床诊治及预后评估提供指导依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2012年1月—2019年1月于河北医科大学附属第四医院择期行手术治疗的肢体脂肪肉瘤的患者资料,并随访预后。纳入标准:①术前未接受新辅助放、化疗;②经手术病理检查确诊为原发性肢体脂肪肉瘤;③未合并其他恶性肿瘤或严重伴发疾病;④手术切缘均为阴性。排除标准:①临床病历资料不完整;②围手术期死亡。最终67 例肢体脂肪肉瘤患者纳入本研究。其中,男性37 例,女性30例;年龄38~80 岁,平均(54.6±9.4)岁;肿瘤最大径线3~25 cm,平均最大径线(12.7±6.1)cm;11 例有肺转移。同时选取同期30 例正常肢体脂肪瘤组织作对照,纳入者经术后病理学检查确诊为肢体脂肪瘤。本研究经医院医学伦理委员会批准,患者及家属术前自愿签署知情同意书。
1.2 主要试剂
一抗鼠抗人SIRT1 单克隆抗体购自美国Abcam公司(1∶500),二抗兔抗鼠IgG 抗体购自北京碧云天生物公司(1∶1 000)。抗体外试剂购自武汉博士德生物工程有限公司。
1.3 方法
采用免疫组织化学法检测30 例正常肢体脂肪瘤组织、67 例肢体脂肪肉瘤组织及11 例肢体脂肪肉瘤肺转移组织中SIRT1 蛋白的表达,分析SIRT1蛋白表达与肢体脂肪肉瘤患者临床病理特征的关系,以及SIRT1 蛋白表达对肢体脂肪肉瘤患者生存预后的影响。
1.3.1 链菌素亲生物素-过氧化酶连接法(SP 法)①病理组织石蜡切片,68℃烘烤固片,20 min;②常规二甲苯脱蜡,梯度酒精脱水;③阻断内源性过氧化物酶:0.3%过氧化氢(H2O2),37℃孵育10 min,磷酸盐缓冲液(PBS)冲洗3 次,每次5 min;④抗原修复:置于枸橼酸钠缓冲液(pH 值为6.0)修复;⑤封闭:加1∶20 正常山羊血清,室温下封闭10 min;⑥一抗:封闭后吸去正常羊血清,不洗,直接加一抗,4℃冰箱孵育过夜;⑦PBS 冲洗3 次,5 min/次;⑧二抗:37℃,30 min,PBS 冲洗3 次,5 min/次;⑨滴加过氧化物酶标记的链霉素卵白素工作液,37℃孵育30 min,PBS 冲洗3 次,5 min/次;⑩二氨基联苯胺(DAB)/H2O2反应染色,自来水充分冲洗后,苏木精复染,常规脱水、透明、干燥、封片,光镜下观察。
1.3.2 结果判定[10]①按照染色强度:无色计0 分,淡黄色计1 分,棕黄色计2 分,棕褐色计3 分。②按照阳性细胞数:总数<5%计0 分,5%~25%计1 分,>25%~50%计2 分,>50%计3 分。以①×②为最终得分,得分0~3 分为阴性(-),≥4 分为阳性(+)。
1.4 随访
通过电话和门诊方式进行随访,以了解患者生存情况。从手术当天至死亡或最近1 次随访的间隔为“随访时间”。从手术当天至任何因素所致死亡或最近1 次随访时间为“总生存期”。“截断”事件即患者在最近1 次随访仍然存活。随访至2019年10月31日。
1.5 统计学方法
数据分析采用SPSS 19.0 统计软件。计数资料以构成比或率表示,比较做χ2检验,进一步两两比较采用χ2分割法(检验水准α=0.014);Kaplan-Meier法绘制生存曲线,比较用Log-rank χ2检验;影响因素的分析用多因素Cox 逐步回归模型。P<0.05 为差异有统计学意义。
2 结果
2.1 随访结果
67 例肢体脂肪肉瘤患者均获得术后随访,随访时间为2~81 个月,中位随访时间为39 个月。至随访结束,67 例肢体脂肪肉瘤患者中死亡34 例,死因均为肿瘤复发。
2.2 正常肢体脂肪瘤组织、肢体脂肪肉瘤组织及肢体脂肪肉瘤肺转移组织中SIRT1 蛋白阳性表达率的比较
正常肢体脂肪瘤组织、肢体脂肪肉瘤组织及肢体脂肪肉瘤肺转移组织中SIRT1 蛋白阳性表达率比较,差异有统计学意义(P<0.05)。进一步两两比较,肢体脂肪肉瘤组织及肢体脂肪肉瘤肺转移组织中SIRT1 蛋白阳性表达率高于正常肢体脂肪瘤组织(P<0.014),肢体脂肪肉瘤肺转移组织中SIRT1 蛋白阳性表达率高于肢体脂肪肉瘤组织(P<0.014)。见表1和图1。
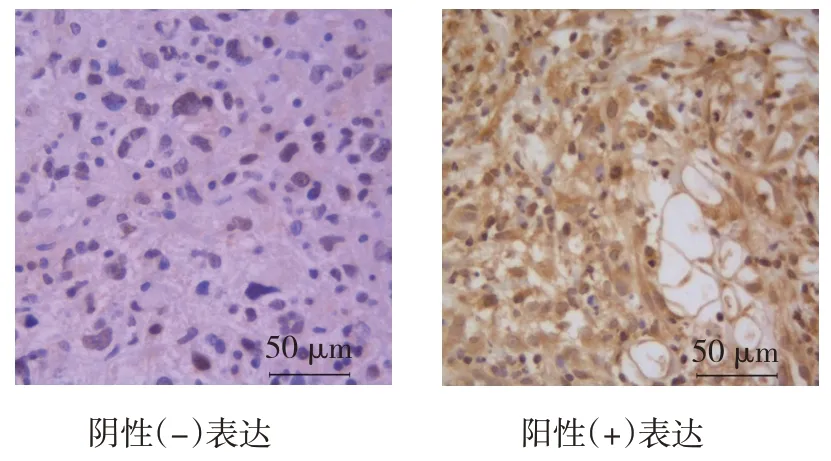
图1 SIRT1蛋白在肢体脂肪肉瘤组织中的表达

表1 正常肢体脂肪瘤组织、肢体脂肪肉瘤组织及肢体脂肪肉瘤肺转移组织中SIRT1蛋白表达阳性率的比较
2.3 不同临床病理特征肢体脂肪肉瘤患者SIRT1蛋白阳性表达率的比较
不同性别、年龄、肿瘤大小及发病部位的肢体脂肪肉瘤患者SIRT1 蛋白阳性表达率比较,差异无统计学意义(P>0.05)。不同肿瘤深度、Enneking外科分期、病理学类型及有无肺转移肢体脂肪肉瘤患者的SIRT1 蛋白阳性表达率比较,差异有统计学意义(P<0.05)。见表2。
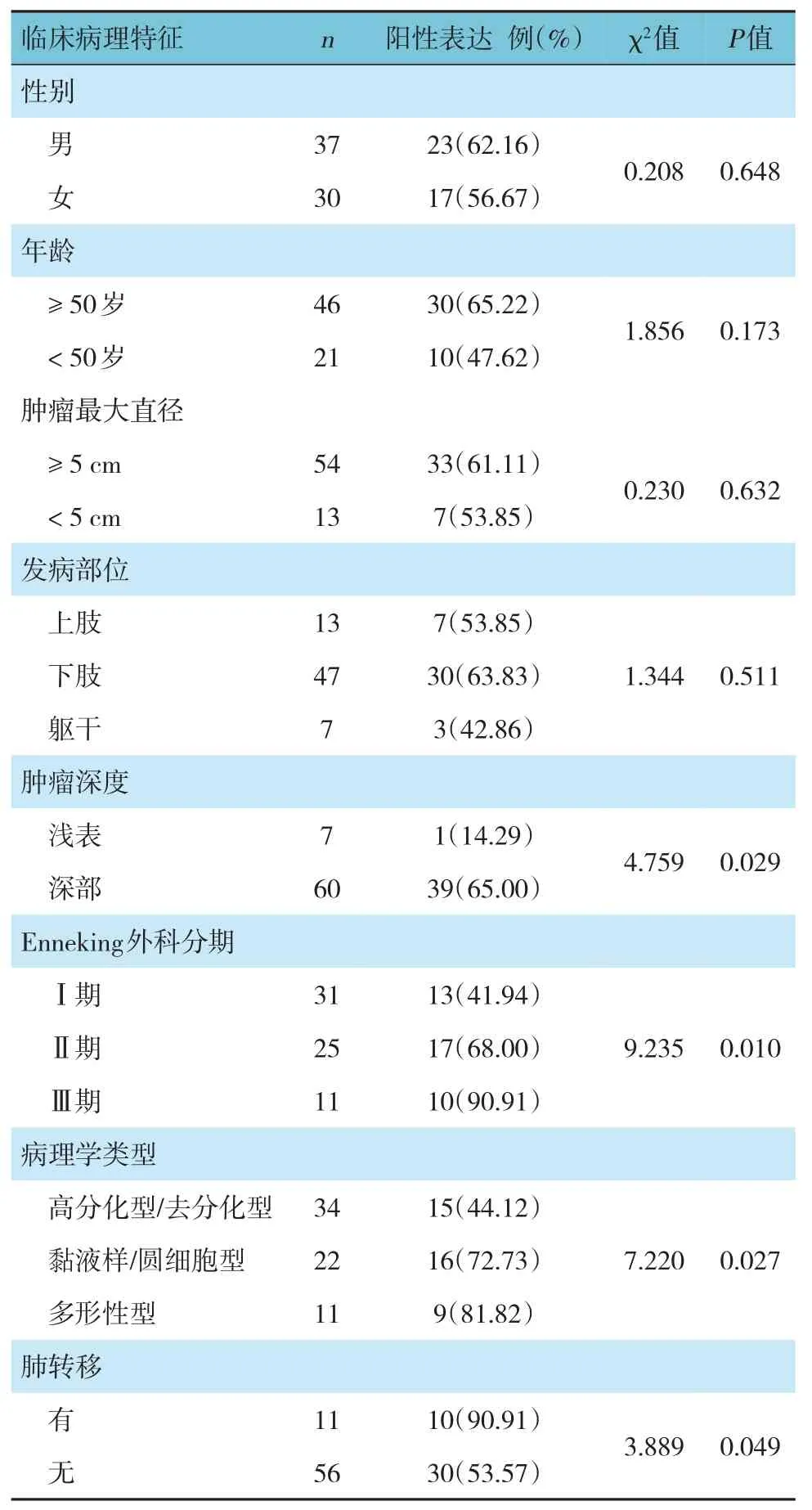
表2 不同临床病理特征肢体脂肪肉瘤患者SIRT1蛋白阳性表达率比较
2.4 SIRT1 蛋白阳性表达者和阴性表达者总体生存分析
随访期间,40 例SIRT1 蛋白阳性表达者中存活13 例,死亡27 例;最短总生存期为2 个月,最长总生存期为74 个月。27 例SIRT1 蛋白阴性表达者中存活20 例,死亡7 例;最短总生存期为5 个月,最长总生存期为81 个月。两组生存曲线比较,采用Logrank χ2检验,差异有统计学意义(χ2=15.796,P=0.000)。见图2。
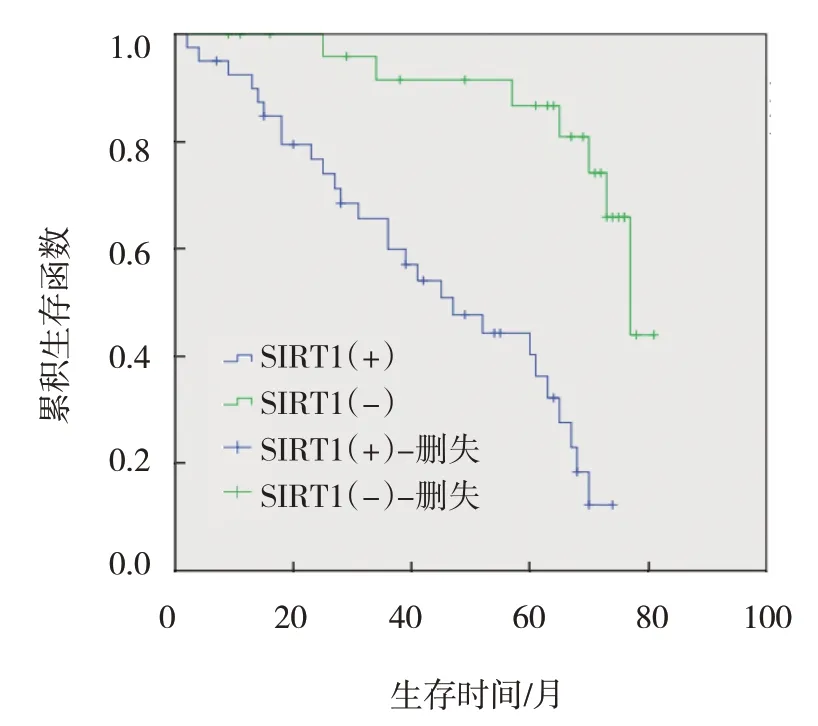
图2 SIRT1蛋白阳性表达者和阴性表达者总体生存曲线
2.5 不同临床病理特征肢体脂肪肉瘤患者1年、3年、5年生存率的比较
不同年龄、Enneking 外科分期、SIRT1 蛋白表达、病理学类型及有无肺转移患者的1年、3年、5年生存率比较,采用Log-rank χ2检验,差异有统计学意义(P<0.05);不同性别、肿瘤大小、发病部位及肿瘤深度患者的1年、3年、5年生存率比较,采用Log-rank χ2检验,差异无统计学意义(P>0.05)。见表3。
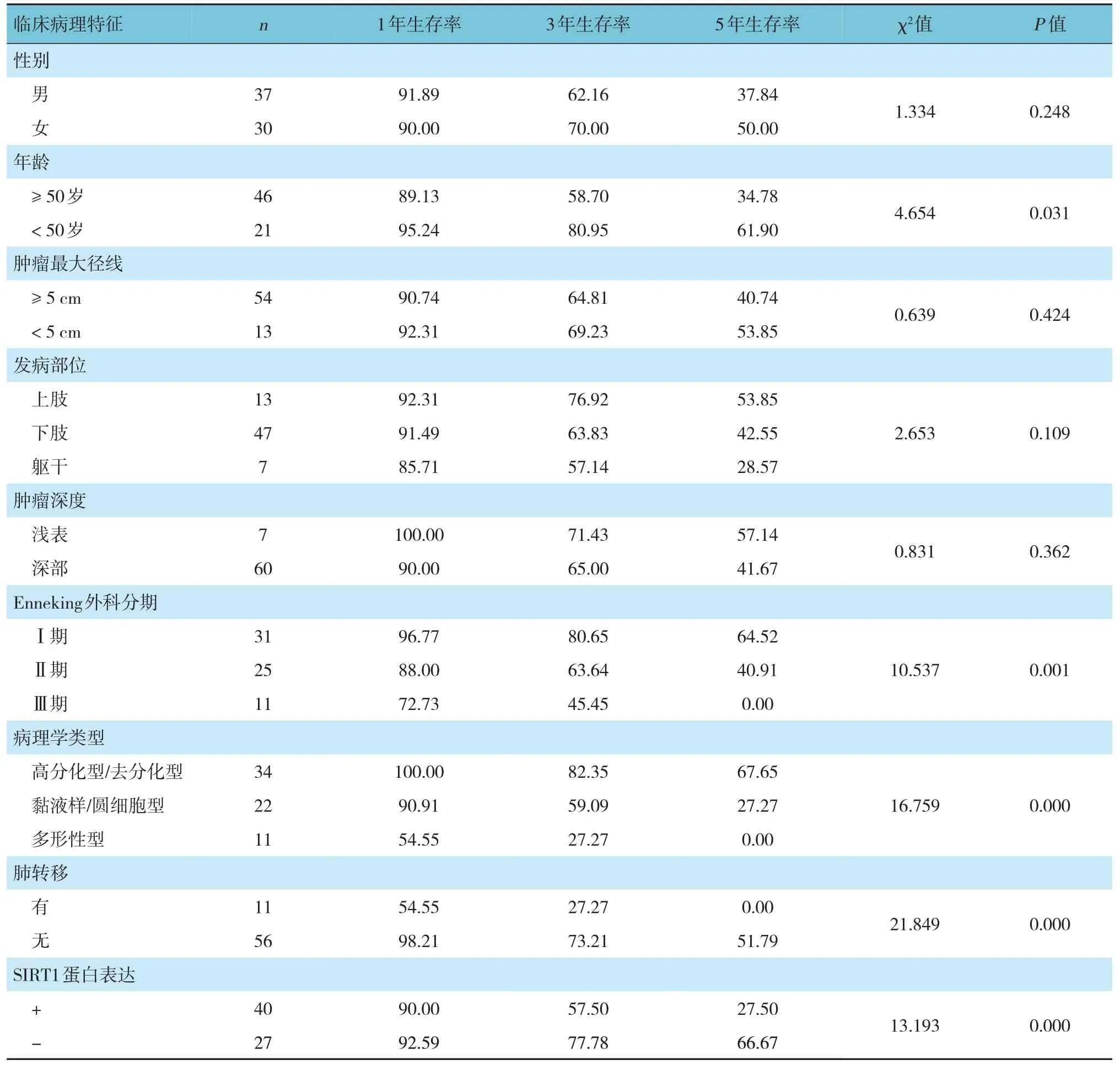
表3 不同临床病理特征肢体脂肪肉瘤患者1年、3年、5年生存率的比较(%)
2.6 肢体脂肪肉瘤患者生存预后的影响因素
将单因素分析中有统计学意义的年龄、Enneking 外科分期、SIRT1 蛋白表达、病理学类型及肺转移纳入多因素Cox 逐步回归模型,结果:年龄[=1.724(95% CI:1.180,3.075)]、Enneking 外科分期[=1.379(95% CI:1.015,2.952)]、SIRT1 蛋白表达[=1.403(95% CI:1.068,2.494)]、病理学类型[=4.620(95% CI:1.517,10.325)]及肺转移[R^R=6.641(95% CI:1.655,17.808)]是影响肢体脂肪肉瘤患者生存预后的危险因素(P<0.05)。见表4。
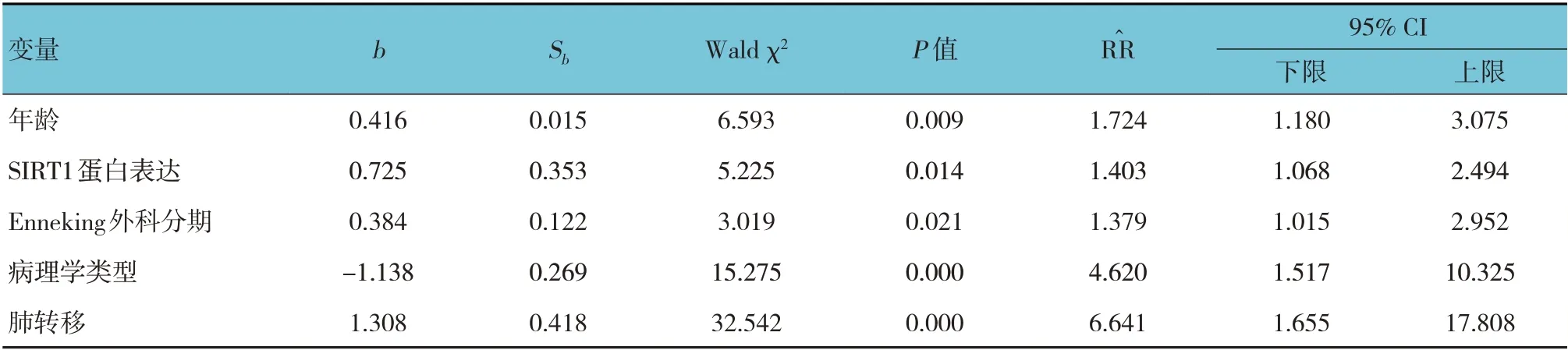
表4 影响肢体脂肪肉瘤患者生存预后的多因素Cox逐步回归分析参数
3 讨论
脂肪肉瘤是一种由异型程度和分化程度不等的脂肪细胞所组成的罕见的恶性肿瘤,具有局部侵袭性强(呈局部浸润性或破坏性生长)、可多次复发及可远处转移(血行转移至肺部是其最常见的转移方式)等特点[11-13]。该病患者一般主诉无明显诱因发现包块或肿物,本研究中67 例肢体脂肪肉瘤患者中因无痛性肿块就诊者有51 例,占76.12%。同时本研究中≥50 岁的患者有46 例,占68.66%,说明此恶性肿瘤好发于高龄人群;男性略多于女性。由于肢体是脂肪肉瘤的常见发病部位之一,故本研究以肢体脂肪肉瘤为重点,且在67 例肢体脂肪肉瘤患者中下肢发病占70.15%,与朱刚等[14]研究结果的下肢发病者占69.77%相似。另外本研究中下肢发病者主要发生于大腿部位,占85.11%;提示肢体脂肪肉瘤最常见的发病部位是大腿。世界卫生组织(WHO)软组织肿瘤分类(2002年版)中将脂肪肉瘤分为高分化型、去分化型、多形性型、黏液样/圆细胞型和混合型[15]。在本研究67 例肢体脂肪肉瘤患者中高分化型/去分化型最为常见,占50.75%,其次为黏液样/圆细胞型,占32.84%,多形性型则相对较少,占16.42%,这与既往报道[16]结果大致相同。但不管是哪种病理分型,手术治疗仍是肢体脂肪肉瘤最主要的治疗手段,且应尽量做到广泛切除,保持切缘距离>1 cm。不过多数肢体脂肪肉瘤发病部位位于深层肌肉间隙,与重要神经、血管临近,故很多情况下无法达到广泛切除的要求,加之术后尚无特效的辅助治疗方法,因此长期疗效并不理想。
SIRT1 基因定位于人类染色体10q21.3,有8 个内含子与9 个外显子,长约33 kb,编码747 个氨基酸,SIRT1 蛋白质相对分子量120 kD,细胞核是其主要分布区域。SIRT1 是第Ⅲ类组蛋白去乙酰化酶,对烟酰胺腺嘌呤二核苷酸(NAD+)具有依赖性,与组织细胞生长、衰老、凋亡以及能量代谢等有关[17-19]。SIRT1 不仅能对组蛋白进行去乙酰化修饰,还可与多种非组蛋白质进行相互作用,共同参与基因沉默、能量代谢调节、细胞衰老、抗氧化应激、脱氧核糖核酸(DNA)损伤修复等多种生理、病理过程[20-21]。SIRT1 在进行细胞自我修复与调整,增加细胞存活机会的同时,也可能会增加肿瘤细胞的存活机会,导致肿瘤细胞异常生长,使其凋亡受到抑制[22-23]。研究显示[24-25],SIRT1 在多种肿瘤细胞中的表达均有异常增加,如甲状腺癌、胃癌、胰腺癌等,SIRT1 可能起着肿瘤促进作用。东星等[26]通过研究SIRT1 蛋白在大肠癌组织中的表达得出,SIRT1 蛋白表达随着大肠癌浸润深度的加深、TNM 分期的增加及淋巴结转移而升高,且SIRT1 蛋白阳性表达者术后5年生存率低于SIRT1蛋白阴性表达者,该研究指出SIRT1 蛋白表达的增加引发了大肠癌细胞浸润与转移。可见随着对SIRT1 研究的不断深入,其在大肠癌和胃癌等多种恶性肿瘤中所扮演的角色逐渐被人们认识并争论,以SIRT1 作为靶点来治疗甲状腺癌、消化系癌症等恶性肿瘤正逐渐成为研究的热点[27]。
笔者所在省份是肿瘤高发区,近年来肢体脂肪肉瘤的发病率、诊断率逐年升高,且部分患者已出现肺转移,大部分患者需采取外科手术联合新辅助化疗的方案进行治疗,手术和化疗给患者及家属造成了巨大的痛苦和经济损失,故而针对肢体脂肪肉瘤的早期干预性治疗是医生及患者非常关注的问题。为此本研究旨在检测肢体脂肪肉瘤及肢体脂肪肉瘤肺转移病灶中SIRT1 蛋白的表达特征,并分析SIRT1 蛋白表达水平与患者临床病理特征及预后的关系,以期为笔者所在省份及全国的肢体脂肪肉瘤患者提供诊治依据。
本研究结果发现,正常肢体脂肪瘤组织、肢体脂肪肉瘤组织及肢体脂肪肉瘤肺转移组织中SIRT1 蛋白阳性表达率分别为10.00%、59.70%及90.91%,肢体脂肪肉瘤组织及肢体脂肪肉瘤肺转移组织中SIRT1 蛋白阳性表达率均高于正常肢体脂肪瘤组织,而肢体脂肪肉瘤肺转移组织中SIRT1 蛋白阳性表达率又高于肢体脂肪肉瘤组织。这提示SIRT1 蛋白的异常表达在肢体脂肪肉瘤的发生、发展及侵袭转移中发挥着重要作用。本研究比较不同临床病理特征肢体脂肪肉瘤患者SIRT1 蛋白阳性表达率发现,SIRT1 蛋白的表达与肢体脂肪肉瘤患者的性别、年龄、肿瘤大小和发病部位均无关。但SIRT1 蛋白表达强弱与肢体脂肪肉瘤患者的肿瘤深度、Enneking 外科分期、病理学类型和肺转移有关,并呈现出SIRT1 蛋白表达强者肿瘤侵袭能力和恶性程度往往较高,肺转移多见。同时本研究比较40 例SIRT1 阳性表达的肢体脂肪肉瘤患者与27 例SIRT1阴性表达者的生存情况得出,SIRT1 蛋白阳性表达者的总生存期短于SIRT1 蛋白阴性表达者,SIRT1蛋白阳性表达者的1年、3年和5年生存率低于阴性表达者。说明SIRT1 蛋白的表达强弱与肢体脂肪肉瘤患者的预后密切相关,SIRT1 阳性表达者的预后较差。本研究发现,SIRT1 阳性表达是影响肢体脂肪肉瘤患者预后的独立危险因素之一,SIRT1 蛋白阳性表达者的死亡风险是阴性表达者的1.403 倍。针对SIRT1 蛋白相关生物学行为,采取沉默SIRT1基因表达、阻断SIRT1 相关信号通路或干扰SIRT1蛋白合成的方法,可能达到抑制肢体脂肪肉瘤发生发展及侵袭转移的目的。
综上所述,SIRT1 蛋白在肢体脂肪肉瘤中高表达,其表达与肿瘤深度、Enneking 外科分期、病理学类型及肺转移有关,影响患者预后。随着肿瘤分子生物学研究的不断深入,本研究为今后肢体脂肪肉瘤患者采用以SIRT1 蛋白作为靶点的分子靶向治疗提供了一定的参考价值。
