不同类型改性粘土去除米氏凯伦藻(Karenia mikimotoi)后絮体中细菌变化特点
2021-08-27宋秀贤曹西华俞志明
丁 玉,宋秀贤,曹西华,俞志明
(1.中国科学院海洋研究所 海洋生态与环境科学重点实验室,山东 青岛 266071; 2.青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室,山东 青岛 266237; 3.中国科学院大学,北京 100049; 4.中国科学院海洋大科学研究中心,山东 青岛 266071)
赤潮是由生活在海水中的藻类大量增殖或聚集造成的一种生态异常现象[1],近年来,赤潮在我国近海海域频繁出现,对生态环境和养殖业等造成严重危害。2000年以前,我国赤潮发生次数和累计面积相对较少。自2001年起,赤潮年发生次数维持在50次以上,其中,2012年在我国东南沿海一带暴发的米氏凯伦藻(Karenia mikimotoi)赤潮对水产养殖业带来了毁灭性的打击,直接经济损失超过20亿元[2]。
作为全球性的典型海洋生态灾害之一,赤潮从多个方面威胁着人类的生命安全,有关赤潮治理方法的研究众多,但大多数方法因成本、生态效应等问题仍停留在实验室阶段[3]。而改性粘土絮凝法作为一种应急处置技术,是目前可现场大规模应用的赤潮治理方法,具有操作简便、成本节约、环境友好等优点。改性粘土除藻原理是通过改性粘土颗粒与赤潮藻细胞碰撞结合、发生絮凝,使赤潮藻细胞沉降到底层死亡,并对未絮凝的藻细胞造成损伤,从而达到有效消除和控制赤潮的目的[4]。
与赤潮藻自然消亡相比,改性粘土法作为一种重要的赤潮防控手段,可在短时间内迅速沉降大量藻细胞至底层,絮凝后藻细胞的消亡分解问题一直备受关注。藻类的消亡分解过程除了受温度、pH、营养盐浓度等因素影响外[5],通常由细菌介导[6]。目前,关于细菌在藻类分解过程中的影响和作用等已有很多报道,例如,在分解的微囊藻(Microcystisspp.)细胞周围发现有大量杆菌聚集[7]; 研究还发现在小球藻(Chlorellasp.)和中肋骨条藻(Skeletonema costatum)分解过程中异养菌优势群落从假单胞菌属-产碱菌属(Pseudomonas-Alcaligenes)转变为不动杆菌属-莫拉菌属(Acinetobacter-Moraxella)[8]。
改性粘土法的高效絮凝作用使大量藻细胞在短时间内脱离上层水体进入沉积物表面,这些沉积絮体中的藻源有机质可能部分被粘土吸附封存于底层沉积物中,部分被细菌分解后进入水体。因此,改性粘土絮凝赤潮生物过程中细菌群落的变化值得关注与研究。本文通过室内模拟实验,探究典型赤潮生物——米氏凯伦藻在不同改性粘土絮凝后,底层絮体中细菌变化差异,揭示改性粘土治理赤潮后对底层环境中细菌群落的组成及功能的影响,同时结合相关水质参数,初步探讨细菌群落变化与底层絮体中有机质(TOC)含量的关系,以期进一步完善对改性粘土生态环境效应的认识,为改性粘土治理赤潮的现场工作提供一定科学依据。
1 材料与方法
1.1 微藻培养及改性粘土制备
本研究选取我国近海典型的有毒赤潮藻——米氏凯伦藻为研究对象。藻种取自中国科学院海洋研究所海洋生态与环境科学重点实验室藻种库,在温度(20±1) ℃、光照强度 50~60 μmol/(m2·s)、光暗比12 h∶12 h条件下进行培养,后期实验培养条件相同。所有实验用具经过5%HCl浸泡24 h后,在121 ℃下高温灭菌30 min。培养实验所用的海水取自青岛胶州湾海域,经0.45 μm混合纤维膜过滤、121 ℃高温灭菌 30 min,冷却至室温后,加入无硅L1营养液[9]。
实验所使用的粘土为广西北海高岭土,所采用的改性剂分别为聚合氯化铝(PAC)和硫酸铝(AS)。聚合氯化铝改性粘土(MCⅠ)和硫酸铝改性粘土(MCⅡ)的制备方法参照文献[10-11]。本实验利用16S rDNA的方法测定改性粘土的带菌情况,多次浓缩提取 DNA后,PCR扩增均未获得目的条带,说明改性粘土自带细菌量较低; 这可能是改性粘土的制备过程(包括水洗筛选、磁选净化、高温老化等十几道工艺[4])使得材料本身的细菌含量较低,故在本文讨论中暂不考虑粘土自带细菌的影响。
1.2 实验设计
将米氏凯伦藻培养至指数生长期,混合均匀后分别置于32个1 L的容器中,藻密度约为(3.08±0.30)×107个/L。分别加入 MCⅠ和 MCⅡ,使其最终质量浓度均为 0.5 g/L,于 3 h(在图中表示为 1 d)、3 d、5 d、7 d、11 d、16 d、21 d、26 d采集样品,每组两个平行样。分层取样,首先,于液面下3 cm处移取藻液10 mL,用于当日测定藻密度,随后,通过虹吸法吸出上层液体(940 mL),取其中 40 mL用于溶解态营养盐(硝酸盐、亚硝酸盐、铵盐)的测定,样品经三氯甲烷固定后冻于-20 ℃待分析。剩余50 mL液体与底层絮体充分混匀,15 mL絮体混合液经饱和氯化汞固定后储存于-20 ℃冰箱,用于测定总有机碳(TOC)。30 mL用于测定 16S rDNA,样品于-80 ℃冰箱中储存。5 mL样品经多聚甲醛(终浓度为1%)固定后储存于-80 ℃冰箱中,用于细菌计数。
1.3 分析方法
1.3.1 细菌及藻细胞计数
将冻存的细菌样品融化处理后,利用无菌 TE(10 mmol/L Tris,1 mmol/L EDTA)缓冲液稀释100倍(逐级稀释)。通过SYBR Green I染色剂(按照体积比1∶10 000)避光染色 15 min后[12],上流式细胞仪(BD FACS Calibur,USA)进行检测[13],利用内含数量已知 Beads的绝对计数管(BD Trucount tubes,USA)确定细菌浓度,将细菌在坐标轴上圈出来完成计数[14]。藻细胞计数的样品用 Lugol试剂固定,在倒置显微镜(Olympus IX71,Japan)下进行镜检细胞计数。
1.3.2 16S rDNA
真空抽滤絮体悬浊液于 0.22 μm 的滤膜上,用OMEGA水样提取试剂盒(D5525),按照使用说明书提取总 DNA,使用 1%琼脂糖凝胶电泳检测提取DNA的质量。将检测合格的 DNA样品送至诺禾致源生物信息科技有限公司,使用16S rDNA通用引物341F(5′-CCTAYGGGRBGCASCAG-3′)和 806R(5′-GG ACTACNNGGGTATCTAAT-3′)进行目的基因扩增,基于 Ion S5TMXL技术测序平台(Thermofisher),利用单端测序(single-end)的方法,完成16S V3-V4区域测序分析。
1.3.3 其他水质参数
TOC通过总有机碳分析仪(Analytik jena Multi N/C 2100S,Germany)进行测定[15]。营养盐浓度测定的方法参照《海洋调查规范》(GB/T 12763.4—2007),铵盐采用次氯酸钠-苯酚法,硝酸盐通过 Cd还原为亚硝酸盐采用盐酸萘乙二胺法(重氮-偶氮法)[16],所有营养盐样品均用营养盐自动分析仪(Skalar San++,Netherland)测定。
1.4 数据处理
改性粘土对藻细胞的去除率计算公式如下:
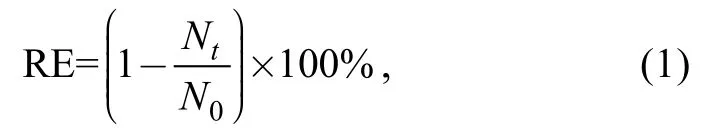
其中,RE为去除率,N0和Nt分别为添加改性粘土前和取样时间t时刻的藻细胞数量。
利用FlowJo软件(TreeStar,USA)进行细菌数量的读取和分析。使用 Qiime软件(Version 1.7.0)计算Shannon指数。采用FAPROTAX(Functional Annotation of Prokaryotic Taxa)数据库,基于16S rDNA测序所得的OTU分类表对细菌群落的功能进行注释预测[17]。使用mothur软件amova函数进行组间群落结构差异性分析。通过 LEfSe软件使用线性判别分析方法(linear discriminant analysis,LDA)进行组间差异物种筛选。运用Excel 2013和Origin 8.5对数据进行处理及绘图。
2 实验结果
2.1 改性粘土对米氏凯伦藻的去除效果
实验结果显示,质量浓度(以下简称浓度)为0.5 g/L的MCⅠ能够迅速沉降水体中约70%的藻细胞,在之后的10 d内藻细胞密度虽有一定程度的反弹,但最高密度远低于自然生长的对照组的藻密度(约 8×107个/L) (图1)。加入 0.5 g/L 的 MCⅡ后,对米氏凯伦藻去除率将近100%,且随时间推移并未出现再次增殖的现象。由此可见,同样用量、不同类型改性粘土对同一种赤潮生物的去除率有较大差异,该结果与以往研究结果类似[18]。
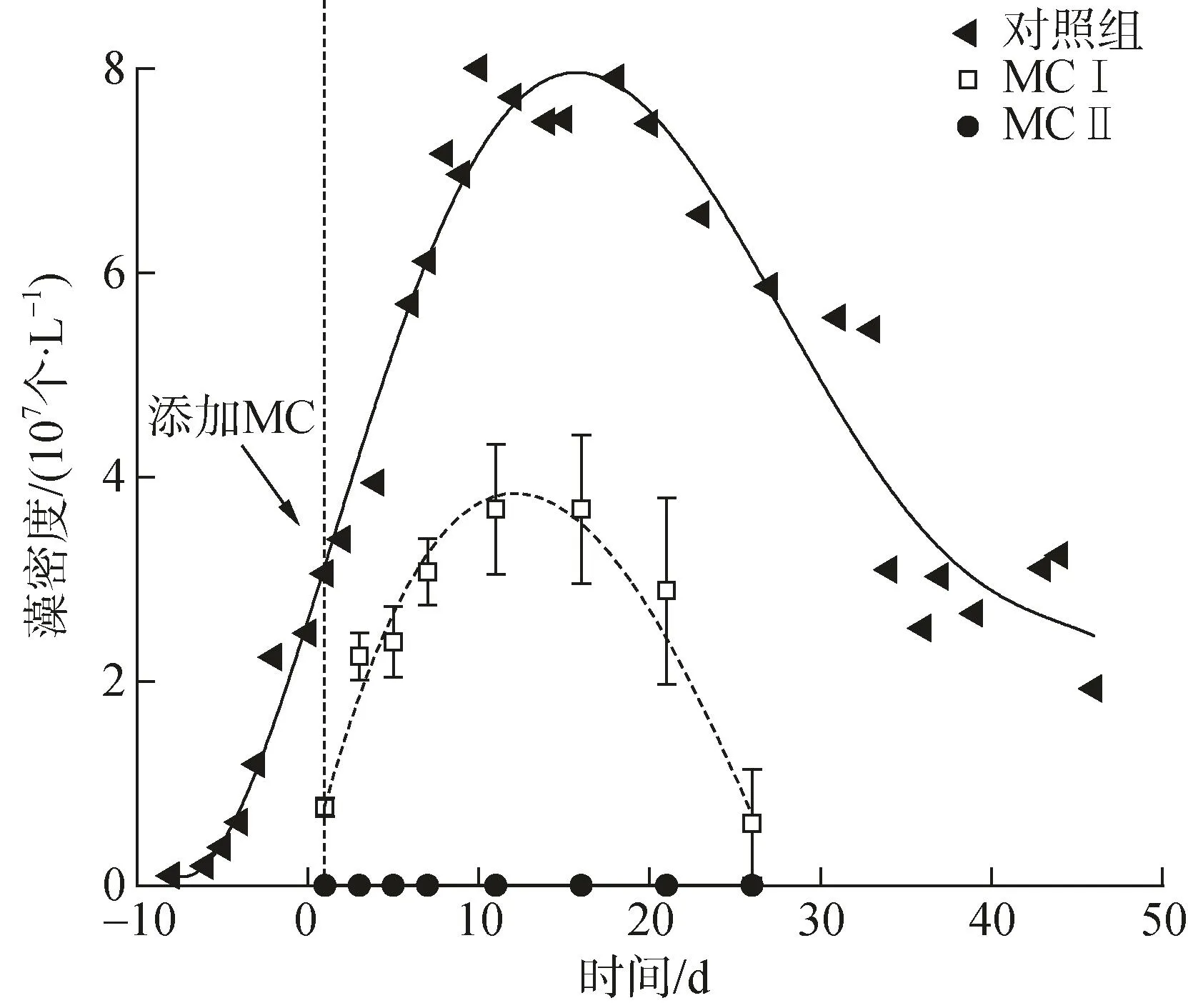
图1 不同处理组中米氏凯伦藻密度随时间的变化情况Fig.1 Variation of K.mikimotoi density under contrasting systems
2.2 细菌密度、群落组成与功能预测
2.2.1 细菌密度
流式细胞仪测定结果表明,添加0.5 g/L的MCⅠ3 h后,絮体中细菌密度为(3.02±0.26)×1010个/L,此后持续增长至第 26 d (7.52±0.30)×1011个/L; 经 0.5 g/L的MCⅡ处理3 h后,絮体中细菌密度为(7.51±1.28)×1010个/L,而后增长至第 26 d(5.18±0.30)×1011个/L(图2)。
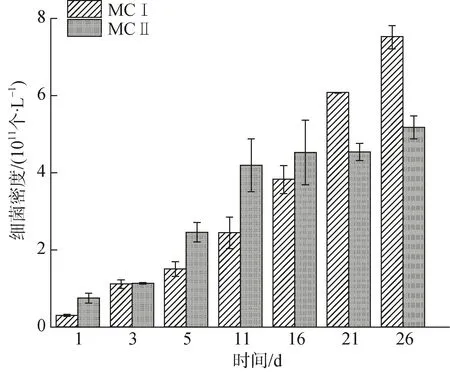
图2 两种类型絮体中细菌密度随时间变化情况Fig.2 Variation of the bacterial density of flocs treated with two types of modified clay
2.2.2 细菌群落组成与多样性
细菌16S rDNA高通量测序后,平均每个样品测得37 008条有效序列。所有样品的序列经过聚类后共得到1 422个OTU(operational taxonomic unit,操作分类单元),经物种注释后共获得 21个门、36个纲、82个目、159个科和 322个属的细菌。在属水平上,两实验组最大丰度排名前10的物种相对丰度如图3所示。MCⅠ处理3 h后,絮体中细菌主要以Stenotrophomonas为主,且随时间变化,Stenotrophomonas丰度逐渐降低,第26 d主要以Celeribacter和Altererythrobacter为主。添加MCⅡ后,絮体中优势菌属同样随时间发生演替,由Altererythrobacter、Marivita、Fluviicola逐渐向Celeribacter、Muricauda、Sulfitobacter、Altererythrobacter转变。选用Shannon指数评估不同改性粘土处理后絮体菌群的物种多样性(图4),MCⅠ组3 h的Shannon指数为0.44,而后逐渐升高至第26 d的4.93,MCⅡ组菌群多样性指数由3 h的4.68降低至第11 d的2.43,此后第26 d回升至3.62。

图3 属水平最大丰度排名前10的细菌物种相对丰度图Fig.3 Relative abundances of the top ten bacteria at the genus level
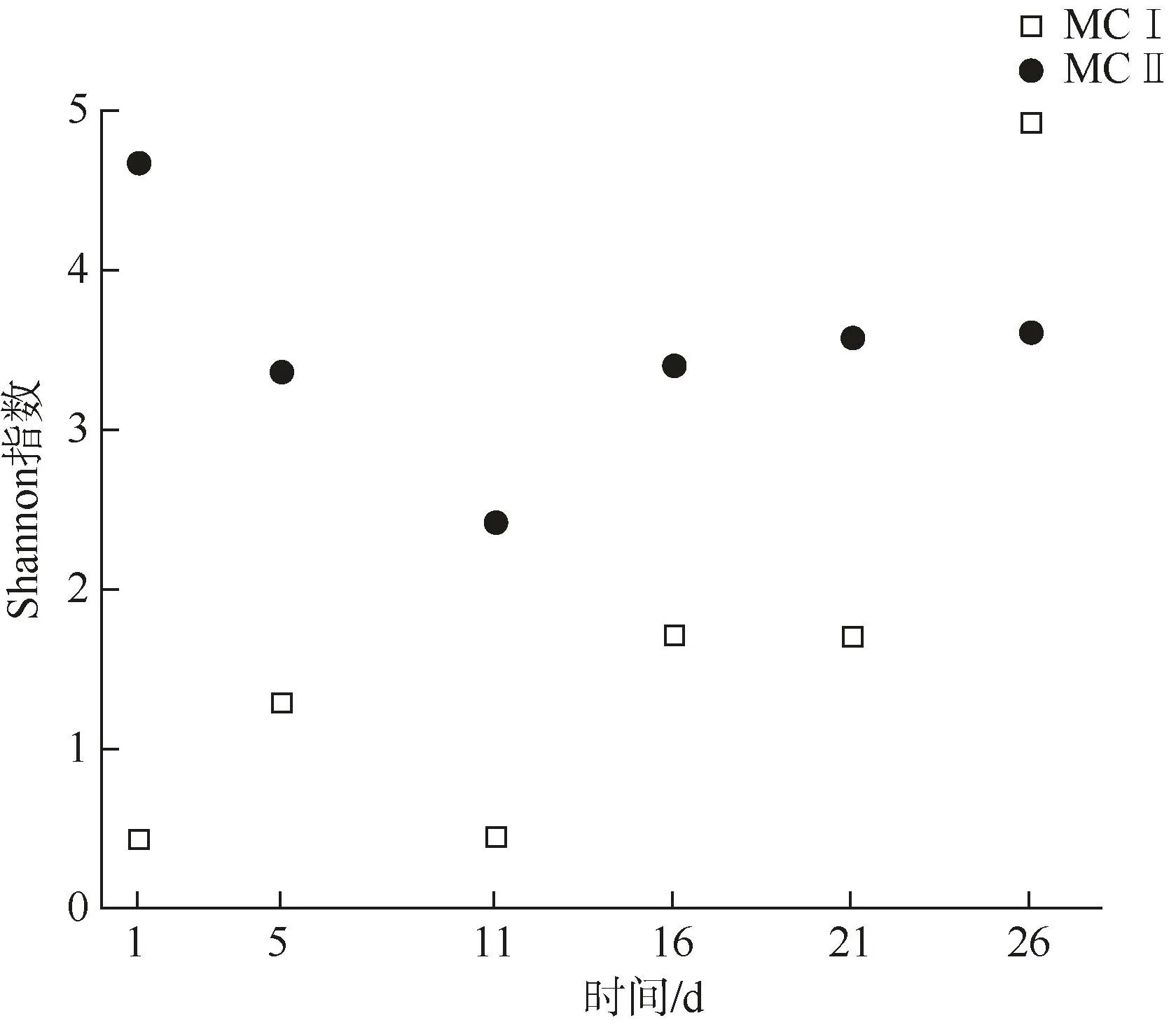
图4 MCⅠ和MCⅡ组絮体中细菌的Shannon指数Fig.4 Bacterial Shannon index of MCⅠand MCⅡ flocs
2.2.3 细菌功能预测
根据 16S rDNA序列的分类注释结果,采用FAPROTAX工具对MCⅠ和MCⅡ组的细菌群落功能注释后,分别获得57和53种功能分组,最大丰度排名前20的功能分组信息如图5所示。从图中可以看出,化能异养(包括 chemoheterotrophy和 aerobic chemoheterotrophy)功能相对丰度较高,在所有样本中均有出现。另外,在MCⅠ组中,具有硝酸盐还原(nitrate reduction)、硝酸盐呼吸(nitrate respiration)、固氮(nitrogen respiration)功能的细菌相对丰度较高; MCⅡ组中,除了化能异养功能外,细菌发酵功能(fermentation)的相对丰度较高,后期还出现了较高比例的硫氧化(dark sulfur oxidation)、硫化合物氧化(dark oxidation of sulfur compounds)和亚硫酸盐氧化(dark sulfite oxidation)方面的细菌功能。

图5 不同改性粘土处理后,絮体中细菌功能相对丰度Fig.5 Relative abundances of bacterial function in flocs treated with different modified clays
2.3 主要水质参数
本研究在分析不同处理组细菌密度和群落变化的同时,也监测了主要水质参数的变化情况。经改性粘土处理后,MCⅠ组3 h絮体中TOC浓度为(151.35±16.23) mg/L,实验前期略有下降,而后随时间变化逐渐升高; MCⅡ组絮体TOC持续缓慢减少,由3 h的(203.18±2.69) mg/L 降至第 26 d(166.24±14.49) mg/L (图6)。

图6 不同改性粘土处理后,絮体TOC随时间变化Fig.6 Changes of TOC in flocs after treatment with different modified clays over time
水体中硝酸盐含量变化情况如图7a所示,添加0.5 g/L的MCⅠ后,3 h水体中硝酸盐含量为(467.00±11.35) μmol/L,而后随时间变化持续降低至(262.15±5.86) μmol/L。加入 MCⅡ后,水体中硝酸盐浓度为(460.30±6.59) μmol/L,一直降低至第 21 d 的(392.22±0.47) μmol/L,第 26 d 回升至(459.95±2.59) μmol/L。添加MCⅠ后,亚硝酸盐浓度从(2.85±0.01) μmol/L增加到(35.09±4.12) μmol/L; 而 MCⅡ组亚硝酸盐浓度变化幅度较小,在(1.41±1.94) μmol/L到(2.88±0.01) μmol/L范围内波动(图7b)。添加0.5 g/L的MCⅠ后,水体中铵盐浓度为(3.92±0.00) μmol/L,此后逐渐增加至(14.70±0.83) μmol/L。添加MCⅡ后,铵盐浓度一直上升,至第 26 d 为(22.28±3.02) μmol/L (图7c)。

图7 不同改性粘土处理后,水体中溶解无机氮各组分变化Fig.7 Changes in dissolved inorganic nitrogen in water treated with two types of modified clay
3 讨论
3.1 改性粘土对细菌密度的影响
海洋细菌作为重要的分解者,以多样化的代谢活动参与海洋中的物质转化和分解过程,其密度是海洋微生物研究的关键参数。有不少研究表明,海洋细菌的密度[19-20]和群落结构[21-22]与赤潮暴发关系密切,细菌与赤潮藻之间相互利用、相互选择,形成特有的微生物群落结构[23]。
改性粘土通过表面改性使原土表面由负电性转变为正电性[4],而细菌表面含有羧基和磷酸基团等,带有大量负电荷[24],与表面带正电的改性粘土颗粒易发生絮凝沉降。有研究发现,在鱼虾养殖中可以使用粘土絮凝沉降细菌,以防止养殖生物幼体受到病原菌感染[25]。本研究中,由于不同类型改性粘土絮凝效果不同,MCⅡ对米氏凯伦藻的去除率高于MCⅠ(图1),可以推断 MCⅡ对细菌的絮凝效果也高于MCⅠ,致使3 h的MCⅡ组絮体中的细菌密度高于 MCⅠ组(图2)。
细菌生长繁殖需要适宜的条件,如营养物质、温度、水分、环境含氧量等[26],本研究中 MCⅠ和 MCⅡ组温度等环境条件稳定,造成细菌密度变化的主要差异来源于营养物质。在后续的26天实验中,底层絮体中细菌密度持续增加,这是由于沉积絮体含有大量的藻源有机质,为异养细菌提供了丰富的碳源等营养物质[27]。Avnimelech[28]研究发现,有机质含量会影响细菌密度,随着水体中 C/N的提高,异养细菌含量会显著升高; Burford等[29]向养殖水体中添加有机碳,可以促进细菌的生长,消耗大量的营养物质,从而可控制养殖水体的无机氮。本实验中,同样用量、不同类型改性粘土对米氏凯伦藻的去除率不同(图1),致使底层絮体中有机质含量不同(图6),TOC含量的差异可能会影响后续细菌密度的变化。实验前期(1~11 d),MCⅠ组絮体中细菌平均增长速率为 2.14×1010个/(L·d),而 MCⅡ组细菌平均增长速率为 3.44×1010个/(L·d)。由此可见,MCⅡ组底层絮体中较高的有机质含量为 MCⅡ组中细菌的增殖提供了更好的环境条件,可能是导致 MCⅡ组细菌的生长率高于MCⅠ组的原因之一。在实验后期(11~26 d),MCⅠ组絮体中细菌平均增长速率为3.38×1010个/(L·d),而MCⅡ组为 6.60×109个/(L·d),推测其原因可能是 MCⅠ组中再次生长的藻细胞进入衰亡期(图1),水体中藻细胞死亡后沉降至底层,补充了絮体中藻源有机质的含量,从而促进了MCⅠ组底层絮体中细菌的生长;而在 MCⅡ组后续的实验过程里,絮体中无藻源有机质补充,有机质成为细菌生长的限制条件,使得细菌的增长速率减缓。
细菌的生长与繁殖需要消耗有机物,而 MCⅠ处理后米氏凯伦藻经历再次生长与死亡的过程,在实验后期大量有机物沉降至底层,使得絮体中 TOC增长,所以,本研究对 MCⅠ组前期和 MCⅡ组的细菌增长速率与TOC消耗速率进行相关性分析(图8)。结果发现,细菌增长速率与 TOC消耗速率呈正相关(P<0.001),即 TOC消耗得越快,细菌增长越快。由此可见,MCⅠ与MCⅡ组中细菌密度变化与TOC含量密切相关,絮体中TOC含量会影响细菌密度。

图8 细菌增长速率与TOC消耗速率之间的相关性Fig.8 Correlation analysis between bacterial growth rate and TOC consumption rate
3.2 改性粘土对细菌群落组成及功能的影响
实验结果显示,不同类型改性粘土不仅能影响细菌密度,同时也会对细菌群落组成产生一定影响(图3)。MCⅠ和MCⅡ组组间细菌群落结构差异显著(P<0.001),通过 LEfSe分析(LDA score>4)寻找 MCⅠ、MCⅡ组间差异显著的物种,结果显示,MCⅠ组的差异显著的菌属为Stenotrophomonas,MCⅡ组的差异物种有Celeribacter、Muricauda、Sulfitobacter、Altererythrobacter、Maribacter、Marivita、Alteromonas、Fluviicola(图9)。

图9 MCI和MCⅡ组絮体中细菌的LEfSe进化分支图Fig.9 LEfSe analyses of MC I and MC II
MCⅠ组的细菌群落以Stenotrophomonas为主。该细菌为一种革兰氏阴性菌,约0.5~1.5 μm,有若干极生鞭毛,形态为微弯曲或直的杆状[30-31],在水和土壤等自然环境中广泛分布[31],有的还存在于植物根系中,能够参与固氮[32],有的能够降解一些复杂有机物[31],该属下的细菌大多耐药且抗菌,可用来作为生物防治剂[33]。近年来,也曾多次在海洋环境中分离到该属的细菌[34-35],阴盼晴[36]发现S.maitophilia可通过分泌胞外耐高温活性物质及胞外酶类抑制藻细胞存活,抑制赤潮藻锥状斯式藻(Scrippsiella trochoidea)的生长。Stenotrophomonas还是一种耐卤菌群,能够在高浓度的 NaCl条件下存活[37]。另外,Stenotrophomonas能够产生螯合铝的有机酸和增加溶液pH值的多糖来降低铝的毒性,因此该菌能够耐受高浓度铝[38-39]。在MCⅠ组中,絮体中细菌物种多样性指数前期较低(图4),一种Stenotrophomonas占主要优势,可能正是因为该类细菌对MCⅠ中的聚合氯化铝具有一定耐受性,或者MCⅠ中的某些微量元素等综合因素的影响刺激了Stenotrophomonas的生长,亦或未死亡米氏凯伦藻的影响。在MCⅠ组后期,絮体中菌群多样性指数升高,Stenotrophomonas优势地位减弱,可能是由于米氏凯伦藻完全衰亡、或者MCⅠ中的某些微量元素耗尽等原因,该结果将在后续的实验中进一步验证。
在 MCⅡ组中,细菌群落结构随实验时间增加逐渐变化,优势菌属发生演替,由Altererythrobacter、Marivita、Fluviicola逐渐变为Celeribacter、Muricauda、Sulfitobacter、Altererythrobacter,推测该变化或与MCⅡ的改性剂——硫酸铝有关。Fluviicola、Altererythrobacter、Marivita三种菌属均为革兰氏阴性菌,且为海水中常见的菌属[40-42]。而随实验时间的进行,为适应 MCⅡ处理后的环境,细菌群落逐渐向Celeri-bacter、Muricauda、Sulfitobacter、Altererythrobacter等菌属转变。Celeribacter最早从海洋分离[43],是一种化能异养菌,能够氧化硫代硫酸盐[44],Sulfitobacter能够产生亚硫酸盐氧化酶,该属细菌可参与亚硫酸盐的氧化[45-46],而Altererythrobacter属下细菌可通过歧化反应降解硫代硫酸盐[47]。硫是构成生命物质所必须的元素,它是一些必需氨基酸、蛋白质、多糖、维生素和辅酶的组成成分,它的转化过程较为复杂,由多种硫细菌完成[48]。在MCⅡ组中,实验后期的菌属大多能参与和硫相关的反应,推测 MCⅡ组沉积絮体中存在硫转化的可能。
不同类型的改性粘土对细菌群落组成产生了不同的影响,同时也会在一定程度上影响细菌群落的功能。而细菌在有机物矿化分解中起着重要作用,其功能在一定程度上影响了海洋生态系统的物质循环与能量流动。经FAPROTAX对细菌群落功能进行预测发现(图5),在MCⅠ组中,具有硝酸盐还原、硝酸盐呼吸、固氮功能的细菌相对丰度较高,且上述功能在 MCⅠ和 MCⅡ组中存在显著性差异(P<0.05)。通过水质参数变化发现,MCⅠ组水体中硝酸盐浓度降低、亚硝酸盐浓度升高(图7a,图7b),推测其发生硝酸盐还原过程。
相比 MCⅠ组,MCⅡ组中发酵作用的细菌功能相对丰度较高,后期还出现较高比例的硫、硫化合物和亚硫酸盐氧化作用方面的细菌功能,上述功能在MCⅠ和 MCⅡ两组间差异显著(P<0.05)。这可能与MCⅡ型改性粘土中改性剂有关,而本实验中并未进行与硫有关的水质参数的测定,拟在今后的研究中进一步完善和深入。
另外,MCⅠ和 MCⅡ组中化能异养功能均占有较高比例,结合水质参数发现,MCⅠ、MCⅡ组中TOC在实验前期均有所下降(图6),由此可见,MCⅠ和 MCⅡ组絮体中不同的细菌群落对藻源有机质进行了分解。此外,本研究中,MCⅠ组、MCⅡ组水体中铵盐浓度均上升(图7c),推测有机氮在异养菌的作用下发生了降解。海水中还原态氨氮主要是海洋生物代谢和死亡分解的终产物[49],有机氮可以直接脱氨基,氨基再与氢离子结合形成铵离子。
4 结论
1) 改性粘土处理后的26 d内,MCⅠ组和MCⅡ组絮体中细菌密度持续增长,且两组间细菌的增长速率不同,这是由于不同类型改性粘土对米氏凯伦藻的去除率不同,使底层絮体中的有机质含量不同,从而影响细菌的密度变化。
2) 不同类型改性粘土对细菌群落结构产生了不同的影响,MCⅠ组絮体中细菌主要以Stenotrophomonas为主,MCⅡ组的优势种为Celeribacter、Muricauda、Altererythrobacter、Sulfitobacter等。通过 FAPROTAX功能预测发现,MCⅠ组中的细菌具有较高丰度的硝酸盐还原、硝酸盐呼吸以及固氮等功能,MCⅡ组中硫氧化、硫化合物氧化、亚硫酸盐氧化等与硫转化有关的细菌功能占比较高。
致谢:感谢吴婷对实验部分的帮助,感谢张悦对文章修改的建议,同时十分感谢各位审稿专家对本文提出的建设性的修改意见与建议。
