水飞蓟素对重症急性胰腺炎大鼠肠道损伤及PI3K/Akt和NF-κB信号通路影响
2021-08-27张庆清
哈 虹, 哈 良, 张庆清
哈虹, 天津中医药大学第一附属医院妇科 天津市 300191
哈良, 天津市中西医结合医院肝胆胰一科 天津市 300000
张庆清, 天津市河东区中山门街社区卫生服务中心中医妇科 天津市300181
0 引言
轻度急性胰腺炎(mild acute pancreatitis, MAP)、中度急性胰腺炎、重症急性胰腺炎(severe acute pancreatitis, SAP)是临床十分常见的急腹症, 其中重症急性胰腺炎常常涉及到多个器官衰竭、出现败血症等现象, 其治疗十分棘手[1]. 很多研究报道表明[2], 急性胰腺炎中过量的炎症因子释放会损伤肠黏膜, 诱导细胞凋亡, 加快病程. 水飞蓟素属于黄酮类化合物, 其是从水飞蓟种子内提取出来的活性成分, 有抗氧化、免疫调节、消炎、保护肝脏、抗组织纤维化等功效[3]. 以前的研究发现, 水飞蓟素对急性胰腺炎有治疗效果, 其处理以后的急性胰腺炎大鼠模型肺组织损伤程度降低, 炎症水平下降, 并且水飞蓟素可以降低肺组织中NF-κB信号通路激活水平[4]. 目前尚未见关于水飞蓟素在重症急性胰腺炎肠道损伤中的相关研究. 研究显示, 急性胰腺炎的发生与信号通路有关, 目前发现的信号通路主要有PI3K/Akt、NF-κB等[5]. PI3K/Akt、NF-κB均为在人体组织中具有强大生物学作用的信号转导通路, 与炎症、细胞凋亡等有关[6,7]. 以前的研究认为, PI3K/Akt、NF-κB在急性胰腺炎中过度激活, 而下调其激活水平能够减轻胰腺炎损伤[8,9]. 本次实验构建重症急性胰腺炎大鼠模型, 研究水飞蓟素对重症急性胰腺炎大鼠肠道损伤以及PI3K/Akt、NF-κB信号通路的影响, 为水飞蓟素治疗重症急性胰腺炎的临床应用提供理论基础.
1 材料和方法
1.1 材料 TUNEL法细胞凋亡检测试剂盒购自美国Promega; 体重220 g-240 g清洁级SD大鼠购自维通利华实验动物中心; 水飞蓟素购自大连美仑生物技术有限公司; TNF-α含量检测试剂盒购自武汉艾美捷科技有限公司; IL-1β含量检测试剂盒购自美国Cayman Chemical;Bcl-2抗体(12789-1-AP)、PI3K抗体(20584-1-AP)购自美国Proteintech; p-PI3K抗体(17366)购自美国Cell Signaling Technology; Bax抗体(A1434)购自美国BioVision; NFκBp65抗体(PA1-186)购自美国Invitrogen; p-Akt抗体(ab64148)、Akt抗体(ab8805)购自美国Abcam.
1.2 方法
1.2.1 模型构建及分组处理: 50只大鼠随机分成SAP、Experimental+L、Experimental+M、Experimental+H、Glutamine组, 每组10只. 大鼠造模成功以后2 h,Experimental+L、Experimental+M、Experimental+H组腹腔注60、120、240 mg/kg的水飞蓟素, Glutamine组腹腔注射1.5 g/kg谷氨酰胺. 选取10只大鼠为Control组, Control组大鼠仅切口并翻动十二指肠, 不注射药物.Control组、SAP组以等量的生理盐水代替水飞蓟素. 24 h以后, 采集标本. SAP组大鼠死亡3只, Experimental+L、Experimental+M组大鼠分别死亡2只、1只, Glutamine组大鼠死亡2只, 随机将各组大鼠淘汰, 使最终各组剩余7只. 大鼠造模方法如下: 在实验前所有大鼠均按照昼夜自然交替方法进行适应性喂养7 d, 不限制饮食和饮水.重症急性胰腺炎大鼠模型构建方法如下: 以腹腔注射10%的水合氯醛将大鼠麻醉, 然后将麻醉以后的大鼠按照仰卧位固定至手术台, 将腹部的毛剪掉, 然后用碘伏消毒. 在大鼠的上腹部正中位置切开2-3 cm的切口, 将十二指肠取出, 找到胰胆管和肝门部的肝总管, 沿着胰胆管的方向, 用小动脉夹把胰胆管靠近肝门的位置夹闭, 避免给药的过程中药物反流. 在壶腹部观察到有一个能够延伸下来、呈现白色的胰胆管, 选择在壶腹部没有血管的区域, 直接穿刺胰胆管. 首先使用注射针头穿刺一个小孔, 然后用4.5号的头皮针插入胰胆管5 mm, 按照逆行的方向等量注射5%的牛磺胆酸(1 mL/kg), 将针头抽出, 使动脉夹继续夹闭5 min, 以食指和拇指将穿刺点捏紧5 min, 促进药物进入胰腺. 将动脉夹取掉, 复位肠管, 关闭腹腔. 取大鼠胰腺组织切片, HE染色观察, 并对胰腺病理学评分, 鉴定造模成功.
1.2.2 标本采集: 将大鼠麻醉以后, 心脏采血, 在室温中静置1 h以后, 以3000 g离心10 min, 收集上清, 用于1.4中检测. 取大鼠的回肠以及胰腺组织.
1.2.3 淀粉酶、脂肪酶和IL-1β、TNF-α水平检测: 用全自动生化分析仪检测血清中淀粉酶、脂肪酶水平, 用ELISA法检测血清中IL-1β、TNF-α含量, 操作步骤按照IL-1β含量检测试剂盒、TNF-α含量检测试剂盒操作说明书进行.
1.2.4 胰腺病理评分和回肠病理评分: 取大鼠胰腺组织以及回肠组织, 用PBS洗涤以后, 在4%的多聚甲醛溶液中固定, 以浓度梯度酒精包埋, 组织切片机切片(厚度为4 μm), 70 ℃烤片30 min. 用透明剂I和II孵育5 min.然后将切片放在100%、95%、80%、75%浓度的酒精溶液中浸泡45 s, 用水洗涤1 min. 苏木素染色2 min, 用水洗涤1 min. 用1%的盐酸乙醇分化, 1%的氨水显蓝.加伊红复染60 s. 在浓度为75%、85%、95%的酒精中浸泡45 s, 透明剂Ⅰ和Ⅱ孵育1 min, 中性树脂封片. 在显微镜下观察切片, 参照文献[10]进行胰腺病理评分和回肠病理评分.
1.2.5 Western blot检测Bcl-2、Bax、PI3K、p-PI3K、Akt、p-Akt、NF-κBp65蛋白表达: 取回肠组织, 用剪刀将组织块切碎, 添加已经预冷至0 ℃的RIPA裂解溶液, 放在冰上裂解20 min, 然后以4 ℃, 12000 g离心10 min. 把上清溶液吸取到EP管内, 按照BCA方法检测蛋白的浓度. 将玻璃板洗涤干净并固定, 然后制备10%的分离胶添加到玻璃槽内, 用去离子水将胶面覆盖, 在室温中固定40 min. 然后制备5%的浓缩胶, 添加到胶板中, 将样品梳插入, 在室温中凝固40 min. 将梳子拔掉, 分别在上样孔内添加30 μg的蛋白样品, 蛋白样品在添加到上样孔之前, 需要和5×Loading Buffer混合煮沸5 min. 在浓缩胶内采用80 V的电压电泳, 在分离胶中使用120 V的电压电泳, 等到染料进入到分离胶的底部以后, 停止电泳. 将PVDF膜浸泡在甲醇中2 min,然后转移到转膜缓冲液中备用. 转膜装置放在冰上, 以130 mA的恒流转膜1.5 h. 将PVDF膜取出, 放在封闭液(含有5%牛血清白蛋白的TBST)中, 转移到室温条件下孵育2 h. 然后将PVDF膜放在一抗溶液中, 在4 ℃条件下过夜, 最后把PVDF膜放在二抗溶液中, 在室温中结合2 h. 用ELC方法显色. Image J分析条带的灰度值, 内参为GAPDH, 分析目的蛋白的表达变化. 二抗均按照1:4000稀释, Bcl-2、Bax、PI3K、p-PI3K、Akt、p-Akt、NF-κBp65一抗按照1:1000、1:1000、1:1000、1:600、1:1000、1:600、1:800稀释.
1.2.6 TUNEL法检测细胞凋亡指数: 取回肠石蜡切片,用二甲苯浸泡5 min×2次, 然后用浓度梯度酒精水化,4%的多聚甲醛固定, TUNEL染色, 肠上皮细胞核为棕色表示阳性, 在显微镜下选择5个视野, 计算细胞凋亡指数. 步骤完全按照TUNEL法细胞凋亡检测试剂盒说明书进行.
统计学处理用SPSS 21.0软件分析实验数据, 数据用mean±SD表示, 两组数据间比较用t检验, 多组差异比较用单因素方差,P<0.05为差异有统计学意义.
2 结果
2.1 水飞蓟素对重症急性胰腺炎大鼠死亡情况影响 结果见表1, SAP组大鼠死亡3只, Experimental+L、Experimental+M、Experimental+H组大鼠分别死亡2只、1只和0只.
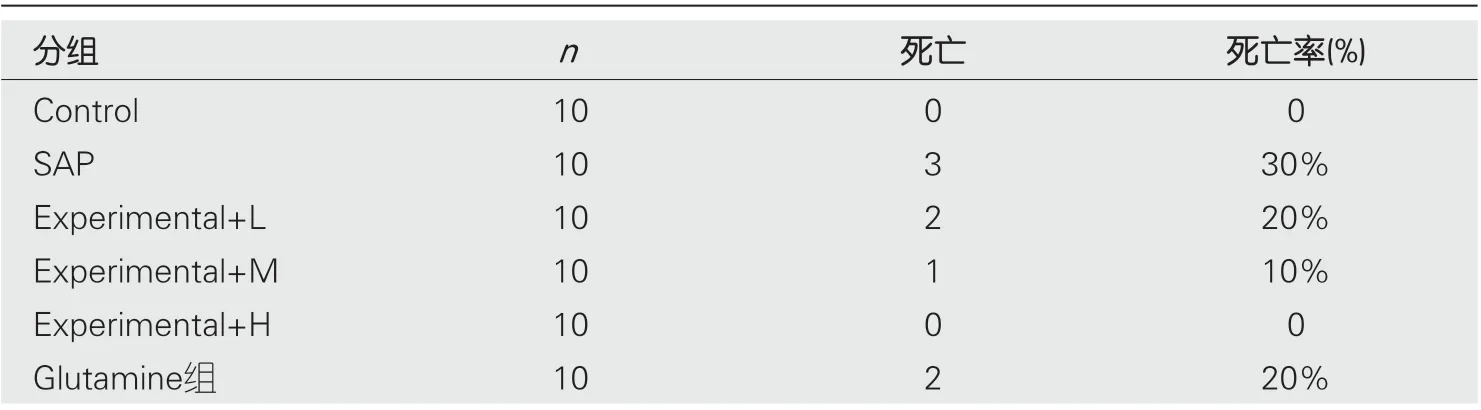
表1 各组大鼠死亡情况(mean±SD)
2.2 水飞蓟素对重症急性胰腺炎大鼠血清中淀粉酶、脂肪酶和IL-1β、TNF-α含量影响 结果见图1及表2,SAP组大鼠血清中淀粉酶、脂肪酶以及IL-1β、TNF-α水平均高于Control组; 与SAP组比较, Experimental+L、Experimental+M、Experimental+H组大鼠血清中淀粉酶、脂肪酶以及IL-1β、TNF-α水平均逐渐降低, 不同剂量组间比较差异有统计学意义(P<0.05). 与SAP组比较, Glutamine组大鼠血清中淀粉酶、脂肪酶以及IL-1β、TNF-α水平均降低, 差异有统计学意义(P<0.05).
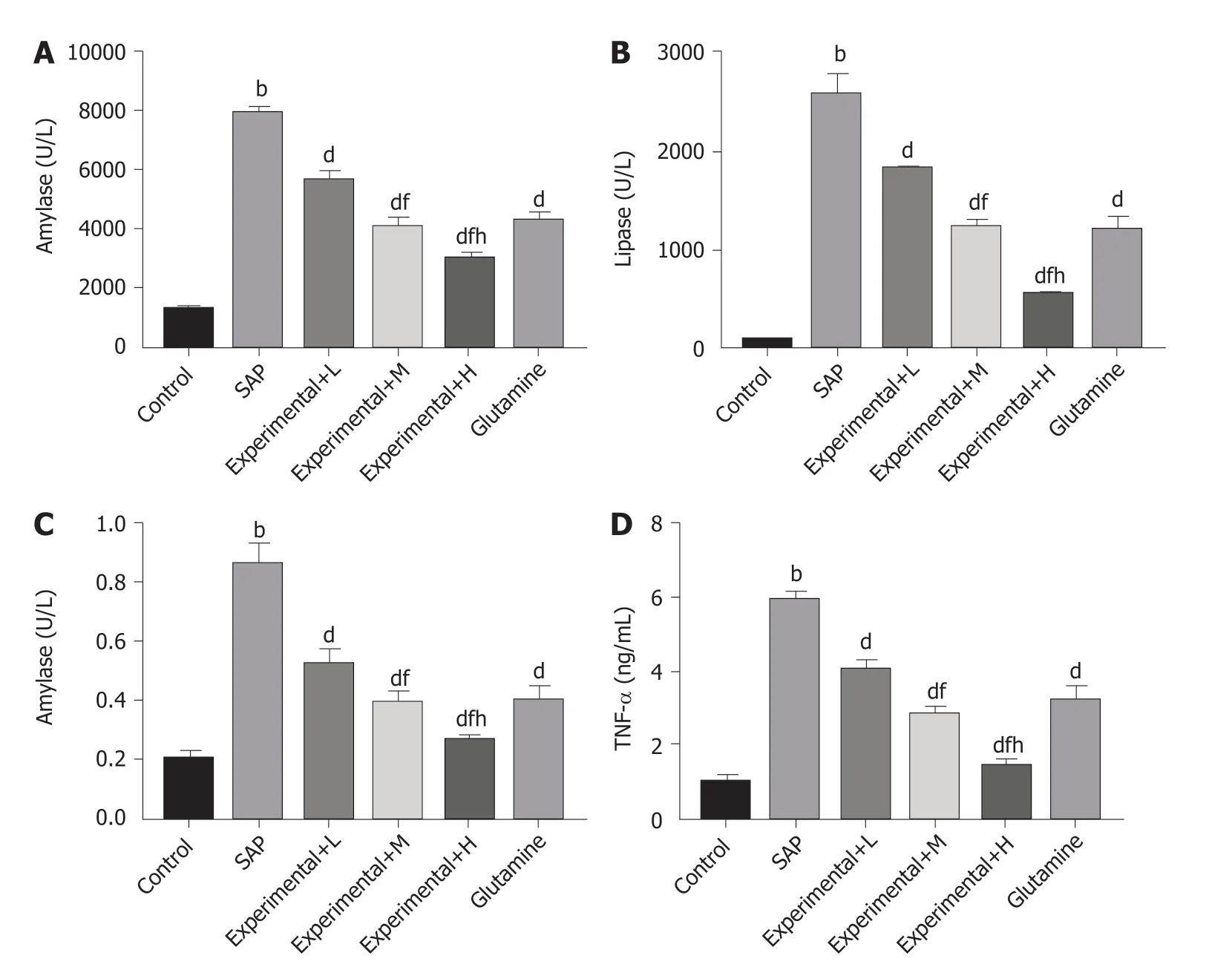
图1 各组大鼠血清中淀粉酶、脂肪酶和IL-1β、TNF-α水平(mean±SD). A: 血清中淀粉酶水平; B: 血清中脂肪酶水平; C: 血清中IL-1β水平; D: 血清中TNF-α水平. 与Control组比较, aP<0.05, bP<0.01; 与SAP组比较, cP<0.05, dP<0.01; 与Experimental+L组比较, eP<0.05, fP<0.01; 与Experimental+M组比较, gP<0.05, hP<0.01. Control组: 对照组; SAP: 重症急性胰腺炎模型组; Experimental+L组: 重症急性胰腺炎模型+60 mg/kg水飞蓟素治疗组; Experimental+M组: 重症急性胰腺炎模型+120 mg/kg水飞蓟素治疗组; Experimental+H组: 重症急性胰腺炎模型+240 mg/kg水飞蓟素治疗组.
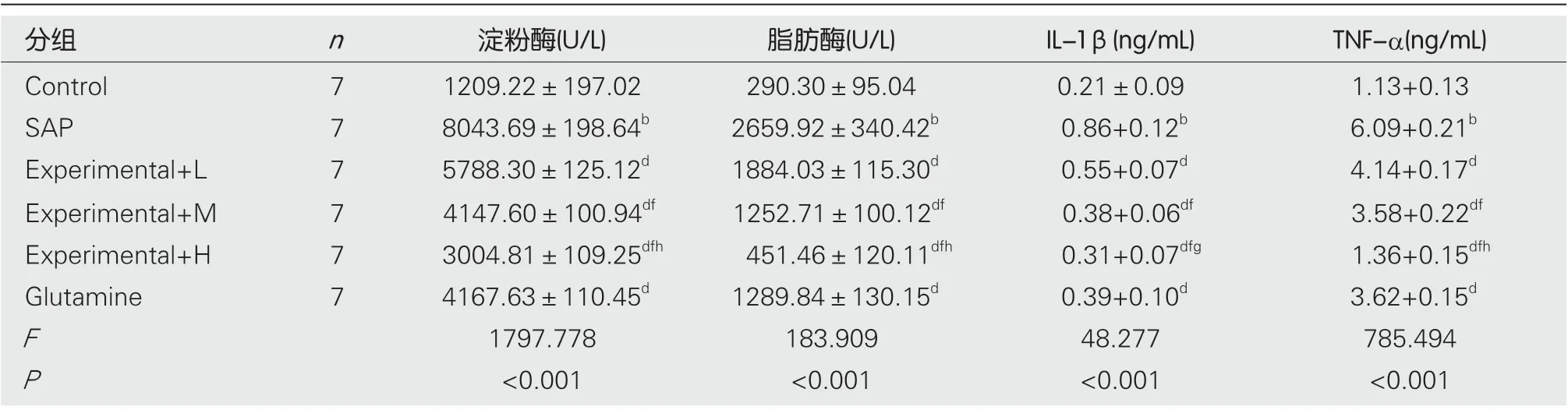
表2 各组大鼠血清中淀粉酶、脂肪酶和IL-1β、TNF-α水平(mean±SD)
2.3 水飞蓟素对重症急性胰腺炎大鼠胰腺病理评分和回肠病理评分影响 结果见图2, 图3, 表3, SAP组大鼠胰腺病理评分和回肠病理评分均高于Control组;Experimental+L、Experimental+M、Experimental+H组大鼠胰腺病理评分和回肠病理评分均逐渐降低, 与SAP组比较, 差异有统计学意义(P<0.05), 且不同剂量组间比较差异有统计学意义(P<0.05). 与SAP组比较, Glutamine组大鼠胰腺病理评分和回肠病理评分均降低, 差异有统计学意义(P<0.05).
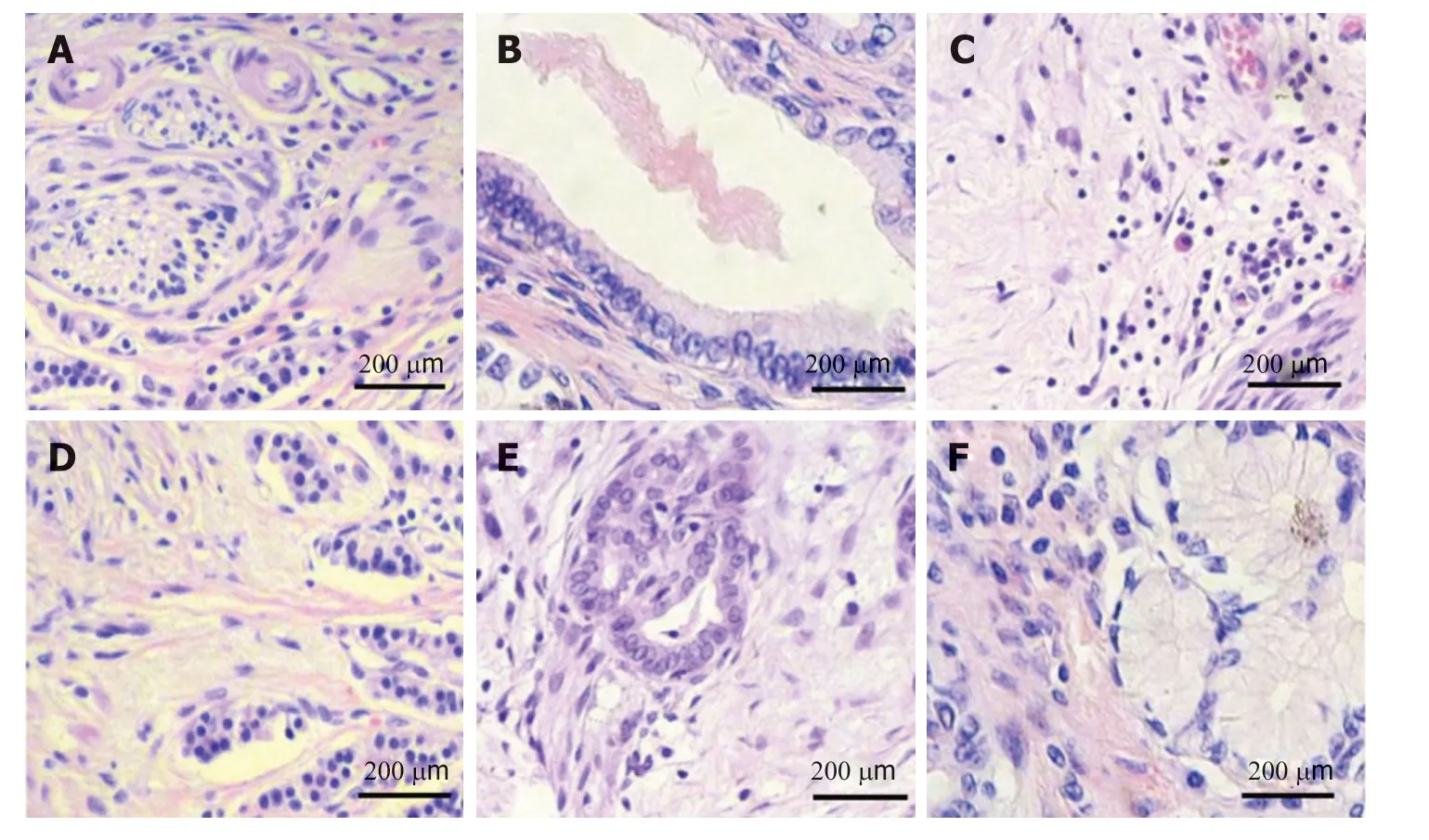
图2 胰腺HE染色结果. A: Control: 对照组; B: SAP: 重症急性胰腺炎模型组; C: Experimental+L: 重症急性胰腺炎模型+60 mg/kg水飞蓟素治疗组; D: Experimental+M: 重症急性胰腺炎模型+120 mg/kg水飞蓟素治疗组; E: Experimental+H: 重症急性胰腺炎模型+240 mg/kg水飞蓟素治疗组; F: Glutamine.
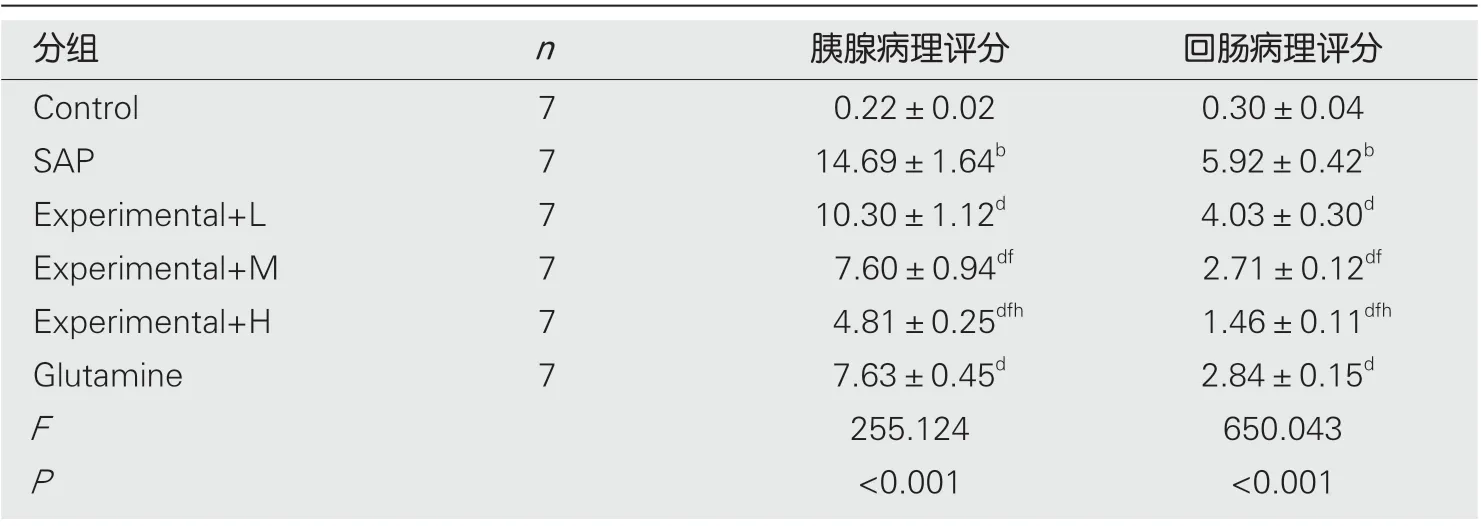
表3 各组大鼠胰腺病理评分和回肠病理评分比较(mean±SD)
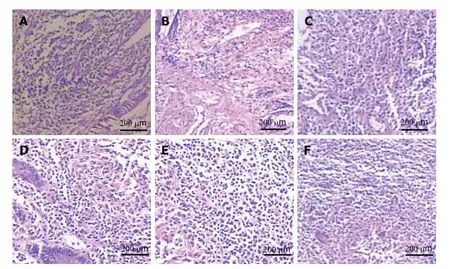
图3 回肠HE染色结果. A: Control; B: SAP; C: Experimental+L; D: Experimental+M; E: Experimental+H; F: Glutamine. Control组: 对照组; SAP:重症急性胰腺炎模型组; Experimental+L组: 重症急性胰腺炎模型+60 mg/kg水飞蓟素治疗组; Experimental+M组: 重症急性胰腺炎模型+120 mg/kg水飞蓟素治疗组; Experimental+H组: 重症急性胰腺炎模型+240 mg/kg水飞蓟素治疗组.
2.4 水飞蓟素对重症急性胰腺炎大鼠肠道组织中Bcl-
2、Bax蛋白表达以及肠黏膜细胞凋亡影响 结果见图4和表4, SAP组大鼠肠道组织中Bcl-2蛋白表达水平降低,Bax蛋白表达水平以及细胞凋亡指数均升高, 与Control组比较, 差异有统计学意义(P<0.05); Experimental+L、Experimental+M、Experimental+H组大鼠肠道组织中Bcl-2蛋白表达水平依次升高, Bax蛋白表达水平以及细胞凋亡指数均依次降低, 与SAP组比较, 差异有统计学意义(P<0.05), 且不同剂量组间比较差异有统计学意义(P<0.05). 与SAP组比较, Glutamine组大鼠肠道组织中Bcl-2蛋白表达水平升高, Bax蛋白表达水平以及细胞凋亡指数均降低, 差异有统计学意义(P<0.05).

表4 各组大鼠肠黏膜细胞凋亡指数比较(mean±SD)
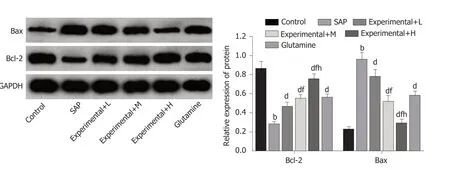
图4 Western blot方法分析各组大鼠肠道组织中Bcl-2、Bax蛋白表达变化. A: Western blot检测结果; B: Bcl-2、Bax蛋白表达水平比较.与Control组比较, aP<0.05, bP<0.01; 与SAP组比较, cP<0.05,dP<0.01; 与Experimental+L组比较, eP<0.05, fP<0.01; 与Experimental+M组比较,gP<0.05, hP<0.01. Control组: 对照组; SAP: 重症急性胰腺炎模型组; Experimental+L组: 重症急性胰腺炎模型+60 mg/kg水飞蓟素治疗组;Experimental+M组: 重症急性胰腺炎模型+120 mg/kg水飞蓟素治疗组; Experimental+H组: 重症急性胰腺炎模型+240 mg/kg水飞蓟素治疗组.
2.5 水飞蓟素对重症急性胰腺炎大鼠肠道组织中PI3K/Akt和NF-κB信号通路激活水平影响 结果见图5, SAP组大鼠肠道组织中p-PI3K/PI3K、p-Akt/Akt、NF-κBp65蛋白表达水平均升高, 与Control组比较, 差异有统计学意义(P<0.05); Experimental+L、Experimental+M、Experimental+H组大鼠肠道组织中p-PI3K/PI3K、p-Akt/Akt、NF-κBp65蛋白水平均依次降低, 与SAP组比较, 差异有统计学意义(P<0.05), 且不同剂量组间比较差异有统计学意义(P<0.05). 与SAP组比较, Glutamine组大鼠肠道组织中p-PI3K/PI3K、p-Akt/Akt、NF-κBp65蛋白水平均降低, 差异有统计学意义(P<0.05).
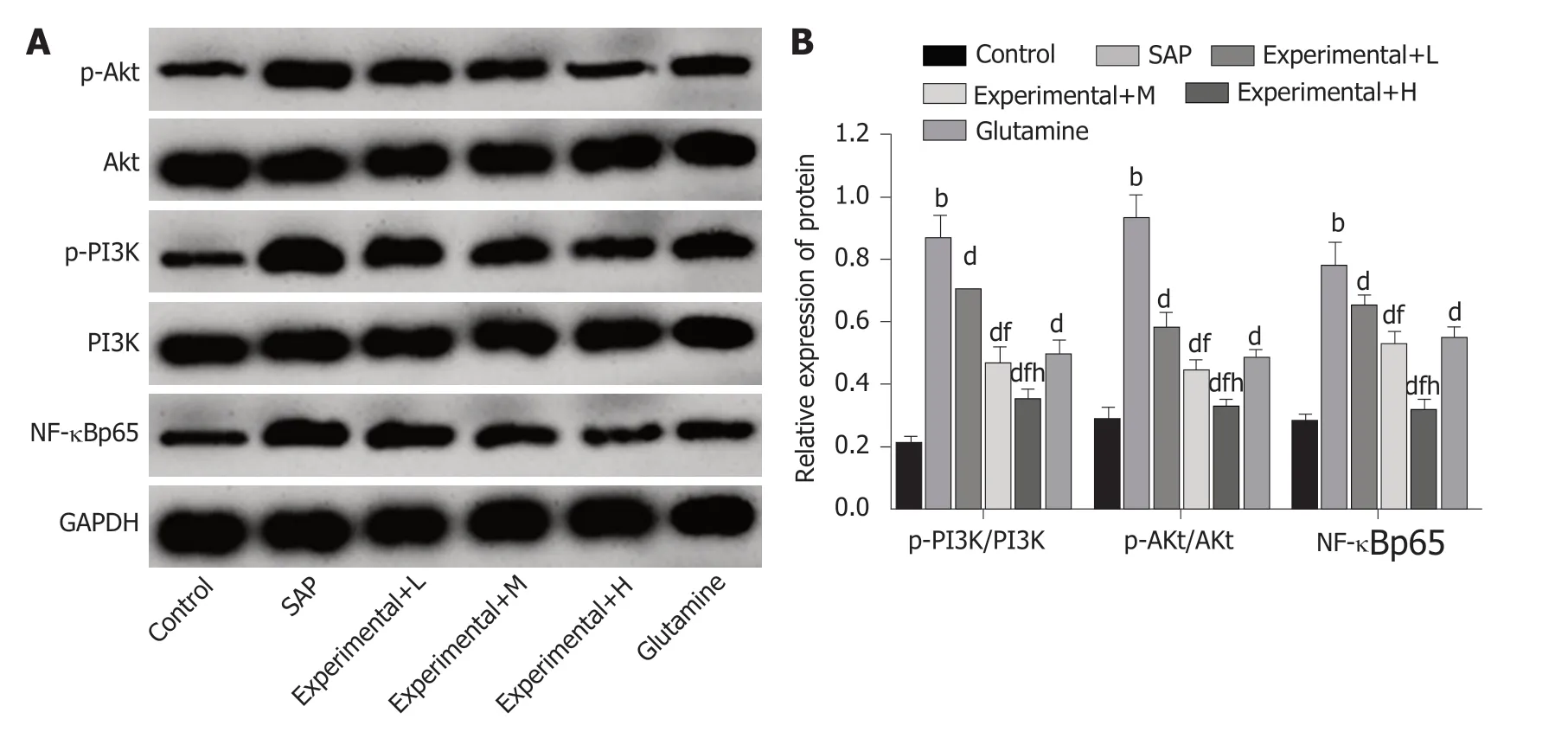
图5 Western blot方法分析各组大鼠肠道组织中PI3K、p-PI3K、Akt、p-Akt、NF-κBp65蛋白表达情况. A: Western blot检测结果; B: PI3K、p-PI3K、Akt、p-Akt、NF-κBp65蛋白表达水平比较. 与Control组比较, aP<0.05, bP<0.01; 与SAP组比较, cP<0.05, dP<0.01; 与Experimental+L组比较, eP<0.05, fP<0.01; 与Experimental+M组比较, gP<0.05, hP<0.01. Control组: 对照组; SAP: 重症急性胰腺炎模型组; Experimental+L组: 重症急性胰腺炎模型+60 mg/kg水飞蓟素治疗组; Experimental+M组: 重症急性胰腺炎模型+120 mg/kg水飞蓟素治疗组; Experimental+H组: 重症急性胰腺炎模型+240 mg/kg水飞蓟素治疗组.
3 讨论
水飞蓟属于菊科草本植物, 其活性成分主要存在于种子内, 为水飞蓟素, 水飞蓟素有很多药理学作用, 如保肝、促进肝细胞修复、降血脂、抗肿瘤、抗血小板等[11]. 近些年来, 有研究发现, 水飞蓟素治疗以后的急性胰腺炎大鼠的肺组织和胰腺组织损伤程度降低, 并且其可以抑制NF-κB信号通路的激活[4]. 胰腺炎是一个炎症性疾病,机体内炎症水平与其造成的组织损伤密切相关[12]. IL-1β、TNF-α为常见的促炎因子, 其表达水平升高以后,机体炎症水平也升高[13]. 本实验显示, 60、120、240 mg/kg的水飞蓟素处理以后的重症急性胰腺炎大鼠模型血清中淀粉酶、脂肪酶、IL-1β、TNF-α水平下降, 胰腺损伤程度降低, 回肠病理评分也降低, 水飞蓟素改善重症急性胰腺炎大鼠肠道损伤, 这与以前研究报道相一致,说明在60-240 mg/kg剂量范围内, 水飞蓟素对急性胰腺炎有治疗作用.
重症急性胰腺炎发生过程中, 机体内过量的炎症介质能够造成肠道损伤, 影响肠黏膜正常功能[14]. 研究显示[15], 肠上皮细胞凋亡是引起肠黏膜损伤的关键. 细胞凋亡是一个复杂过程, 与细胞内多种基因、信号调控有关, 而且这些因子通过相互作用, 共同影响细胞凋亡的命运[16]. Bcl-2是一个和细胞凋亡关系十分密切的蛋白成员, 其包含有多个蛋白成员, 这些蛋白成员在细胞凋亡进展中分别发挥抑制作用和促进作用[17]. Bax和Bcl-2均为Bcl-2蛋白家族成员, 但其在细胞凋亡进程中的作用相反[18]. Bax是一个促凋亡蛋白, 在细胞凋亡进程中发挥激活作用, 而Bcl-2是一个抗凋亡蛋白, 在细胞凋亡进展中发挥削弱作用[19]. 本实验结果表明, 重症急性胰腺炎大鼠肠上皮细胞凋亡水平升高, 而60、120、240 mg/kg的水飞蓟素治疗以后的大鼠肠上皮细胞凋亡指数降低,同时Bax蛋白表达减少, Bcl-2蛋白表达增加, 提示在60-240 mg/kg剂量范围内, 水飞蓟素抑制重症急性胰腺炎大鼠肠上皮细胞凋亡, 这可能是水飞蓟素抗重症急性胰腺炎大鼠肠道损伤的重要原因.
无论是在人体正常的生理过程还是在疾病进展中, 信号通路的作用十分关键, 并且信号通路还可能是疾病治疗的靶点[20]. 以前的研究发现, 水飞蓟素降低胰腺炎动物模型肺组织中NF-κB信号通路的激活水平[4].NF-κB信号通路是炎症反应的中心枢纽, 能够介导下游多个炎症因子的释放[21]. 另外, NF-κB还参与影响细胞凋亡进程, 是一个多功能信号通路[22]. 在急性胰腺炎中发现, NF-κB过度激活加重胰腺炎损伤, 而抑制NF-κB活化改善胰腺炎损伤[5]. NF-κBp65是NF-κB信号的关键亚单位, 其表达高低与NF-κB激活程度有关. PI3K/Akt也是一个与急性胰腺炎有关的信号转导通路, PI3K/Akt信号抑制剂能够减弱重症急性胰腺炎肠道损伤[23].PI3K、Akt是PI3K/Akt信号通路的关键因子, 二者在正常情况下以没有活性的形式存在, 只有磷酸化以后形成p-PI3K、p-Akt才可以发挥生物学功能[24]. 本实验发现,重症急性胰腺炎大鼠肠组织中NF-κBp65、p-PI3K、p-Akt水平均升高, 而60、120、240 mg/kg的水飞蓟素能够呈浓度依赖性的减少NF-κBp65、p-PI3K、p-Akt蛋白表达, 这提示, 在60-240 mg/kg剂量范围内, 水飞蓟素改善重症急性胰腺炎大鼠肠损伤可能和PI3K/Akt、NF-κB信号通路有关.
4 结论
总而言之, 在60-240 mg/kg剂量范围内, 水飞蓟素能够改善重症急性胰腺炎大鼠肠损伤, 降低机体炎症水平, 减少肠上皮细胞凋亡, 作用机制可能和抑制PI3K/Akt、NF-κB信号激活有关, 这为水飞蓟素治疗重症急性胰腺炎提供了理论数据. 目前对水飞蓟素通过何种机制影响PI3K/Akt、NF-κB信号进而参与重症急性胰腺炎肠道损伤还不清楚, 在以后实验中会进行探讨.
文章亮点
实验背景
重症急性胰腺炎常诱发机体的肠黏膜损伤导致病情加重, 危及患者生命. 减轻肠粘膜损伤, 可加速患者康复.水飞蓟素对急性胰腺炎有治疗效果, 可减轻其急性胰腺炎大鼠模型肺组织损伤程度降低.
实验动机
本研究试图探讨水飞蓟素对重症急性胰腺炎大鼠肠道损伤的改善作用及对PI3K/Akt和NF-κB信号通路的影响,旨在为重症胰腺炎肠道损伤患者的更有效治疗提供有效的药物治疗.
实验目标
本研究旨在通过建立重症急性胰腺炎大鼠肠道损伤模型, 观察不同剂量水飞蓟素对肠道损伤的改善作用, 并分析其对PI3K/Akt和NF-κB信号通路相关蛋白的影响.
实验方法
本研究成功建立重症急性胰腺炎大鼠肠道损伤模型,并给予60 m、120、240 mg/kg的水飞蓟素治疗, 观察大鼠死亡情况, 进行胰腺病理评分和回肠病理评分, 血清中淀粉酶、脂肪酶、IL-1β、TNF-α含量变化, 并采用Western blot检测回肠组织中Bcl-2、Bax、PI3K、p-PI3K、Akt、p-Akt、NF-κBp65蛋白的表达, TUNEL法检测回肠组织中细胞凋亡情况.
实验结果
本实验的结果是在给予水飞蓟素治疗后, 大鼠血清中淀粉酶、脂肪酶以及IL-1β、TNF-α、胰腺病理评分和回肠病理评分均逐渐降低, Bax、p-PI3K/PI3K、p-Akt/Akt、NF-κBp65蛋白水平和细胞凋亡指数均逐渐降低,Bcl-2蛋白表达水平逐渐升高, 水飞蓟素改善了胰腺炎肠损伤情况, 达到了本实验的目的, 对该领域SAP肠损伤的发病进展机制及药物治疗又增加了相关的理论依据, 以后可以进一步在临床方面进行研究应用.
实验结论
水飞蓟素减轻重症急性胰腺炎大鼠肠道损伤, 减轻了肠道病理损伤, 抑制机体中IL-1β、TNF-α水平的升高,其机制可能与降低Bax、p-PI3K/PI3K、p-Akt/Akt、NFκBp65蛋白水平, 升高Bcl-2蛋白表达水平, 减轻肠粘膜细胞的凋亡有关.
展望前景
只是在理论层面上对大鼠模型的研究, 到临床上的研究和应用还有一段距离, 还需进一步研究水飞蓟素对肠粘膜损伤的具体作用机制, 并进一步往临床方向进行相关研究.
