生物炭对农田土壤中酶活性和细菌群落结构的影响研究
2021-08-26韩志旺赵志华张艳利何秋生何丽霞张桂香
韩志旺,赵志华,张艳利,何秋生,何丽霞,张桂香
(1. 太原科技大学环境科学与工程学院,太原 030024;2. 中国科学研究院广州地球化学所,广州 510640)
前 言
山西省的土壤是典型的黄土,土壤养分贫瘠、持水力差,不利于水土保持以及植物生长[1-2]。因此,十分有必要对黄土进行改良。近年来,生物炭作为土壤改良剂引起了世界各国学者的广泛关注,这是因为生物炭具有诸多方面的优点,比如固定碳、减少温室气体排放、调节土壤中微生物群落结构、提高土壤肥力和促进植物生长[3-4]。在土壤改良过程中,土壤酶活性和微生物丰富度是指示土壤健康状况的重要指标[5-6]。关于土壤酶活性,研究表明生物炭对土壤酶活性的影响取决于酶种类和生物炭类型,比如,蛋白酶活性随生物炭的热解温度的升高而显著升高,而热解温度对土壤脲酶活性几乎没有影响[7]。对于微生物群落,大多数研究表明生物炭能够通过改变土壤基本性质和养分,比如pH、阳离子交换量(CEC)、总有机碳(TOC)、氮(N)和磷(P)含量等,进而改变土壤微生物的丰度和群落结构[8-9]。大多数研究表明生物炭对微生物生长具有促进作用[5]。然而,也有研究报道了生物炭能够抑制微生物的生长[10]。这可能是因为生物炭生产的原料、热处理条件和工艺流程对生物炭的物理化学性质和性能有重要影响,导致了不同生物炭对微生物的生长和群落结构组成产生不同的影响。因此,十分有必要考察生物炭原料来源和热解温度对土壤酶活性和微生物群落结构的影响。但是,目前关于生物炭如何影响黄土中酶活性和微生物群落结构的研究还十分有限。
本研究的目的在于以下几个方面:(1)考察生物炭原料来源和热解温度对山西黄土土壤基本性质和营养元素的影响;(2)探讨生物炭对山西黄土中酶活性包括脲酶、蔗糖酶、过氧化氢酶和中性磷酸酶活性的影响;(3)考察生物炭对山西黄土中微生物群落结构的影响,并阐明生物炭及其所引起的土壤环境变化与微生物群落结构变化之间的关系。这些结果将为设计高效、廉价、环保的生物炭作为土壤改良剂用于山西黄土改良提供理论依据和基本数据支撑。
1 材料与方法
1.1 材料
土壤:取自中国山西榆次的某农田表层土(0~20 cm),去除植物残渣及石块后,并在避光条件下自然风干,研磨,过2 mm筛。本研究的土壤中施用过鸡粪堆肥产品。土壤组成:粘土(2.35%),粉砂(11.26%)和细沙(86.39%)。土壤pH按照土-水比例为1∶2.5(w/v)混匀,用pH计测定,其值为7.68±0.02。土壤有机质(SOM)采用K2CrO7容量-外加热法测定,含量为(47.81±1.54)g/kg,阳离子交换量采用乙酸铵交换法测定,土壤CEC值为(30.51±0.93)cmol/kg。总磷(TP)按照中国农业行业标准NY/T88-1988 NaOH熔融-钼锑抗比色法测定。总氮(TN)采用凯氏定氮法测定。
生物炭:本研究中使用的生物炭是将不同原材料包括核桃壳(WS)、玉米轴(CC)和玉米秸秆(CS)分别在250℃、400℃和600℃的马弗炉中缺氧热解4 h,冷却至室温后,将马弗炉中的生物炭取出,过100目筛子,得到的生物炭分别记作WS2、WS4、WS6、CC2、CC4、CC6、CS2、CS4和CS6。所有生物炭的pH调整至近中性(6.71~7.66)待用。
1.2 试验设计
生物炭改良土壤:将生物炭与土壤分别以0%和1%的质量比混合均匀。未加生物炭的土样记作UCK,对应生物炭处理的土样分别记作UWS2、UWS4、UWS6、UCC2、UCC4、UCC6、UCS2、UCS4和UCS6。每组重复两次。每两天称重、补充水分,使其水分保持在最大持水量的70%。老化之后,将土样冷冻干燥,并过0.15 mm筛,以待进一步分析。
1.3 酶活性测定
脲酶活性采用苯酚-次氯酸钠比色法测定。取0.4 g的冷冻干燥土样,与0.5 mL甲苯混合,10 min后加5 mL 10%尿素溶液和10 mL的柠檬酸盐缓冲溶液(pH 6.7),摇匀后在37 ℃恒温箱培养24 h,培养结束后过滤,取0.5 mL滤液用超纯水稀释至50 mL,再加4 mL苯酚钠溶液(6.75 mol/L)和3 mL次氯酸钠溶液(活性氯为0.9%),随加随摇匀,最终定容至50 mL。20 min后显色,利用分光光度计于578 nm波长处比色测定。脲酶活性以24 h后1 g土壤中生成氨的毫克数表示。
蔗糖酶采用3,5-二硝基水杨酸比色法测定。方法如下:称取0.4 g的冷冻干燥土样,注入15 mL 8%蔗糖溶液,5 mL磷酸缓冲液(pH 5.5)和5滴甲苯。摇匀混合物后,放入恒温箱,在37 ℃下培养24 h。吸取滤液0.5 mL至容量瓶中,加3 mL DNS试剂,摇匀后,在沸腾的水浴锅中加热5 min,随即将容量瓶移至自来水流下冷却3 min。溶液因生成3-氨基-5-硝基水杨酸而呈橙黄色,最后用蒸馏水稀释至50 mL。在分光光度计上于508 nm处进行比色。蔗糖酶活性以24 h,1 g土样生成葡萄糖的毫克数表示。
过氧化氢酶活性用高锰酸钾滴定法测定。称0.5 g的冷冻干燥土样,加入40 mL蒸馏水,加5 mL 0.3%的H2O2溶液,震荡20 min后,加入5 mL 3 mol/L硫酸溶液,吸取滤液25 mL,用0.1 mol/L高锰酸钾溶液滴定至淡粉色,过氧化氢酶活性以1 min内1 g土壤消耗的高锰酸钾的毫升数表示。
中性磷酸酶的测定方法如下:称2 g土样,加5滴甲苯和20 mL 0.5%磷酸苯二钠溶液(柠檬酸盐缓冲液),仔细摇匀后放入恒温箱,于37 ℃下培养24 h。然后在培养液加入40 mL 0.3%硫酸铝溶液并过滤。吸取10 mL滤液于50 mL容量瓶中,稀释定容,最后,于分光光度计上660 nm处比色。中性磷酸酶活性以24 h后1 g土壤中释放的酚的毫克数表示。
1.4 基于高通量测序法的细菌群落结构分析
从土壤中提取的DNA经0.8%琼脂糖凝胶电泳检测。本研究选择长度为450 bp的细菌16S rRNA的高度可变V3V4区域进行测序。用引物338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)作为16S rRNA基因的细菌特异性片段。PCR条件由最初在变性步骤为98 ℃(30 s)。紧随其后的是27个周期以下步骤:98 ℃(15 s)、50 ℃(30 s)、72 ℃(30 s)。在72 ℃保持5 min,最后在4 ℃退火10 min。每个样本进行了一式三份,然后把它们混合在一起。2%琼脂糖凝胶电泳扩增结果,用Axygen凝胶回收试剂盒对目标片段进行切割回收。使用Quant-iT PicoGreen dsDNA检测试剂盒对Microplate reader(BioTek, FLx800)上的PCR产物进行定量,然后根据每个样品所需的数据量混合样品。取1 μL文库,在Agilent Bioanalyzer机器上用Agilent High Sensitivity DNA Kit对文库做2100质检,合格的文库应该有单一的峰,无接头。利用Quant-iT PicoGreen dsDNA Assay Kit在Promega QuantiFluor上对文库进行定量,合格的文库计算后浓度应在2 nmol/L以上。对合格的文库,我们在MiSeq机器上利用MiSeq Reagent Kit V3(600cycles)进行2×300 bp的双端测序。首先将需要上机的文库(Index不可重复)梯度稀释到2 nmol/L,然后按所需数据量比例混样。混好的文库经0.1 mol/L NaOH变性成单链进行上机测序。所上文库量的多少可根据实际情况控制在15~18 pmol/L之间。
1.5 数据分析
数据采用IBM SPSS Statistics 22.0进行统计分析。差异的统计学意义通过单因素方差分析(ANOVA)和Tukey post-hoc检验确定。采用单因素方差分析(ANOVA)的置信区间为95%,P<0.05为差异达到显著性水平。利用Canoco 5.0软件对考察环境因子对酶活性和微生物群落组成影响进行了冗余分析(RDA)。使用QIIME软件,对UniFrac PCoA分析得到基于微生物系统发育关系的群落样本空间分布特征,量化样本间的差异和相似度。采用Weighted UniFrac距离侧重描述由群落成员丰度梯度的改变导致的样本差异。
2 结果与讨论
2.1 生物炭的基本理化性质
生物炭的元素组成和原子比见下表。随着热解温度的升高,生物炭中碳(C)含量均有所增加,但氢(H)和氧(O)含量降低。相比之下,生物炭中的N含量因原料来源和热解温度而发生变化,但是无明显的规律性。H是主要与植物有机质有关的,因此,生物炭的炭化程度可以通过H/C原子比来估算[11]。生物炭的H/C比值随热解温度的升高而降低,说明生物炭中原始有机质组分减少,并且生物炭的炭化程度提高。(O+N)/C比值降低表明极性基团数量的减少[11]。随着热解温度的升高,生物炭中的灰分含量增加。比表面积分析结果表明,随着热解温度的升高,比表面积(SA值)增大。特别是600 ℃下制备的生物炭具有大的比表面积,其SA值大于200 m2/g,表明具有较多微孔结构的存在。
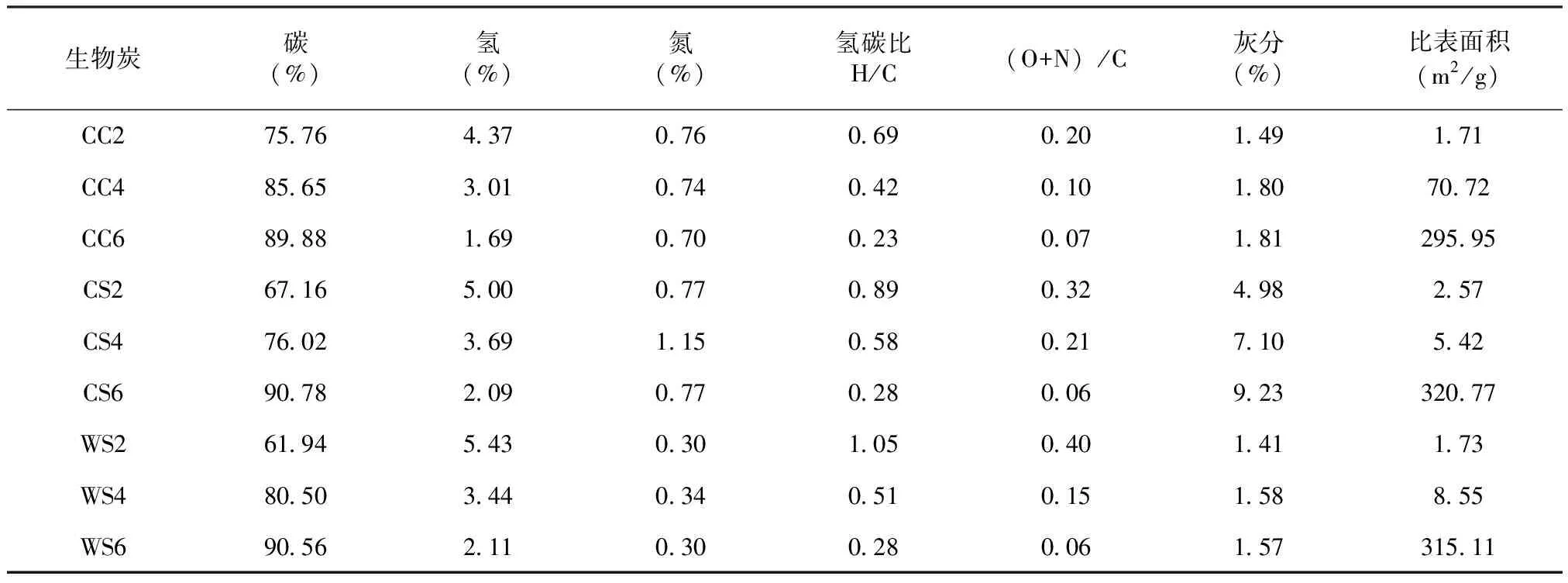
表 生物炭的基本理化性质Tab. Physical and chemical properties of biochar
2.2 生物炭对土壤性质的影响
图1给出了生物炭对土壤性质(pH、SOM和CEC)的影响。与对照组相比,生物炭(除了WS6之外)未能显著改变土壤pH(P>0.05)。一方面,生物炭的施用量较少,不足以对弱碱性土壤产生较大影响[12];另一方面,生物炭的pH均调至近中性。生物炭(除CS6、WS4和WS6外)通常增加土壤SOM含量达7%~26%,但是其差异不显著(P>0.05)。其他报道中也得到了类似的结果[7,13-14]。生物炭(除了CC2和CC6外)降低了土壤CEC,尽管此差异并不显著(P>0.05)。此发现不同于先前的研究[13],它报道了生物炭显著增加土壤CEC值。造成不同结果的原因可能是由于土壤中含有鸡粪堆肥[15]。
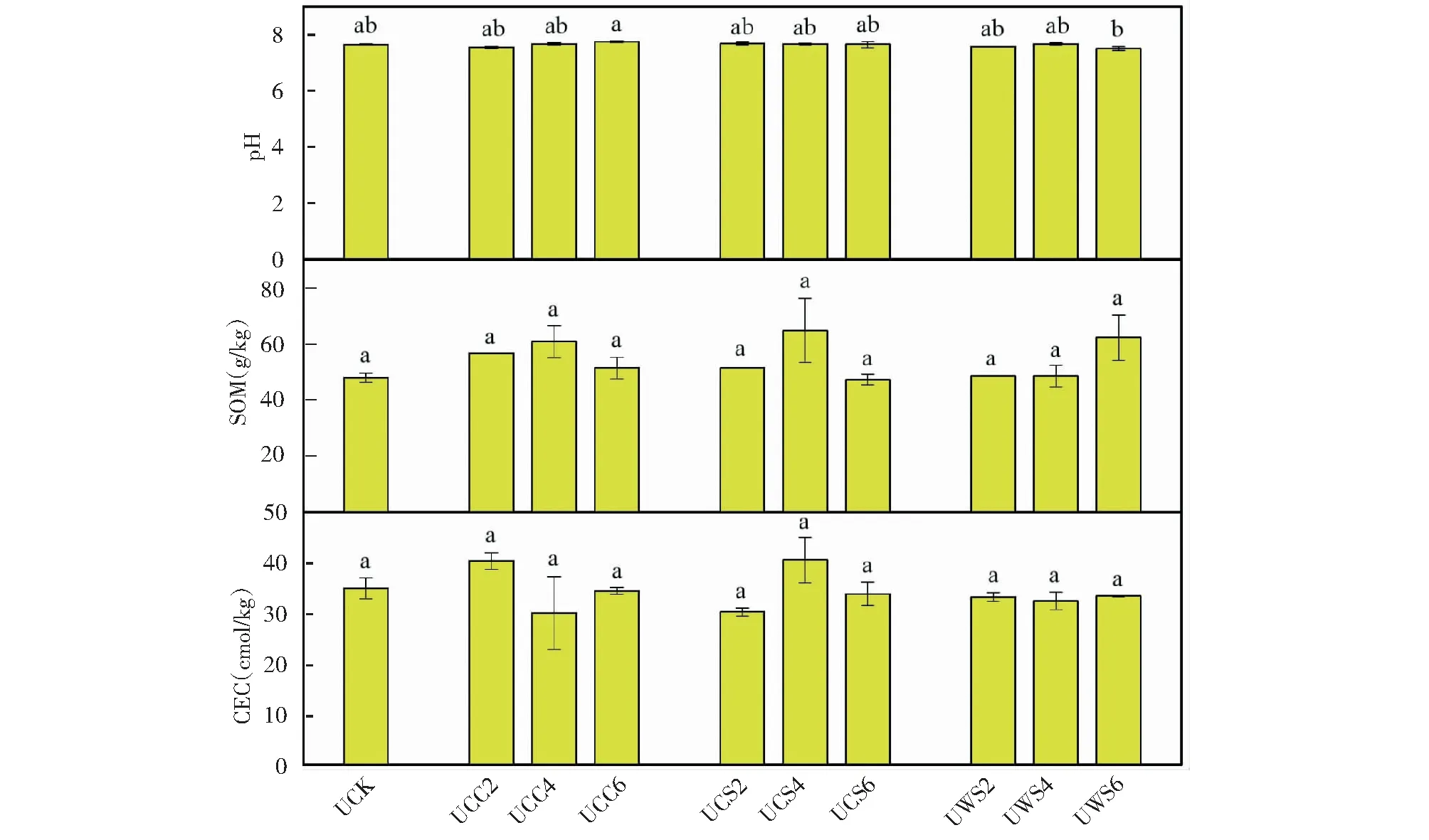
图1 生物炭对土壤pH,土壤有机质(SOM)和阳离子交换量(CEC)的影响Fig.1 The effects of biochars on soil pH, soil organic matter (SOM), and cationic exchange capacity (CEC)
图2给出了生物炭对土壤中营养元素的影响。与对照组相比,生物炭对土壤TN几乎没有影响。
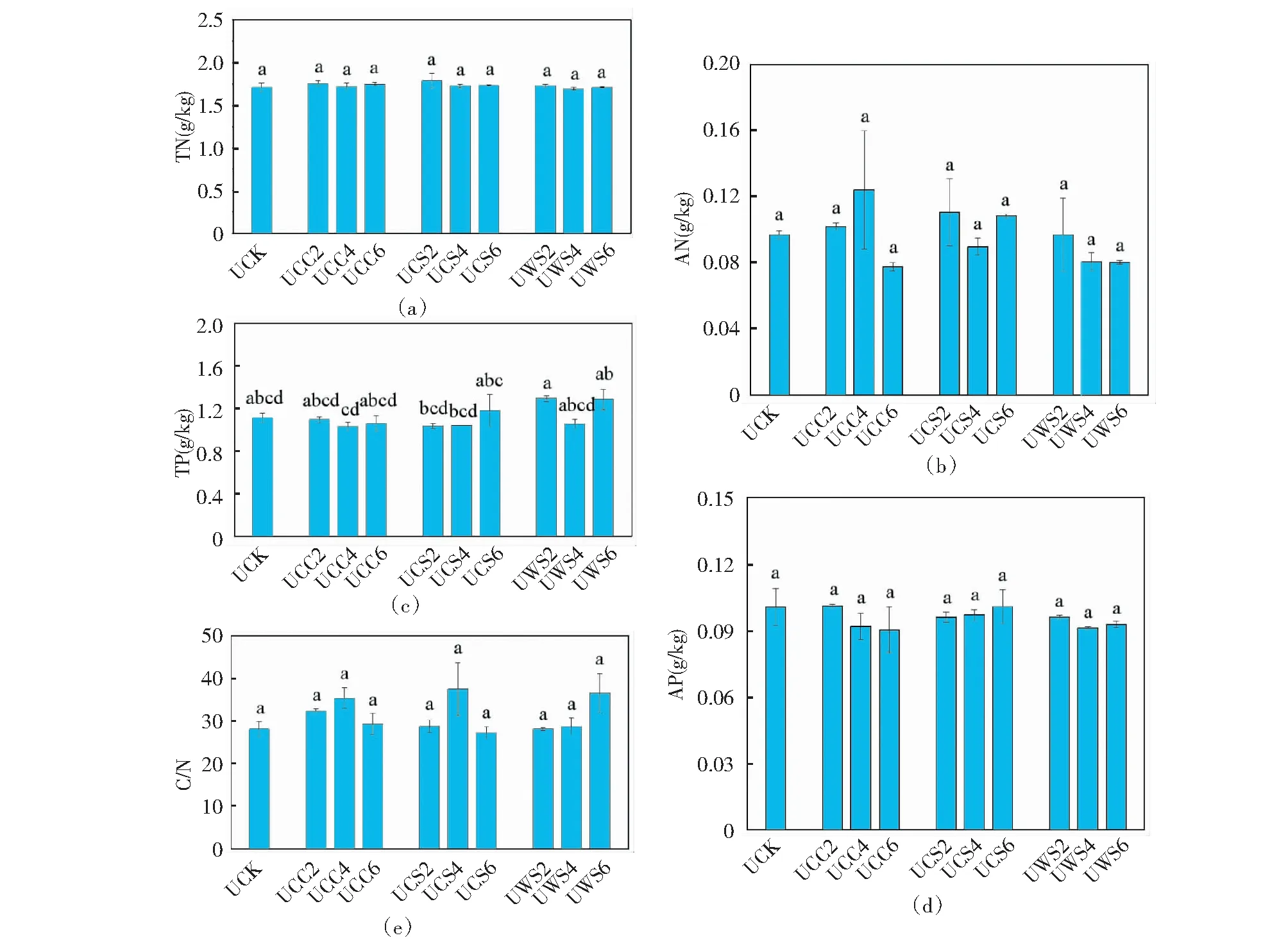
图2 生物炭对土壤营养元素的影响Fig.2 The effects of biochars on soil nutrients
相反的是,它略微降低了土壤的速效氮(AN)含量(除UCC4、UCS2和UCS6之外),尽管差异并不显著(P>0.05)。此结果与之前的研究相一致[16]。对于P来说,CS6、WS2和WS6对土壤TP略有增加,而其他的生物炭则稍微降低了土壤TP含量;生物炭通常减少了土壤中速效磷(AP)的含量,这不同于我们先前的研究[16]。出现这种矛盾的原因可能是本研究的土壤中含有鸡粪堆肥造成的。堆肥中含有的P含量一般高于生物炭[5,9]。就土壤C/N而言,CC2、CC4、CS4和WS6增加了土壤C/N比,尽管这个差异不显著(P>0.05),而其他的生物炭则对土壤C/N几乎没有影响。土壤C/N比增加可能是由于生物炭本身具有较高的C/N比[5]。
2.3 生物炭对土壤酶活性的影响
图3给出了生物炭对土壤酶活性(蔗糖酶、脲酶、中性磷酸酶和过氧化氢酶)的影响。与对照组相比,生物炭(除了CS4、CC6和WS4外)降低了土壤的蔗糖酶活性,虽然此差异不明显(P>0.05)。类似地,生物炭降低了土壤中性磷酸酶的活性,UCS2、UCS4、UWS2和UWS6处理的土样中,其结果差异较显著(P>0.05)。不同于前两种酶,生物炭(除WS2外)略微增强了脲酶活性,尽管这个差异没有显著性(P>0.05)。先前也有研究报道生物炭处理的土壤,其蔗糖酶活性随时间的推移而降低,而对脲酶来说,则是刚开始具有增强作用,然后逐渐抑制其活性[17]。生物炭对土壤过氧化氢酶活性几乎没有影响(P>0.05)。此结果不同于原先的研究,它报道生物炭可以增强土壤过氧化氢酶活性[18]。有研究报道酶活性与生物炭的H/C原子比之间具有显著的正相关关系,而与其表面积呈现明显的负相关性[18]。然而,本研究中冗余(RDA)结果表明(图4),生物炭的H/C比与酶活性(除了蔗糖酶)之间呈现强烈的负相关关系,而生物炭的pH、电导率(EC)、SA对土壤脲酶和中性磷酸酶活性具有促进作用。这些不同结果表明土壤中添加生物炭,对其酶活性具有不同的影响。RDA中生物炭处理组与CK组的距离较远,进一步说明生物炭对土壤中酶活性具有影响。不同生物炭处理组也较为分散,这一结果表明生物炭的差异包括原料来源和热解温度对土壤中酶活性的影响不同。

图3 生物炭对土壤中酶活性的影响Fig.3 The effects of biochars on enzyme activities in soil

图4 冗余分析生物炭和土壤性质对酶活性的影响Fig.4 Redundancy analysis (RDA) for the effects of biochars and soil properties on enzyme activities in soil
2.4 生物炭对细菌丰度和多样性指数的影响
细菌的丰度主要用Chao1和ACE指数描述。细菌多样性(均匀度)主要用Shannon和Simpson指数来描述。与对照组相比(Chao1:3232;ACE:3384),CC2略有增加Chao1(3278)和ACE(3443),而其他生物炭普遍减少Chao1(2407~3183,除了WS6)和ACE(3167~3317)。其中CS4使得Chao1和ACE,分别显著降低了25%和28%。与丰度指数不同,生物炭对Shannon和Simpson指数的影响不明显。这些结果表明,除CC2外,生物炭对土壤中细菌的丰度具有负面影响,对土壤中细菌的多样性影响不大。Xu等[17]也报道了生物炭在实验结束时降低了水稻土壤中的细菌丰度。然而,在他们的研究中,生物炭增加了细菌的多样性,这与本研究的结果不同。Zheng等[8]也报道了生物炭增加了水稻土壤中的细菌多样性。导致差异的原因很可能与这些研究中不同的生物炭和土壤特性有关。
基于Weighted Unifrac距离进行PCoA分析结果表明(图5),PC1和PC2两个轴分别解释了48.7%和23.4%的细菌群落变化。不同生物炭处理组在PC1轴上的投影均与对照组在PC1轴上的投影具有一定的距离,表明生物炭对土壤中微生物群落结构产生影响。玉米秸秆(CS)生物炭处理组与核桃壳(WS)生物炭处理组在PC1轴上的投影比较接近,而玉米轴(CC)生物炭处理组在PC1轴上的投影距离较远。这一结果表明,玉米秸秆和核桃壳生物炭对土壤中微生物群落结构的影响程度更为接近,而与玉米轴(CC)生物炭处理土壤中微生物群落结构相差较大。除了UCC4,其余生物炭处理组在PC2轴上的投影较为接近。这些结果表明生物炭的原料来源是影响微生物群落结构的关键因素,而生物炭的热解温度对细菌群落结构的影响较小。
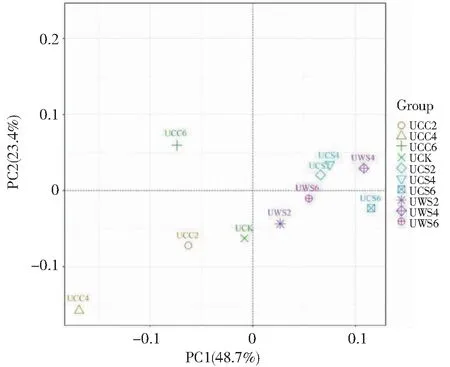
图5 不同处理组微生物群落结构的主成分分析(PCA)Fig.5 Principal component analysis of microbial community structures in different treatment groups
2.5 生物炭对土壤中细菌组成的影响
许多研究表明,生物炭可以改变微生物群落组成,从而影响土壤中污染物的生物降解[19~21]。为了研究生物炭对细菌群落组成的影响,对门级优势菌进行了分析(图6)。放线菌在对照和经生物炭处理的土壤中都是优势门,占37%~46%。放线菌属革兰氏阳性菌,已知在分解纤维素、甲壳素等难降解有机化合物方面发挥重要作用[8,20]。其次是变形杆菌门、酸杆菌门和绿弯菌门,分别占20%~22%、11%~15%和10%~11%。其他细菌门低于10%。与对照组相比,除CC2和CC4外,生物炭处理的土壤中,其放线菌丰度略有下降,降幅为5%~15%。我们的结果与Ali等[20]的研究结果相反。Ali等[20]的研究显示,生物炭显著增加了高农药污染农业土壤中的放线菌的丰度。然而,我们的结果与Zheng等[8]报道的结果一致,这一发现归因于较低的土壤有机质降解率,以及随后较慢的有机碳转化率。一般情况下,在生物炭处理的土壤中,伴随着放线菌的抑制,变形杆菌、酸杆菌和芽单胞菌的丰度略有增加。这一结果表明,生物炭为大多数细菌提供了良好的生境[9,22]。

图6 生物炭对土壤中门级细菌群落结构的影响Fig.6 Effects of biochars on bacterial composition at phylum level
2.6 环境变量与微生物群落组成之间的关系
采用冗余分析法(RDA)来研究生物炭和土壤性质对其混合土壤中微生物群落结构在门水平上的影响。RDA结果显示(图7),RDA的前两个轴分别表明总变异量的68.37%和19.84%。芽单胞菌门、硝化螺旋菌门、酸杆菌门和浮霉菌门与生物炭的灰分之间具有正相关性。其他研究也有报道生物炭对酸杆菌门和芽单胞菌门具有相似的影响[17]。生物炭与这些细菌之间的相似关系可能是由于协同效应[20]。有研究报道酸杆菌门和芽单胞菌门不依赖于生物炭的可利用基质,而与生物炭所提供的适宜生境有关[17,22]。生物炭的灰分中含有Ca2+、Mg2+、K+和P等营养元素,能够为特定的细菌提供营养物质[23-24]。然而,生物炭中的灰分与放线菌门和厚壁菌门均具有显著的负相关关系,表明生物炭中的灰分不利于这两类细菌的生长。变形菌门与土壤中的总氮和可利用氮具有正相关关系。以往的研究已经证实了变形菌门的丰度与土壤中有机氮的矿化具有紧密的关系[25]。拟杆菌门与生物炭的(O+N)/C和H/C具有正相关性,表明较低温度下制备的生物炭能够为拟杆菌门微生物提供较好的生长环境。绿弯菌门能够促进含氯有机物的脱氯反应[26]。生物炭比表面积与绿弯菌门丰度具有正相
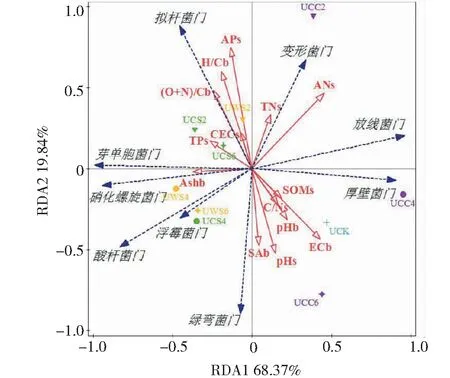
图7 生物炭和土壤性质对微 生物群落结构影响的冗余分析(RDA)Fig.7 Redundancy analysis for the effects of biochar and soil properties on microbial community structures
关关系,这可能是因为生物炭较大的比表面积为绿弯菌门的生长提供了庇护所。以往的研究已经报道了某些微生物可以通过以生物炭的孔隙为栖息地来对抗捕食者或竞争对手的威胁,从而使自身受到更好的保护[5]。厚壁菌门和放线菌门与芽单胞菌门、硝化螺旋菌门和酸杆菌门之间具有显著的负相关关系。变形菌门与浮霉菌门和绿弯菌门之间呈现显著的负相关性。这些结果表明,土壤中微生物之间具有相互促进(正相关关系)或者相互制约(负相关关系)的关系。
3 结 论
本研究考察不同生物炭对农田土壤酶活性和细菌群落结构的影响。结果表明:生物炭对土壤酶活性的影响主要与酶的种类有关;生物炭通常降低了土壤中细菌的丰度,而对细菌多样性影响较小;与对照组相比,生物炭(除了玉米轴生物炭)使放线菌丰度降低了5%~15%,伴随着放线菌的减少,变形杆菌、酸杆菌和芽单胞菌的丰度略有增加,表明生物炭改变了土壤中的细菌群落结构。冗余分析(RDA)结果表明,门级细菌群落丰度对生物炭和土壤性质的响应与细菌类型有关。尽管大多数研究表明生物炭能够刺激微生物的生长,但是本研究的结果表明生物炭对微生物群落结构的影响受到生物炭类型和微生物类型的影响。因此,在生物炭应用于农田土壤时,应充分考虑生物炭对土壤生态学的影响。
