赤潮藻米氏凯伦藻抑藻细菌的筛选及鉴定*
2021-08-26丁宁
丁 宁
(曲阜师范大学生命科学学院,273165,山东省曲阜市)
0 引 言
赤潮(Red tides),国内外学者称之为“有害藻华”(Harmful algal blooms)的一种,它是海洋中一些有毒有害微藻、大型藻或蓝细菌等生物量在一定环境条件下暴发性增长或高度聚集达到某一水平,引起局部海域水体变色,影响和危害水生生态系统以及人类健康的现象[1-2].赤潮被研究学者普遍划分为两大类别—无毒赤潮与有毒赤潮.无毒赤潮是指赤潮生物本身不具毒性或不分泌有害毒素.有毒有害赤潮是指以赤潮生物体内含有某种毒素或能分泌毒素的生物为主形成的赤潮[3].当前,有毒有害赤潮的治理方法已成为全球区域内海洋生态环境方向的研究内容.物理和化学治理有害藻华的方法立竿见影,但是容易导致二次海洋生态环境污染问题.人们将赤潮防治领域的研究热点聚焦于生物控藻方法.目前,生物防治赤潮主要有两大研究方向:一是大型海藻与赤潮微藻间的相生相克及营养竞争作用[4].当前大型海藻对赤潮微藻的抑制作用主要集中在研究克生物质的分离提取、克生机理的探究等方面[5];二是利用细菌、真菌、病毒等微生物方法控藻.微生物是海水中调节藻类种群动态平衡的潜在因子,它们繁殖速度快、具有宿主专一性,是一种非常有潜质的有害赤潮调控因子[3].在生物进化过程中,海洋微藻和细菌之间形成了复杂的生态关系.微藻能够向周围分泌有机物,这些有机物可以吸引大量以细菌为主的微生物,并且能够刺激细菌的生长因子[6];而细菌代谢后形成的简单有无物或者有机物,又能为微藻提供营养盐和必要的生长因子,从而调节藻类的生长、繁殖、孢囊形成、形态改变、致死率[7],这类细菌成为依附于微藻生长环境的“藻际细菌”.有一类细菌可以通过直接或者间接的方式抑制赤潮藻的生长、杀死或溶解赤潮藻细胞,这类细菌称为抑藻细菌[8].由于细菌具有分布广、繁殖快、无二次污染等特点,细菌抑藻已成为防治赤潮的重要方向.
米氏凯伦藻(Kareniamikimotoi)作为典型的有毒有害海洋赤潮藻类,隶属于甲藻门,裸甲藻目,凯伦藻属,常见于温带和亚热带的近海水域.自上世纪30年代以来,人们就发现这种藻类的大量繁殖,导致了许多国家沿海水域的鱼类、贝类和其他无脊椎动物大量死亡[9].因此,分离筛选和鉴定抑藻细菌,探究抑藻细菌的多样性,为防治米氏凯伦藻赤潮的爆发提供理论依据.
1 材料与方法
1.1 实验材料
1.1.1 供试藻种及培养
实验用米氏凯伦藻(Kareniamikimotoi)藻株从中国海洋大学微藻培养室购入.微藻培养在光照培养箱中进行,温度为(20±1) ℃,光照强度为2500 μmol m-2s-1,光暗比为12 h∶12 h,pH=7.5±0.1,盐度为30±1.0.实验所用天然海水均通过0.45 μm的膜过滤,121 ℃高压蒸汽灭菌20 min,每天定时摇动微藻培养瓶4~5次,以防止微藻附壁生长.
1.1.2 藻种及细菌培养基
米氏凯伦藻培养用f/2培养液[10].细菌培养基为2216E培养基:陈海水1000 mL、蛋白胨5.0 g、酵母膏1.0 g、磷酸高铁0.1 g[11].
1.2 实验方法
1.2.1 米氏凯伦藻生长曲线的测定采用血球计数法对微藻计数.取1 mL摇匀的米氏凯伦藻藻液加入一滴鲁格试剂进行固定,混匀取20 μL滴于血球计数板上,于光学显微镜(10×40)下观察计数,每24 h观察记录一次,记录7 d,实验设置3组平行.
1.2.2 米氏凯伦藻异养细菌的分离纯化
在超净工作台中取米氏凯伦藻藻液10 mL稀释成不同的浓度梯度,各取100 μL至高温灭菌后的2216E固体培养基上中,用涂布棒均匀涂布,将其倒置于21 ℃培养箱中培养.待平板中出现肉眼可见的大小、颜色、形态不同的单菌落,进而分离纯化.将单菌转移至2216E液体培养基(经高温灭菌)中,于温度21 ℃、转速100 r min-1条件的摇床中培养.为保证单菌的纯度用同样方法分离纯化3次.将纯化后的单菌用15%的甘油于-80 ℃超低温冰箱中保存备用[12].
1.2.3 细菌DNA提取及基因序列扩增
对待测菌株用AXYGEN AxyPrep基因组提取试剂盒提取细菌DNA.以正向27F和反向1492R为引物进行PCR系列反应[13].PCR(LC480Ⅱ型)扩增体系和反应程序为:TaqDNA聚合酶0.5 μL,dNTPs 1 μL,27F 1 μL、1492R 1 μL,DNA 1 μL,ddH2O 15.5 μL;96 ℃预变性2.5 min,96 ℃扩增30 s,60 ℃退火30 s,70 ℃延伸30 s,循环35次后,70 ℃延伸4 min.取PCR产物进行琼脂糖凝胶电泳,用凝胶图像处理系统观察并选取条带明亮且单一的扩增子送北京奥科鼎盛生物科技有限公司测序.
1.2.4 DNA序列分析
将测序所得的序列在GenBank中与已有的细菌16S rRNA序列进行blast比对以确定其进化地位和亲缘,序列差异小于3%的被认为属于同一种系型,Clustal X建立aln文件,用Mega 6.0软件中neighbor-joining算法对菌株系统发育树进行构建.
1.2.5 抑藻效果的测定
将分离纯化的单菌于2216E液体培养基中培养3 d,然后以体积比为3%和5%的细菌菌液添加至100 mL指数生长期的米氏凯伦藻培养液中进行共培养,以添加无菌2216E液体培养基为对照组,每24 h观察米氏凯伦藻的生长情况,计数藻细胞数量,观察藻细胞形态结构变化,实验设置3组平行.
1.3 数据分析
使用Microsoft Excel 2010软件完成数据处理与统计分析.通过单因素方差分析(One-way ANOVA)检验处理组与对照组之间的差异显著性,P<0.05表示具有显著性差异.
2 实验结果与讨论
2.1 米氏凯伦藻生长曲线
通过光学显微镜下血球计数法对米氏凯伦藻细胞计数,由图1可见,米氏凯伦藻的生长可分为平稳增长期、指数生长期和生长延滞期.藻细胞在前两天处于缓慢增长期,随即进入指数生长期,在第3天处于缓和后又进入二次指数生长期,直至第7天藻细胞密度生长缓慢(未列出),进入生长停滞期.米氏凯伦藻(Kareniamikimotoi)是我国沿海一种分布广泛的鱼毒性赤潮微藻,通过对藻细胞生长周期的测定,为抑藻菌的筛选及分离奠定基础.

图1 米氏凯伦藻的生长曲线
2.2 米氏凯伦藻异养细菌的分离
从米氏凯伦藻培养液中分离纯化得到了5株细菌2号至7号(图2),菌落形态不一,颜色各异,见下图.这些细菌均可以在2216E培养基中快速生长繁殖.
藻际异养细菌对于微藻的生长、繁殖和代谢活动都起着非常重要的作用,近年来对海洋细菌的关注已越来越多,分离鉴定方法也越来越多,传统的平板涂布划线方法能够有效地分离筛选获得单菌菌落,然后通过表型和化学方法加以初步鉴定.
图2 细菌菌落形态及颜色
2.3 16S rRNA基因序列测序结果
对6株细菌进行16S rRNA基因序列扩增,PCR产物跑电泳后,经凝胶图像观察6株细菌的条带明亮且单一(图3),送测序公司公司测序.将测序所得的6株米氏凯伦藻异养细菌的16S rRNA基因序列在NCBI上与所存在的序列进行对比,结果表明,6株细菌的基因序列与数据库中已知的序列相似达96%~99%,其中包含Kocuriasp.,Paracoccussp.,Halomonassp.,Joostellamarina,Idiomarinasp.和Halobacillusalkaliphilus.
有些菌种的鉴定仅通过传统的表型及化学方法无法满足,随着分子生物学方法研究的开展,目前16S rRNA序列方法已经成为细菌系统分类学研究中常用也是最有效的分子指标,被广泛应用于海洋、陆地等微生物的遗传特性和分子差异的研究[14].利用分子生物学方法研究海洋藻类共生细菌群落的组成,是简单、快捷又有效的一种方法.

图3 PCR产物凝胶成像电泳检测
2.4 抑藻效果
将分离获得的6株异养细菌与米氏凯伦藻进行共培养观察并记录7 d,与对照组相比,其中一株米氏凯伦藻藻液颜色变浅,藻细胞数量减少,藻细胞形态结构发生破损变化,初步判定这株菌具有一定抑藻效果,即副球菌属(Paracoccussp.).抑藻实验结果表明(图4),对照组中,藻细胞密度从初始3×104cells·mL-1逐渐增加至第7 d的2.3×105cells·mL-1.由图可知,随着副球菌菌液作用浓度的升高,米氏凯伦藻密度随时间延长呈现降低的趋势.在1%副球菌液浓度下,仅在第1 d时藻细胞密度呈现下降趋势,藻细胞密度随即开始上升,在第2 d后抑藻菌对米氏凯伦藻表现为生长促进作用(负抑制)(P>0.05).这一现象普遍被认为是低浓度的毒物对微藻生长产生了刺激效应[15].当副球菌浓度为3%时,1 d以后即对米氏凯伦藻细胞的生长表现出显著的抑制效应(P<0.05),抑藻率维持在95%以上.在5%作用浓度下,副球菌对米氏凯伦藻呈现出最大的抑制效果,且随时间的延长抑藻效果增强(P<0.05).实验结果表明本课题组从微藻生长环境中分离得到的副球菌株对有害赤潮藻米氏凯伦藻的生长具有短期有效的灭杀效果,且作用浓度在3%以上时抑制效果尤为显著.
越来越多的报道研究表明,在赤潮发生和消失过程中,细菌群落与赤潮藻华的组成、繁殖和生理状态密切相关.目前,许多对赤潮藻有抑制作用的溶藻微生物被从赤潮微藻生长繁殖的环境中分离得到,例如,谭烁(2016)在赤潮发生的海水样本中分离获得希瓦氏菌和芽孢杆菌能够诱导有害微藻球形棕囊藻发生细胞程序性死亡[16].

图4 副球菌对米氏凯伦藻生长的影响
2.5 抑藻菌进化树分析
对所测得的抑藻细菌副球菌与在NCBI数据库中同源性高的细菌16S rRNA序列构建系统发育树(图5).由图可知,基于16S rRNA的米氏凯伦藻抑藻菌隶属于副球菌(Paracoccussp.).副球菌细胞呈球状或短杆状,为革兰氏阴性菌,缺乏运动能力,属于好氧菌,当硝酸盐、亚硝酸盐或氧化氮存在时能以它们为电子受体营厌氧生长,常出现在土壤、天然和人工的盐水中.本文中对米氏凯伦藻产生抑制作用的一株副球菌被从微藻生长的天然海水中分离得到.龚诗雁等(2014)从米氏凯伦藻藻际环境中分离到一株异养细菌,其与黄杆菌属(Flavobacterium)序列相似度达99%,有研究表明,黄杆菌属能诱导孔石莼形态发生变化,是常见的抑藻细菌[17].
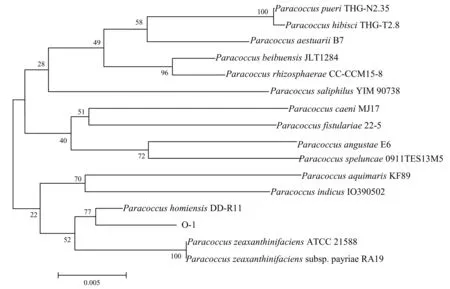
图5 基于16S rRNA的米氏凯伦藻抑藻菌系统发育树
3 结 论
米氏凯伦藻因其分泌溶血性毒素是一种有毒藻类.本文从米氏凯伦藻生长环境中筛选得到1株具有潜在抑藻活性的细菌,通过分子生物学16S rRNA序列分析方法分析,抑藻细菌隶属于副球菌属(Paracoccussp.).通过藻菌共培养试验表明,副球菌对米氏凯伦藻的生长呈现出短期高效的抑制效果,且抑藻效果随着菌液作用浓度的增加和作用时间的延长而增强.本研究表明,米氏凯伦藻抑藻细菌存在于海洋环境中,抑藻菌副球菌的分离获得及抑藻活性的探究也为研究赤潮的防治提供了重要的理论依据.
