金属有机骨架材料在中药研究的应用进展
2021-08-24蔡梦如尹东阁王开心胡雪凌刘曼婷董晓旭曲昌海尹兴斌
蔡梦如,姚 宇,尹东阁,王开心,胡雪凌,刘曼婷,董晓旭,曲昌海,尹兴斌,倪 健
·综 述·
金属有机骨架材料在中药研究的应用进展
蔡梦如,姚 宇,尹东阁,王开心,胡雪凌,刘曼婷,董晓旭,曲昌海,尹兴斌*,倪 健*
北京中医药大学中药学院,北京 102488
金属有机骨架材料(metal organic frameworks,MOFs)是由金属离子中心与有机配体连接而成的杂化多孔晶体材料,具有比表面积大、孔径可调、活性位点丰富、生物相容性良好的优点,被广泛用于气体储存、吸附、提取、催化及药物递送等领域。近年来,MOFs在中药研究领域的应用也越来越广泛,主要用于中药有效成分的缓控释放、靶向递送、改善药物的溶解性、增加药物的稳定性、降低药物的毒副作用等。此外,MOFs在中药成分的提取分离及检测方面也有诸多应用。综述近年来MOFs在中药研究领域的应用进展,以期为MOFs在中药研究中的进一步应用提供参考,为中药成分的新型递药系统研究提供新思路。
金属有机骨架材料;中药;靶向递药;缓释递药;催化;吸附;提取分离;检测
金属有机骨架材料(metal organic frameworks,MOFs)又称多孔配位聚合物,是由金属离子中心与有机配体连接而成的杂化多孔晶体材料,是一类具有优良特性的纳米材料[1]。与其他传统纳米材料相比,MOFs具有高的孔隙率和比表面积、可调的结构与功能、良好的生物相容性[2-4]等特点,可满足多个领域发展的需求。近年来,基于MOFs的应用引发了广泛关注,在吸附[5]、催化[6]、化学传感[7]及药物递送[8]等领域均具有较多的研究报道。为了满足不同的需求,研究者们已经开发出包括溶剂热法、三乙胺快速沉淀法、电化学法、机械化学法及微波法等各种合成方法。
为改善部分中药成分溶解度低、稳定性差、生物利用度低等现状,降低中药潜在毒性,提高中药成分提取分离和催化的效率及检测的灵敏度,MOFs受到研究者的广泛关注。MOFs是由有机单元和无机单元组成的网状多孔材料[2]。金属离子中心和有机配体的丰富性,使得MOFs的多样性成为可能,理论上可以合成千万种MOFs。目前常见的几大类MOFs包括网状金属有机骨架材料(isoreticular metal organic frameworks,IRMOFs)[9]、拉瓦希尔骨架系列材料(materials of institute lavoisiers,MILs)[10]、层状结构系列材料(coordination pillared-layers,CPLs)[11]、类沸石咪唑酯骨架系列材料(zeolitic imidazolate frameworks,ZIFs)[12]、孔-通道式骨架系列材料(porous coordination networks,PCNs)[13]、锆基三维微孔骨架系列材料(university of Oslos,UIOs)[14]、浙江大学合成系列材料(Zhejiang University MOFs,ZJUs)[15]、“孔笼- 孔道”结构MOFs[16]、混合配体MOFs[17]、混合金属MOFs[18]等,各类型MOFs具有不同的结构及功能特性,可以满足不同的需求。其优良的特性,允许MOFs与其他各种生物材料杂化使用。目前,各种新型多功能MOFs仍在开发中,出现了基于MOFs的复合材料,复合材料表现出优于单一材料的新特性[1]。目前,已有大量研究将MOFs的优异性能引入中药领域,MOFs独特的结构特征及功能特性为中药成分的递送、吸附、催化、提取分离及检测提供了便利。本文针对近年来MOFs在中药领域方面的研究进展进行综述,以期为MOFs在中药研究中的进一步应用提供参考,为中药成分的新型递药系统研究提供新思路。
纳米技术的成熟与革新使其在生物医学领域的应用逐渐广泛。MOFs作为新型纳米材料,在生物医学领域起步较晚,但发展却十分迅速。与传统多孔材料相比,MOFs具有较大的孔隙率和比表面积、较小的晶体密度、可调的孔径、良好的生物相容性等优点[6]。将MOFs应用在中药新型递药系统、改善溶解度、增加稳定性、降低毒副作用等方面已成为近年的研究热点。
1 MOFs在中药靶向递药系统中的应用
靶向药物递送系统(targeted drug delivery system,TDDS)能精准递送药物至靶部位,既能有效提高疗效又能减轻药物对正常组织与器官的不良反应,是一种经济高效且安全的治疗策略[19]。TDDS的发展在很大程度上取决于载体材料的发展,MOFs以其高载药量、易于功能化、生物安全性高等特点引起了广大研究者们的兴趣[20]。基于MOFs的靶向策略主要包括被动靶向、主动靶向、物理化学靶向(pH值响应型、离子响应型、氧化还原型、光敏感型、磁响应型、温度敏感型)、基因递送和仿生修饰等。
控制MOFs的粒径在100 nm左右,由于其增强的渗透和滞留作用而具有被动靶向至肿瘤组织的能力。而通过对MOFs修饰靶向配体能够实现主动靶向。如在肿瘤部位叶酸受体丰富,利用MOFs的氨基与叶酸的羧基进行酰胺化反应,将叶酸偶联至MOFs上,从而靶向至肿瘤部位已成为当前普遍的靶向策略。Laha等[21]利用叶酸修饰IRMOF-3,将姜黄素靶向递送至肿瘤部位,提高了姜黄素治疗三阴性乳腺癌的效率。由于局部缺氧、代谢较快,因而肿瘤部位较正常组织具有较低的pH值。利用病灶和正常生理环境pH值的差别,可以合成具有pH值敏感的MOFs,这些MOFs在酸性环境中更易降解,在生理条件下较稳定,因此,它们可以在肿瘤部位特异性释放药物。Cabrera-García等[22]合成了氨基功能化的MIL-100(Fe)负载喜树碱,该纳米平台在酸性条件下释放量为正常条件下的4倍,并有效改善了细胞内化。pH值响应型的MOFs能够加速纳米粒在病灶的药物释放,但无法避免药物在正常组织的释放。离子响应型和氧化还原型策略也是通过环境差异来响应性释放药物,只有在特定环境,如某些离子和酶的过量分泌可诱导MOFs的降解从而释放药物。Lei等[23]用4,4′-二硫代双苯甲酸作为有机配体合成MOFs,该MOFs能被过表达的谷胱甘肽裂解,从而释放姜黄素。此外,光疗和磁疗也是目前研究的热点,研究者既能以光敏剂为有机配体合成具有光敏的MOFs,也可通过MOFs对光敏剂进行包载递送至靶部位来实现光疗。Zeng等[24]以金纳米粒为种子介导合成了卟啉基金属有机骨架,该纳米平台能在近红外光下发出光动力治疗所需的活性氧,提高治疗效率。而磁疗则是通过使用磁性金属来合成MOFs,但这种策略靶向效率有限,因此,研究者更倾向于以MOFs为外壳包载磁性纳米粒(如Fe2O3)及药物,在外磁场的作用下至靶部位发挥药效。Zhuang等[25]将Fe2O3装入ZIF-8的孔隙中,赋予了纳米粒子磁性。温度敏感型MOFs在不同温度下具有不同的释放行为,对病灶部位局部升温可以促进药物的快速释放。基因递送则是指利用MOFs将外源DNA导入病灶并进行基因修改以达到治疗目的的方式。仿生修饰是指利用生物膜(红细胞膜、血小板膜、癌细胞膜等)包裹MOFs伪装成内源性物质,在体内进行长循环,减少免疫逃逸的一种策略。Xiao等[26]利用肿瘤细胞膜仿生修饰金属有机骨架靶向递送二氢青蒿素,该纳米粒具有优异的同源靶向能力,可在肿瘤组织中积累。
由于各种策略具有不同的特点,已有研究者开发出基于MOFs不同策略相结合的TDDS,这有利于各策略之间取长补短,提高靶向效率,获得更高的疗效。MOFs在中药靶向递药系统中的应用见表1。

表1 MOFs在中药靶向递药系统中的应用
2 MOFs在中药缓释递药系统中的应用
许多有潜力的中药单体成分由于溶解性差、半衰期过短、体内代谢不理想等特点限制了其临床应用。常规给药往往导致毒性的增加,且在给药后的较短时间内需重复给药[44]。因此,缓释制剂受到广泛关注。MOFs载药量高、体内可降解且易于修饰,是一类理想的药物缓释载体材料。药物从材料内部释放往往有几个阶段,首先材料表面的一部分药物溶解释放,然后材料内部的药物随着浓度的梯度逐渐向外扩散溶解,随着骨架的坍塌,被包裹在材料空腔内的药物被释放。此外,一部分药物与材料之间可能存在某种亲和力(氢键、π-π共轭、静电吸附),这部分药物最后被释放。由于几个阶段不断地进行,最终实现药物的持续缓慢释放。Latifi等[45]合成了MIL-53包封百里香酚,展现出了较高的装载能力及可控释放能力,该纳米平台能在24 h内持续释放百里香酚。同时该研究还展现了3种MOFs对百里香酚不同的递药性能,发现药物的递送与MOFs的孔径有着较大的关系。近年来,MOFs在中药缓释递药系统中的应用见表2。

表2 MOFs在中药缓释递药系统中的应用
此外,MOFs结构可调、易于修饰的特点使得可编程的个性化药物释放模式成为可能。对MOFs进行结构修饰以改变药物与载体之间的亲和力,能有效控制药物释放速度;对MOFs进行孔径的调节,是改变药物释放速率的另一种策略。Orellana-Tavra等[55]对Zr-MOFs进行功能化,-Br、-NO2和-NH2被引入MOFs,可以观察到各MOFs具有完全不同的释放行为,-NH2修饰的MOFs能在15 d内缓慢持续的释放肉桂酸,而另2种基团修饰的MOFs并不能完全释放所有的肉桂酸。基团修饰是有效调整药物释放速率的策略之一,研究者需要考虑基团与药物之间的亲和力以获得理想的释放行为,如果基团与药物之间不可逆的结合会导致死吸附,使得包裹的药物无法完全释放而造成浪费。因此,应该根据药物的特点与疾病的需求合理选择修饰基团。
3 MOFs在改善中药成分溶解性中的应用
低的溶解性和生物利用度严重影响了中药的开发与利用,必须达到一定的剂量才能激发药物在人体内的药理活性。Suresh等[56]将姜黄素包封在MOF-5中,该纳米系统能显著提高姜黄素的溶解性,在前60 min,该纳米系统中姜黄素的释放速率大于纯姜黄素的释放速率,这表明MOF-5在一定程度上能促进姜黄素的释放。这一研究提示可以利用水反应性MOFs对难溶性药物进行装载以提高溶解度并加速治疗进程。Santos等[57]将厚朴酚包封在Uio-66(Zr)中,其生物利用度提高了几乎2倍。He等[58]通过体内药动学证明了环糊精-MOFs能提高厚朴酚的生物利用度。以上研究证明MOFs能在一定程度上改善药物的溶解性并提高药物的生物利用度,这为难溶性药物的研究与开发提供了新的思路。
4 MOFs在增加中药成分稳定性中的应用
良好的稳定性是药物发挥药效的关键,过早的降解失活往往难以发挥药物的治疗作用。Chen等[40]将表没食子儿茶素棕榈酸酯(epigallocatechin-3-gallatea palmitate,PEGCG)包裹在ZIF-8中,该纳米粒中的PEGCG比游离PEGCG的稳定性提高了6倍。Moussa等[59]利用CD-MOF提高了姜黄素在碱性溶液中的稳定性。姜黄素的稳定性受温度影响较大,Liu等[60]将其包封在ZIF-L中,其温度稳定性比游离姜黄素增强了5倍。分析其原因,一方面,MOFs外壳本身对于中药具有保护作用,在MOFs的包裹与保护下,药物对外部环境的敏感性降低;另一方面,MOFs由金属离子与有机配体组成,中药成分往往能与其中的金属离子或配体之间存在配位键或作用力,这一作用力使得药物向其稳定的异构体或络合物转变,从而增强稳定性。
5 MOFs在降低中药成分毒副作用中的应用
此外,为了减少部分药物的严重不良反应,提高其治疗效果,需要开发新型无毒、生物相容性好的药物递送系统。Bi等[61]合成了MIL-100(Fe)并对氯化两面针碱进行装载,发现该纳米制剂对正常肝L02细胞表现出低毒性,而对肝癌细胞表现出了高毒性,证明该纳米制剂具有一定选择性,能降低药物对正常组织的毒性。
6 MOFs在中药合成反应催化中的应用
尽管部分中药单体成分能发挥良好的药效,但其从中药中提取的效率及产率较低,常需要从其他成分转化获得。而有效成分的获得通常需要依靠催化剂来提高反应的效率,催化剂对于药物的合成与转化发挥着重要的作用。MOFs由于其具有金属活性位点,组成复杂,且具有高的孔隙率和比表面积,为反应的发生提供了充足的接触面。此外,MOFs同时具有金属元素和有机连接基团,具有多重性质,因而是一类良好的催化剂。Wang等[62]合成了一种高效生产青蒿素的光催化剂2D纳米片,该催化剂具有较高的活性,能实现快速反应动力学。Feng等[63]也合成了基于卟啉MOFs的光催化剂,用于双氢青蒿素合成青蒿素,且该材料具有较高的催化性能。Luan等[64]合成了一种非均相Au(III)催化剂HAuCl4@UiO-66-NH2,能够以中等至良好的产率促进2-色烯形成各种二氢查耳酮。Ghaffarian等[65]在回流条件下,以CoFe2O4@OCMC@Cu(BDC)纳米复合材料为催化剂,对芳基醛、姜黄素、巴比妥酸进行处理,得到了功能化吡喃[2,3-d]嘧啶-2,4(3)二酮。MOFs作为一种生物安全性材料,在生物医学方面具有广阔的应用前景。将MOFs的催化性能及体内递送药物功能进行结合,可以实现在体内的精准递送前体药物并在靶部位进行药物的催化,从而减少由于药物不稳定而造成的失活。Wang等[66]合成了一种能靶向细胞器的催化剂MOF-Cu,该纳米材料能在线粒体中原位合成活性白藜芦醇类似物,该方法能有效减少不良反应的发生。MOFs作为一种催化剂在中药领域有一定的应用前景。
7 MOFs在中药吸附中的应用
MOFs以其大的孔隙率、比表面积以及可逆的合成过程,被认为是一种优良的吸附剂。MOFs在气体吸附储存领域备受关注,近年来,已有学者把MOFs用于中药成分的吸附。药物在一定剂量下能对疾病发挥治疗作用,当超过最小有毒剂量时,会对机体产生不良反应,MOFs可用于吸附体内过量的药物成分。Molavi等[67]合成了UiO-66和NH2-UiO-66 2种材料,均能对姜黄素进行有效吸附。Mao等[68]利用UiO-66吸附不同芳香剂以控制其释放,发现UiO-66对不同芳香剂有不同的吸附力,对丁香酚的吸附作用最强。Thi Dang等[69]揭示了Ui0-66对姜黄素的吸附机制,发现其吸附过程受MOFs结构中缺陷位点的影响。George等[70]通过Ca-BDC对姜黄素进行吸附-解吸附实验,发现Ca-BDC对姜黄素有较强的吸附力,这可能是由于姜黄素与钙氧簇之间存在配位关系。Molavi等[71]合成了3种MOFs:UiO-66-NH2、UiO-66-GMA和UiO-66-EDA,并研究了3种材料对姜黄素的吸附力,发现由于不同极性基团的存在能形成氢键等强相互作用力,因而UiO-66-EDA对姜黄素的吸附力最高。此外,这3种材料经过脱吸附后能再次活化并重复利用。基于以上发现,吸附作用的产生除了与MOFs的孔径有关以外,还与底物跟MOFs之间的作用力有关,对MOFs引入一定基团能够增大其对底物的吸附力。因此,在利用MOFs进行吸附实验时,可根据底物的特征、极性以及基团对MOFs进行修饰,以尽可能提高MOFs的吸附力。
此外,中药在种植过程中,需要一定的杀虫除草等措施,可能导致农残残留甚至超标,利用MOFs的吸附功能可有效除去中药中的农残及其他污染物。Wang等[72]使用Zr-MOF有效吸附了铁皮石斛、丹参和山楂中的5种苯脲类除草剂,证明了MOFs除去样品中农残和有机污染物的可能性。
8 MOFs在中药提取分离中的应用
MOFs丰富的活性位点及可调的结构功能使其选择性的提取中药成分成为可能。根据中药成分的性质,对MOFs进行合成与修饰,使其对药物具有选择性,可高效环保地对中药成分进行提取。Ghiasvand等[73]合成了MIL-101(Cr)/PANI/SiO2纳米复合材料,并成功地应用于水介质固相萃取酚类抗氧化剂。Xiang等[74]合成了能有效提取槲皮素(quercetin,QT)的CuII-MOF,该MOF还能在解吸过程中将QT转换为Cu-QT。Cui等[75]利用ZIF-8从鬼箭锦鸡儿中提取黄酮类化合物。Zhang等[76]采用MOF辅助基质固相分散微萃取技术提取人参叶中的5种皂苷,该方法具有更高的提取效率,操作简单,提取物更清洁,有机试剂消耗少,可用于植物活性化合物的快速评价和质量控制。Chen等[77]制备了新型共价有机骨架-1修饰磁性纳米颗粒可用于提取大鼠血浆紫杉醇,该材料富集效率高,清理能力强。此外,MOFs也可用于药物的分离。Ma等[78]利用MOFs修饰毛细管柱用于分离药物的立体异构体,成功地分离了麻黄碱和伪麻黄碱。
9 MOFs在中药成分检测中的应用
关于MOFs的研究表明,发光MOFs具有优异的发光性能,可以用于对客体分子进行检测。而中药由于成分复杂,有效成分含量差异较大,因此,迫切需要开发一种能灵敏检测其成分的传感器。近年来,涌现了大量基于MOFs的高灵敏度、快速响应、特异性识别中药成分并能重复利用的传感器研究。Song等[79]合成了能够定量检测QT的新型3D金属有机骨架,它能够在不改变荧光强度的情况下重复使用至少6次。Hassanzadeh等[80]报道了一种纸基化学发光装置,在该装置上掺入Co-MOF能显著促进化学荧光的发射,且能提高该装置的稳定性。Liu等[81]选择了5个不同荧光团的发光MOFs构建了一个荧光传感器阵列用于黄酮类化合物的定性和定量分析,这是第一次使用MOFs成功地区分多种同源性药物。Han等[82]使用MIL-101(Cr)纳米材料作为基质辅助激光解吸/电离飞行时间质谱基质检测小分子,其灵敏度高、耐盐性好、重现性好。Senocak等[83]报道了ZIF-67对芦丁的超灵敏检测,ZIF-67传感器的线性范围、定量限和检测限分别为0.1~30 μmol/L和73、22 nmol/L。基于ZIF-8-乙炔黑壳聚糖纳米复合材料的芦丁检测电化学传感器,传感器在0.1~10 mmol/L线性关系良好,检测限低至0.004 mmol/L(/=3),且重现性和稳定性良好[84]。Jiang等[85]合成了发光铟-有机骨架可以在水中选择性地检测秋水仙碱,且灵敏度高,其检测限可以达到0.1μmol/L。Wang等[86]通过将3个发光配体纳入Ui0-66主链合成了1个发光的MOF用于鉴别小檗碱同源物(异喹诺啉类生物碱的亚类)。Xiong等[87]合成了高荧光的Eu-MOF,并对盐酸小檗碱和四环素进行了灵敏检测。
10 MOFs在中药成像中的应用
疾病的早期诊断在临床治疗中发挥着关键作用。因此,开发集临床诊断与药物运输等于一体的诊疗纳米递药系统具有重要意义,也是当前研究的热点。利用MOFs同时递送药物与造影剂既能对纳米系统进行时实时追踪与定位,还能对病灶部位进行成像观察[88]。对MOFs的金属离子部分进行选择与调整,如铁离子的存在可在一定程度上实现磁共振成像,而其较大的孔径可实现药物与造影剂的共同包载,这一策略使得疾病的诊疗一体化有望成为现实。表3列举了近年来基于MOFs的递药与成像一体化策略。
11 结语与展望
MOFs已经在中药领域进行了广泛而深入的研究,在中药成分的靶向递送、缓释递送、溶解度改善、稳定性提高、毒副作用降低等方面取得了较好的发展。MOFs独特的结构可以控制药物释放的速率,使药物平稳的发挥药效,既能减少药物的服用次数,也能在一定程度上起到减毒的作用。可以根据药物的特点及病情需求设计出个性化的MOFs,从而实现MOFs的个体化给药模式。而靶向配体的修饰能特异性地将药物递送至靶部位,以实现中药的精准治疗。同时,MOFs大的比表面积及孔隙率,众多的活性位点为中药的高效催化反应、分离富集以及检测提供了便利。因此,MOFs因其独特的优点,在中药成分的提取分离富集、催化合成、吸附清除及高灵敏检测等方面也有着较大的进展。MOFs在中药领域的应用将为中药的发展提供参考,将进一步推动中药的现代化进程。
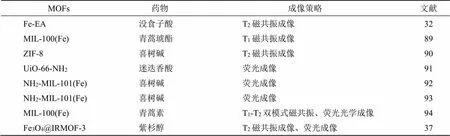
表3 基于MOFs的成像策略
当然,在关注MOFs为中药发展带来成就的同时,也应对其不足进行考虑。基于MOFs的中药成分递送研究尚在基础研究阶段,其体内的代谢过程、金属残留问题、安全性也应被关注。科研工作者应更加深入地研究MOFs在体内的代谢学及安全性问题。由于缺乏临床实践,基于MOFs的递药系统仍缺少严格标准,应对MOFs应用于生物医药领域提出初步的质量标准,保证基础研究的质量。此外,MOFs的大规模合成也应引起重视,只有降低成本,提高产量才能推动其在中药领域的广泛使用。应加大对MOFs从生产到临床应用、体内代谢及安全性等各方面的研究投入,促进生物、化学、材料、医药等多学科的交流,实现基于MOFs递药系统的临床成果转化。中药成分复杂且多种多样,目前基于MOFs的中药研究大多停留于中药单体化合物。而MOFs孔径可调、表面可修饰的特点在中药研究领域尚未完全发挥出作用。根据中医药理论,单体成分常常不能满足需求,而利用不同特点的MOFs递送中药有效部位加强配伍作用将会是更有意义的工作。
目前,MOFs在中药领域的应用尚处于研究阶段,但其独特的优势、多样性的应用使MOFs在中药领域的应用前景越来越明确。认识MOFs在中药应用中的规律,在中医药理论的指导下成分发挥MOFs的作用,并将其由实验室规模扩大到生产应用规模将会是进一步的工作。相信随着科技的发展,MOFs将为中药的现代化发展提供新的方向与选择。
利益冲突 所有作者均声明不存在利益冲突
[1] Zhu Q L, Xu Q. Metal-organic framework composites [J]., 2014, 43(16): 5468-5512.
[2] Furukawa H, Cordova K E, O'Keeffe M,. The chemistry and applications of metal-organic frameworks [J]., 2013, 341(6149): 1230444.
[3] Meek S T, Greathouse J A, Allendorf M D. Metal-organic frameworks: A rapidly growing class of versatile nanoporous materials [J]., 2011, 23(2): 249-267.
[4] Zou K Y, Li Z X. Controllable syntheses of MOF-derived materials [J]., 2018, 24(25): 6506-6518.
[5] Li J R, Kuppler R J, Zhou H C. Selective gas adsorption and separation in metal-organic frameworks [J]., 2009, 38(5): 1477-1504.
[6] Lee J, Farha O K, Roberts J,. Metal-organic framework materials as catalysts [J].,2009,(5): 1450-1459.
[7] Lustig W P, Mukherjee S, Rudd N D,. Metal-organic frameworks: Functional luminescent and photonic materials for sensing applications [J]., 2017, 46(11): 3242-3285.
[8] Huxford R C, Della Rocca J, Lin W B. Metal-organic frameworks as potential drug carriers [J]., 2010, 14(2): 262-268.
[9] Rowsell J L, Yaghi O M. Effects of functionalization, catenation, and variation of the metal oxide and organic linking units on the low-pressure hydrogen adsorption properties of metal-organic frameworks [J]., 2006, 128(4): 1304-1315.
[10] Taylor-Pashow K M, Della Rocca J, Xie Z,. Postsynthetic modifications of iron-carboxylate nanoscale metal-organic frameworks for imaging and drug delivery [J]., 2009, 131(40): 14261-14263.
[11] Zacher D, Shekhah O, Wöll C,. Thin films of metal-organic frameworks [J]., 2009, 38(5): 1418-1429.
[12] Park K S, Ni Z, Côté A P,. Exceptional chemical and thermal stability of zeolitic imidazolate frameworks [J]., 2006, 103(27): 10186-10191.
[13] Park J, Jiang Q, Feng D W,. Size-controlled synthesis of porphyrinic metal-organic framework and functionalization for targeted photodynamic therapy [J]., 2016, 138(10): 3518-3525.
[14] Guillerm V, Gross S, Serre C,. A zirconium methacrylate oxocluster as precursor for the low-temperature synthesis of porous zirconium (IV) dicarboxylates [J]., 2010, 46(5): 767-769.
[15] Jiang K, Zhang L, Hu Q,. Thermal stimuli-triggered drug release from a biocompatible porous metal-organic framework [J]., 2017, 23(42): 10215-10221.
[16] Chui S S, Lo S M, Charmant J P,. A chemically functionalizable nanoporous material [J]., 1999, 283(5405): 1148-1150.
[17] Berens S, Hillman F, Jeong H K,. Self-diffusion of pure and mixed gases in mixed-linker zeolitic imidazolate framework-7-8 by high field diffusion NMR [J]., 2019, 288: 109603.
[18] Su Z, Fan J, Okamura T A,. Ligand-directed and pH-controlled assembly of chiral 3d-3d heterometallic metal-organic frameworks [J]., 2010, 10(8): 3515-3521.
[19] Gao Y, Xie J J, Chen H J,. Nanotechnology-based intelligent drug design for cancer metastasis treatment [J]., 2014, 32(4): 761-777.
[20] Cai M R, Chen G S, Qin L Y,. Metal organic frameworks as drug targeting delivery vehicles in the treatment of cancer [J]., 2020, 12(3): E232.
[21] Laha D, Pal K, Chowdhuri A R,. Fabrication of curcumin-loaded folic acid-tagged metal organic framework for triple negative breast cancer therapyandsystems [J]., 2019, 43(1): 217-229.
[22] Cabrera-García A, Checa-Chavarria E, Rivero-Buceta E,. Amino modified metal-organic frameworks as pH-responsive nanoplatforms for safe delivery of camptothecin [J]., 2019, 541: 163-174.
[23] Lei B Q, Wang M F, Jiang Z L,. Constructing redox-responsive metal-organic framework nanocarriers for anticancer drug delivery [J]., 2018, 10(19): 16698-16706.
[24] Zeng J Y, Zhang M K, Peng M Y,. Porphyrinic metal-organic frameworks coated gold nanorods as a versatile nanoplatform for combined photodynamic/photothermal/ chemotherapy of tumor [J]., 2018, 28(8): 1705451.
[25] Zhuang J, Kuo C H, Chou L Y,. Optimized metal-organic-framework nanospheres for drug delivery: Evaluation of small-molecule encapsulation [J]., 2014, 8(3): 2812-2819.
[26] Xiao Y S, Huang W, Zhu D M,. Cancer cell membrane-camouflaged MOF nanoparticles for a potent dihydroartemisinin-based hepatocellular carcinoma therapy [J]., 2020, 10(12): 7194-7205.
[27] Soomro N A, Wu Q, Amur S A,. Natural drug physcion encapsulated zeolitic imidazolate framework, and their application as antimicrobial agent [J]., 2019, 182: 110364.
[28] Li Y Q, Zheng Y T, Lai X Y,. Biocompatible surface modification of nano-scale zeolitic imidazolate frameworks for enhanced drug delivery [J]., 2018, 8(42): 23623-23628.
[29] Nasihat Sheno N, Farhadi S, Maleki A,. A novel approach for the synthesis of phospholipid bilayer-coated zeolitic imidazolate frameworks: Preparation and characterization as a pH-responsive drug delivery system [J]., 2019, 43(4): 1956-1963.
[30] Ettlinger R, Sönksen M, Graf M,. Metal-organic framework nanoparticles for arsenic trioxide drug delivery [J]., 2018, 6(40): 6481-6489.
[31] Ettlinger R, Moreno N, Volkmer D,. Zeolitic imidazolate framework-8 as pH-sensitive nanocarrier for “arsenic trioxide” drug delivery [J]., 2019, 25(57): 13189-13196.
[32] Zhao G Z, Wu H H, Feng R L,. Novel metal polyphenol framework for MR imaging-guided photothermal therapy [J]., 2018, 10(4): 3295-3304.
[33] Hu G F, Yang L L, Li Y N,. Continuous and scalable fabrication of stable and biocompatible MOF@SiO2nanoparticles for drug loading [J]., 2018, 6(47): 7936-7942.
[34] Chen W H, Luo G F, Sohn Y S,. Enzyme-driven release of loads from nucleic acid-capped metal-organic framework nanoparticles [J]., 2019, 29(5): 1805341.
[35] Liu Z J, Li T, Han F,. A cascade-reaction enabled synergistic cancer starvation/ROS-mediated/chemo-therapy with an enzyme modified Fe-based MOF [J]., 2019, 7(9): 3683-3692.
[36] Yang Y, Zhu W J, Dong Z L,. 1D coordination polymer nanofibers for low-temperature photothermal therapy [J]., 2017, doi: 10.1002/adma. 201703588.
[37] Ray Chowdhuri A, Bhattacharya D, Sahu S K. Magnetic nanoscale metal organic frameworks for potential targeted anticancer drug delivery, imaging and as an MRI contrast agent [J]., 2016, 45(7): 2963-2973.
[38] Wan X Y, Zhong H, Pan W,. Programmed release of dihydroartemisinin for synergistic cancer therapy using a CaCO3mineralized metal-organic framework [J]., 2019, 58(40): 14134-14139.
[39] Zhang Y, Wang L, Liu L,. Engineering metal-organic frameworks for photoacoustic imaging-guided chemo-/ photothermal combinational tumor therapy [J]., 2018, 10(48): 41035-41045.
[40] Chen X R, Shi Z Q, Tong R L,. Derivative of epigallocatechin-3-gallatea encapsulated in ZIF-8 with polyethylene glycol-folic acid modification for target and pH-responsive drug release in anticancer research [J]., 2018, 4(12): 4183-4192.
[41] Jiang W, Zhang H Y, Wu J L,. CuS@MOF-based well-designed quercetin delivery system for chemo-photothermal therapy [J]., 2018, 10(40): 34513-34523.
[42] Cheng Q, Yu W Y, Ye J J,. Nanotherapeutics interfere with cellular redox homeostasis for highly improved photodynamic therapy [J]., 2019, 224: 119500.
[43] Dehghani S, Hosseini M, Haghgoo S,. Multifunctional MIL-Cur@FC as a theranostic agent for magnetic resonance imaging and targeting drug delivery:andstudy [J]., 2020, 28(6): 668-680.
[44] Freiberg S, Zhu X X. Polymer microspheres for controlled drug release [J]., 2004, 282(1/2): 1-18.
[45] Latifi L, Sohrabnezhad S. Drug delivery by micro and meso metal-organic frameworks [J]., 2020, 180: 114321.
[46] Chen G S, Luo J Y, Cai M R,. Investigation of metal-organic framework-5 (MOF-5) as an antitumor drug oridonin sustained release carrier [J]., 2019, 24(18): E3369.
[47] Leng X, Dong X, Wang W P,. Biocompatible Fe-based micropore metal-organic frameworks as sustained-release anticancer drug carriers [J]., 2018, 23(10): E2490.
[48] Wang L C, Guan H D, Wang Z Q,. Hybrid mesoporous-microporous nanocarriers for overcoming multidrug resistance by sequential drug delivery [J]., 2018, 15(7): 2503-2512.
[49] Karimi Alavijeh R, Akhbari K. Biocompatible MIL-101(Fe) as a smart carrier with high loading potential and sustained release of curcumin [J]., 2020, 59(6): 3570-3578.
[50] Orellana-Tavra C, Koeppen M, Li A,. Biocompatible, crystalline, and amorphous bismuth-based metal-organic frameworks for drug delivery [J].,2020, 12(5): 5633-5641.
[51] Teplensky M H, Fantham M, Li P,. Temperature treatment of highly porous zirconium-containing metal-organic frameworks extends drug delivery release [J]., 2017, 139(22): 7522-7532.
[52] Wei L Q, Chen Q, Tang L L,. A porous metal-organic framework with a unique hendecahedron-shaped cage: Structure and controlled drug release [J]., 2016, 45(9): 3694-3697.
[53] Chen Q, Chen Q W, Zhuang C,. Controlled release of drug molecules in metal-organic framework material HKUST-1 [J]., 2017, 79: 78-81.
[54] Zhang L, Chen Y, Shi R,. Synthesis of hollow nanocages MOF-5 as drug delivery vehicle to solve the load-bearing problem of insoluble antitumor drug oleanolic acid (OA) [J]., 2018, 96: 20-23.
[55] Orellana-Tavra C, Marshall R J, Baxter E F,. Drug delivery and controlled release from biocompatible metal-organic frameworks using mechanical amorphization [J]., 2016, 4(47): 7697-7707.
[56] Suresh, K, Matzger, A J. Enhanced drug delivery by dissolution of amorphous drug encapsulated in a water unstable metal-organic framework (MOF) [J]., 2019, 58(47): 16790-16794.
[57] Santos J H, Quimque M T J, Macabeo A P G,. Enhanced oral bioavailability of the pharmacologically active lignin magnolol via Zr-based metal organic framework impregnation [J]., 2020, 12(5): E437.
[58] He Y Z, Hou X F, Guo J W,. Activation of a gamma-cyclodextrin-based metal-organic framework using supercritical carbon dioxide for high-efficient delivery of honokiol [J]., 2020, 235: 115935.
[59] Moussa Z, Hmadeh M, Abiad M G,. Encapsulation of curcumin in cyclodextrin-metal organic frameworks: Dissociation of loaded CD-MOFs enhances stability of curcumin [J]., 2016, 212: 485-494.
[60] Liu Z X, Wu Q, He J,. Crystal-seeded growth of pH-responsive metal-organic frameworks for enhancing encapsulation, stability, and bioactivity of hydrophobicity compounds [J]., 2019, 5(12): 6581-6589.
[61] Bi J R, Zheng Y, Fang L Q,. Nano-sized MIL-100(Fe) as a carrier material for nitidine chloride reduces toxicity and enhances anticancer effects[J]., 2020, 30(9): 3388-3395.
[62] Wang Y, Feng L, Pang J D,. Photosensitizer-anchored 2D MOF nanosheets as highly stable and accessible catalysts toward artemisinin production [J]., 2019, 6(11): 1802059.
[63] Feng L, Wang Y, Yuan S,. Porphyrinic metal-organic frameworks installed with brønsted acid sites for efficient tandem semisynthesis of artemisinin [J]., 2019, 9(6): 5111-5118.
[64] Luan Y, Qi Y, Yu J,. The development of a novel HAuCl4@MOF catalyst and its catalytic application in the formation of dihydrochalcones [J]., 2014, 4(64): 34199-34203.
[65] Ghaffarian F, Ghasemzadeh M A, Aghaei S S. An efficient synthesis of some new curcumin based pyrano[2,3-d] pyrimidine-2, 4(3)-diderivatives using CoFe2O4@ OCMC@Cu(BDC) as a novel and recoverable catalyst [J]., 2019, 1186: 204-211.
[66] Wang F M, Zhang Y, Liu Z W,. A biocompatible heterogeneous MOF-Cu catalyst fordrug synthesis in targeted subcellular organelles [J]., 2019, 58(21): 6987-6992.
[67] Molavi H, Zamani M, Aghajanzadeh M,. Evaluation of UiO-66 metal organic framework as an effective sorbent for curcumin’s overdose [J]., 2018, 32(4): e4221.
[68] Mao D S, Xie C J, Li Z Y,. Adsorption and controlled release of three kinds of flavors on UiO-66 [J]., 2020, 8(4): 1914-1922.
[69] Thi Dang Y, Hoang H T, Dong H C,. Microwave-assisted synthesis of nano Hf- and Zr-based metal-organic frameworks for enhancement of curcumin adsorption [J]., 2020, 298: 110064.
[70] George P, Das R K, Chowdhury P. Facile microwave synthesis of Ca-BDC metal organic framework for adsorption and controlled release of Curcumin [J]., 2019, 281: 161-171.
[71] Molavi H, Moghimi H, Taheri R A. Zr-based MOFs with high drug loading for adsorption removal of anti-cancer drugs: A potential drug storage [J]., 2020, 34(4): e5549.
[72] Wang Q Y, Yang J, Dong X,. Zirconium metal-organic framework assisted miniaturized solid phase extraction of phenylurea herbicides in natural products by ultra-high-performance liquid chromatography coupled with quadrupole time-of-flight mass spectrometry [J]., 2020, 180: 113071.
[73] Ghiasvand A R, Ghaedrahmati L, Heidari N,. Synthesis and characterization of MIL-101(Cr) intercalated by polyaniline composite, doped with silica nanoparticles and its evaluation as an efficient solid-phase extraction sorbent [J]., 2018, 41(20): 3910-3917.
[74] Xiang R Q, Niu Y F, Han J,. A neutral Cu-based MOF for effective quercetin extraction and conversion from natural onion juice [J]., 2019, 9(58): 33716-33721.
[75] Cui Y Y, Yang C X, Yang X D,. Zeolitic imidazolate framework-8 for selective extraction of a highly active anti-oxidant flavonoid fromJubata [J]., 2018, 1544: 8-15.
[76] Zhang R, Xu N, Wang Y,. Metal-organic framework assisted matrix solid-phase dispersion microextraction of saponins using response surface methodology [J]., 2020, 41(15): 1354-1363.
[77] Chen Y L, Chen Z L. COF-1-modified magnetic nanoparticles for highly selective and efficient solid-phase microextraction of paclitaxel [J]., 2017, 165: 188-193.
[78] Ma J C, Ye N S, Li J. Covalent bonding of homochiral metal-organic framework in capillaries for stereoisomer separation by capillary electrochromatography [J]., 2016, 37(4): 601-608.
[79] Song T Q, Yuan K, Qiao W Z,. Water stable [Tb4] cluster-based metal-organic framework as sensitive and recyclable luminescence sensor of quercetin [J]., 2019, 91(4): 2595-2599.
[80] Hassanzadeh J, Al Lawati H A J, Al Lawati I. Metal-organic framework loaded by rhodamine B as a novel chemiluminescence system for the paper-based analytical devices and its application for total phenolic content determination in food samples [J]., 2019, 91(16): 10631-10639.
[81] Liu Q, Gao J, Zheng Z,. Metal-organic frameworks based fluorescent sensor array for discrimination of flavonoids [J]., 2019, 203: 248-254.
[82] Han G B, Zeng Q L, Jiang Z W,. MIL-101(Cr) as matrix for sensitive detection of quercetin by matrix-assisted laser desorption/ionization mass spectrometry [J]., 2017, 164: 355-361.
[83] Şenocak A, Khataee A, Demirbas E,. Ultrasensitive detection of rutin antioxidant through a magnetic micro-mesoporous graphitized carbon wrapped Co nanoarchitecture [J]., 2020, 312: 127939.
[84] Jin Y F, Ge C Y, Li X B,. A sensitive electrochemical sensor based on ZIF-8-acetylene black-chitosan nanocomposites for rutin detection [J]., 2018, 8(57): 32740-32746.
[85] Jiang X L, Hou S L, Jiao Z H,. Luminescent detection of colchicine by a unique indium-organic framework in water with high sensitivity [J]., 2019, 91(15): 9754-9759.
[86] Wang Q, Liu Q, Du X M,. A white-light-emitting single MOF sensor-based array for berberine homologue discrimination [J]., 2020, 8(4): 1433-1439.
[87] Xiong J, Yang L, Gao L X,. A highly fluorescent lanthanide metal-organic framework as dual-mode visual sensor for berberine hydrochloride and tetracycline [J]., 2019, 411(23): 5963-5973.
[88] 陈思亲. 基于吲哚菁绿的肿瘤成像荧光探针的制备及功能评价 [D]. 天津: 天津医科大学, 2016.
[89] Wang D D, Zhou J J, Chen R H,. Core-shell metal-organic frameworks as Fe2+suppliers for Fe2+-mediated cancer therapy under multimodality imaging [J]., 2017, 29(8): 3477-3489.
[90] Yang J C, Chen Y, Li Y H,. Magnetic resonance imaging-guided multi-drug chemotherapy and photothermal synergistic therapy with pH and NIR-stimulation release [J]., 2017, 9(27): 22278-22288.
[91] Tabatabaeian K, Simayee M, Fallah-Shojaie A,.-doped carbon nanodots@UiO-66-NH2as novel nanoparticles for releasing of the bioactive drug, rosmarinic acid and fluorescence imaging [J]., 2019, 27(1): 307-315.
[92] Yin X, Yang B, Chen B B,. Multifunctional gold nanocluster decorated metal-organic framework for real-time monitoring of targeted drug delivery and quantitative evaluation of cellular therapeutic response [J]., 2019, 91(16): 10596-10603.
[93] Liu J T, Zhang L, Lei J P,. Multifunctional metal-organic framework nanoprobe for cathepsin B-activated cancer cell imaging and chemo-photodynamic therapy [J]., 2017, 9(3): 2150-2158.
[94] Wang D D, Zhou J J, Chen R H,. Controllable synthesis of dual-MOFs nanostructures for pH-responsive artemisinin delivery, magnetic resonance and optical dual-model imaging-guided chemo/photothermal combinational cancer therapy [J]., 2016, 100: 27-40.
Progress in application of metal organic frameworks in traditional Chinese medicine
CAI Meng-ru, YAO Yu, YIN Dong-ge, WANG Kai-xin, HU Xue-ling, LIU Man-ting, DONG Xiao-xu, QU Chang-hai, YIN Xing-bin, NI Jian
School of Chinese Material Medica, Beijing University of Chinese Medicine, Beijing 102488, China
Metal organic frameworks (MOFs) are hybrid porous crystalline materials formed by connecting metal ion centers and organic ligands. They have the advantages of large specific surface area, adjustable pore size, abundant active sites, and good biocompatibility. They are widely used in the fields of gas storage, adsorption, extraction, catalysis, and drug delivery. In recent years, MOFs have become more and more extensive in the field of traditional Chinese medicine research, mainly used for slow and controlled release of active ingredients of traditional Chinese medicine, targeted drug delivery system, improvement of drug solubility, increase of drug stability, and reduction of drug side effects, etc. At the same time, MOFs also have many applications in the extraction, separation and detection of Chinese medicine components. The application progress of MOFs in the field of traditional Chinese medicine research in recent years is reviewed in this paper, hoping to provide a reference for the further application of MOFs in the research of traditional Chinese medicine, and provide new ideas for the research of new drug delivery systems based on traditional Chinese medicine components.
metal organic framework; traditional Chinese medicine; targeted drug delivery;slow and controlled release of drug delivery; catalysis; adsorption; extraction and separation; detection
R283
A
0253 - 2670(2021)16 - 5028 - 11
10.7501/j.issn.0253-2670.2021.16.028
2020-11-19
北京市自然科学基金资助项目(7202121);北京市优秀人才培养计划基金资助项目(2017000020124G295);中央高校基本科研业务费专项资金资助项目(2020-JYB-ZDGG-046,2020-JYB-XSCXCY-127)
蔡梦如,女,硕士研究生,主要从事中药新剂型与新技术的研究。E-mail: cmrtcm@163.com
倪 健,男,博士,教授,博士生导师,主要从事中药新剂型与新技术的研究。E-mail: njtcm@263.net
尹兴斌,男,博士,副教授,硕士生导师,主要从事中药新剂型与新技术的研究。E-mail: yxbtcm@163.com
[责任编辑 崔艳丽]
