基于miR-34调控KLF4/VEGF传导轴探讨活血荣络方促脑梗死后血管新生的机制
2021-08-24杨仁义颜思阳周德生傅馨莹张宇星高晓峰刘利娟
杨仁义,颜思阳,周德生,傅馨莹,马 强,张宇星,高晓峰,刘利娟*
• 药理与临床 •
基于miR-34调控KLF4/VEGF传导轴探讨活血荣络方促脑梗死后血管新生的机制
杨仁义1,颜思阳1,周德生2,傅馨莹1,马 强1,张宇星1,高晓峰2,刘利娟2*
1. 湖南中医药大学,湖南 长沙 410208 2. 湖南中医药大学第一附属医院,湖南 长沙 410007
基于miR-34家族基因与Kruppel样因子4(Kruppel-like factor 4,KLF4)/血管内皮生长因子(vascular endothelial growth factor,VEGF)传导轴的相关性探讨活血荣络方促脑梗死后血管新生的机制。将SD大鼠随机分为对照组、模型组、活血荣络方(11.7 g/kg)组和丁苯酞(60 mg/kg)组,每组10只,建立大脑中动脉闭塞/再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型,连续ig药物7 d。采用改良神经功能缺损评分(modified neurological severity score,mNSS)评价大鼠神经功能缺损症状;采用免疫荧光染色观察海马区CD34及皮质区VEGF表达;采用Western blotting法检测各组大鼠梗死侧脑组织中KLF4和VEGF蛋白表达情况;采用qRT-PCR法检测各组大鼠脑组织中miR-34家族基因的表达;采用Pearson相关分析探讨miR-34家族基因与mNSS、KLF4、VEGF的相关性。活血荣络方能够显著改善大鼠神经功能缺损症状(<0.01),增加海马区CD34阳性细胞及皮质区VEGF表达(<0.01),增强脑组织中KLF4和VEGF蛋白表达(<0.01),抑制miR-34家族基因、、mRNA表达(<0.01);且mNSS与、、呈高度正相关(<0.05);VEGF与、、呈高度负相关(<0.05);KLF4与呈高度负相关(<0.05),与呈高度负相关(<0.01)。活血荣络方能够抑制、、mRNA表达,激活KLF4/VEGF传导轴,促进脑梗死后血管新生,进而改善神经功能缺损症状。
活血荣络方;脑梗死;血管新生;KLF4;VEGF;miR-34
脑梗死又称缺血性脑卒中,是由于脑循环灌注障碍,缺血、缺氧所致局限脑组织缺血性坏死,出现相应神经功能缺损症状的临床最常见脑血管病类型,约占全部急性脑血管病的70%[1],是当前我国居民死亡的首要原因[2]。血管新生属于三级脑侧支循环范畴,在脑动脉闭塞后,血管内皮细胞(endothelial cells,ECs)增殖、迁移、分化,在原有微动/静脉基础上以芽生式形成新的血管,能够代偿性地为脑组织提供血流灌注[3],促进病情恢复,是脑梗死药物治疗的关键切入点[4]。因此,积极寻求脑梗死后促血管新生的药物具有重要的意义。
脑梗死属中医“缺血性脑卒中”范畴,在脑藏象理论指导下,本课题组首次提出缺血中风之“荣气虚滞”病机理论体系[5],认为荣气是一切精微物质的总称[6],荣气气化的“精化气-气生变-变成形”过程与ECs增殖、迁移、分化相应,因此,在活血荣络法指导下组方的活血荣络方可能具有促脑梗死后血管新生的作用[7]。基于荣气理论创制的活血荣络方是湖南中医药大学第一附属医院院内制剂,纳入临床路径已13年,前期临床与实验研究发现活血荣络方能够上调微囊蛋白-1(caveolin-1,CAV-1)表达,下调基质金属肽酶-9(matrix metallopeptidase-9,MMP-9)表达,激活Janus激酶2(Janus kinase 2,JAK2)/信号传导与转录激活因子3(signal transducer and activator of transcription 3,STAT3)通路,减轻脑梗死急性期炎性反应,增加脑缺血区微血管密度(microvessel density,MVD),促进血管新生,改善脑梗死后神经功能缺损[8-13],但活血荣络方促脑梗死后血管新生的作用机制仍有待进一步研究。Kruppel样因子4(Kruppel-like factor 4,KLF4)是锌指转录因子家族蛋白之一,是双向调控转录因子,能够易位过表达,正向介导血管内皮生长因子(vascular endothelial growth factor,)mRNA和蛋白的表达,可以形成KLF4/VEGF传导轴促进血管新生,且Targetscan数据库预测发现KLF4是miR-34家族基因的下游靶基因,因此本研究以miR-34家族基因与KLF4/VEGF传导轴之间的相关性为切入点,探讨活血荣络方促脑梗死后血管新生的作用机制。
1 材料
1.1 动物
SPF级雄性SD大鼠40只,10~12周龄,体质量250~280 g,购自湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2019-0004。动物饲养于湖南中医药大学第一附属医院实验动物中心,昼夜交替12 h,温度21~26 ℃,湿度40%~50%。动物实验经湖南中医药大学第一附属医院动物实验伦理委员会批准(批准号20201010-8)。
1.2 药材
活血荣络方(湘药制字Z20080472)由鸡血藤30 g、石楠藤30 g、生地黄15 g、玄参10 g、黄精15 g、乳香10 g、没药10 g、川芎10 g组成,以上药材均购自湖南中医药大学第一附属医院中药房,经湖南中医药大学第一附属医院张裕民主任药师鉴定分别为豆科植物密花豆Dunn的干燥藤茎、胡椒科植物石楠藤(Miq.) Hand. -Mazz.的干燥带叶茎枝、玄参科植物地黄Libosch.的干燥块根、玄参科植物玄参Hemsl.的干燥根、百合科植物黄精Red.的干燥根茎、橄榄科乳香树属植物乳香树Birdw.树皮渗出的树脂、橄榄科植物地丁树Engl.的干燥树脂、伞形科植物川芎Hort.的干燥根茎,均符合《中国药典》2015年版规定。
1.3 药品与试剂
丁苯酞软胶囊(批号H20050299,0.1 g/粒)购自中国石药集团恩必普药业有限公司;乙二胺四乙酸(EDTA)抗原修复液(pH 8.0,批号G1206)、自发荧光淬灭剂(批号G1221-2)、488山羊抗兔荧光抗体(批号GB25303)、CY3山羊抗小鼠荧光抗体(批号GB21301)、CY3荧光TSA抗体(批号G1223)、DAPI染液(批号G1012)、RNA提取试剂盒(批号G3013)、RT First Strand cDNA Synthesis Kit(批号G3330)、2×SYBR Green qPCR Master Mix(批号G3322)购自武汉赛维尔生物科技有限公司;VEGF荧光抗体(批号19003-1-ap)购自武汉三鹰生物技术有限公司;CD34荧光抗体(批号ab81289)、KLF4抗体(批号ab106629)、VEGF抗体(批号ab46154)、HRP标记的山羊抗兔IgG抗体(批号ab150120)购自英国Abcam公司;BCA蛋白定量试剂盒(批号70-PQ0012)购自杭州联科生物技术股份有限公司;SDS-PAGE凝胶配置试剂盒(批号CW0022S)购自康为世纪生物科技有限公司;Immobilon Western HRP底物(批号WBKLS0100)购自美国Millipore公司;PageRulerTMPrestained Protein Ladder(批号26616)购自美国Thermo Fisher Scientific公司;β-actin抗体(批号20536-1-AP)购自美国Proteintech公司;HyPureTMMolecular Biology Grade Water(批号SH30538.02)购自美国HyClone公司。
1.4 仪器
HM325型石蜡切片机、NanoDrop2000超微量分光光度计(美国Thermo Fisher Scientific公司);ECLIPSE C1型正置荧光显微镜、DS-U3型显微成像系统(日本Nikon公司);Mini-Protean Tetra小型垂直电泳槽、Mini Trans-Blot型转印槽、PowerPac Basic基础电泳仪、Gel Doc XR+凝胶成像系统、qRT-PCR仪(美国Bio-Rad公司);0.22 μm PVDF膜(美国Millipore公司);D3024R型台式高速冷冻型微量离心机(北京大龙兴创实验仪器有限公司);SW-CJ-1FD型超净工作台(苏州安泰空气技术有限公司);FBZ2001-up-p标准试剂型纯水仪(青岛富勒姆科技有限公司);Enspire多功能酶标仪(美国Perkinelmer公司)。
2 方法
2.1 活血荣络方的制备
将乳香、没药粉碎,其余药材混合,加入10倍量水浸泡12 h后煎煮2 h;加入8倍量水煎煮1 h;加入5倍量水煎煮1 h;合并3次提取液,于旋转蒸发仪上浓缩,冷却后得到活血荣络方浸膏,于4 ℃保存备用。采用高效液相色谱法对活血荣络方进行质量控制,其主要有效成分芒柄花素、薯蓣皂苷、正丁烯基苯酚、黄芩苷的质量分数分别为4.298、3.568、1.779、18.634 mg/g。
2.2 大鼠脑缺血再灌注模型的制备
SD大鼠适应性饲养7 d,术前12 h禁食不禁水,ip 10%水合氯醛(0.35 g/kg)麻醉,参考Longa等[15]报道的大脑中动脉阻塞法,梗阻大鼠右侧大脑中动脉。钝性分离右侧颈总动脉、颈外动脉和颈内动脉,从颈外动脉和颈内动脉分叉部(4±2)mm处剪口进拴线,插入拴线(18±2)mm,将颈内动脉挂线系牢;缺血2 h后,拔出拴线进行再灌注,以制备大脑中动脉闭塞/再灌注(middle cerebral artery occlusion/reperfusion,MCAO/R)模型。
2.3 分组与给药
采用SPSS 23.0软件设置随机数的方法,将40只SD大鼠随机分为对照组10只和造模组30只,造模组按“2.2”项下方法造模;对照组分离右侧颈总动脉、颈外动脉和颈内动脉,不插入拴线,其余过程与模型制备方法相同。参考Zea-Longa’s标准评分法[15],取造模后评分为1~3分的大鼠30只,随机分为模型组、活血荣络方(11.7 g/kg)[9-12]组和丁苯酞(60 mg/kg)[14]组,每组10只。活血荣络方浸膏以蒸馏水稀释成质量浓度为1.1 g/mL(以生药量计)的药液;丁苯酞软胶囊用麻油配制成质量浓度为6 mg/mL的混悬液。术后6 h,各给药组ig相应药物(10 mL/kg),对照组和模型组ig等体积0.9%氯化钠溶液,1次/d,连续7 d。实验过程中出现死亡、取材时发现蛛网膜下腔出血或脑出血的大鼠予以剔除。
2.4 活血荣络方对MCAO/R大鼠改良神经功能缺损评分(modified neurological severity score,mNSS)的影响
分别于给药后第1、3、7天,采用mNSS[16]评价各组大鼠神经功能缺损症状,包括运动、感觉、平衡木、反射消失或动作异常等共18分,评分越高,损伤程度越严重。
2.5 活血荣络方对MCAO/R大鼠脑组织海马区CD34和皮质区VEGF表达的影响
各组随机取5只大鼠,麻醉后断头取脑,依次将切片放入二甲苯15 min,无水乙醇5 min,85%乙醇5 min,75%乙醇5 min,蒸馏水洗涤。石蜡切片脱蜡至水后,以EDTA抗原修复缓冲液(pH 8.0)进行抗原修复,于PBS脱色,加入牛血清白蛋白孵育30 min,分别加入VEGF抗体(1∶3000)和CD34抗体(1∶100),4 ℃孵育过夜;PBS洗涤后加入二抗,室温避光孵育50 min,洗涤后加入DAPI染液,室温避光孵育10 min,洗涤后用抗荧光淬灭封片剂封片,于荧光显微镜下观察并拍照,采用Image J 1.8.0软件,随机取海马区5个视野,分别对5个视野中CD34阳性细胞计数,取5个视野的均数,参考Weidner法[17]计算MVD值;采用Image J 1.8.0软件分析VEGF阳性表达的平均荧光强度。
2.6 活血荣络方对MCAO/R大鼠脑组织KLF4和VEGF蛋白表达的影响
各组剩余的5只大鼠,麻醉后断头取脑,取梗死侧脑组织皮质区,加入裂解液匀浆,采用BCA蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶,室温封闭1.5 h,分别加入KLF4、VEGF抗体(1∶1000),4 ℃孵育过夜;TBST洗涤3次,10 min/次,加入山羊抗兔抗体(1∶10 000),室温孵育60 min,洗涤后显色成像,采用Image J 1.8.0分析条带灰度值。
2.7 活血荣络方对MCAO/R大鼠脑组织miR-34a、miR-34b和miR-34c mRNA表达的影响
按照试剂盒说明书提取各组大鼠脑组织皮质区总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1,以为内参。

表1 引物序列
2.8 大鼠脑组织miR-34家族基因与mNSS、KLF4和VEGF的相关性
根据模型组、活血荣络方组、丁苯酞组大鼠7 d的mNSS、脑组织中KLF4、VEGF相对蛋白表达量与脑组织中miR-34家族基因表达量,采用SPSS 23.0软件进行相关性分析,并通过R语言3.6.3分别绘制、、与mNSS、KLF4、VEGF之间的相关性分析图。当<0.05时,则两变量存在相关性;>0时为正相关,<0为负相关;0≤ï½<0.3为低度相关,0.3≤ï½<0.5为中度相关,0.5≤ï½<1为高度相关;ï½越大,相关关系越大。
2.9 统计学方法
3 结果
3.1 活血荣络方对MCAO/R大鼠mNSS的影响
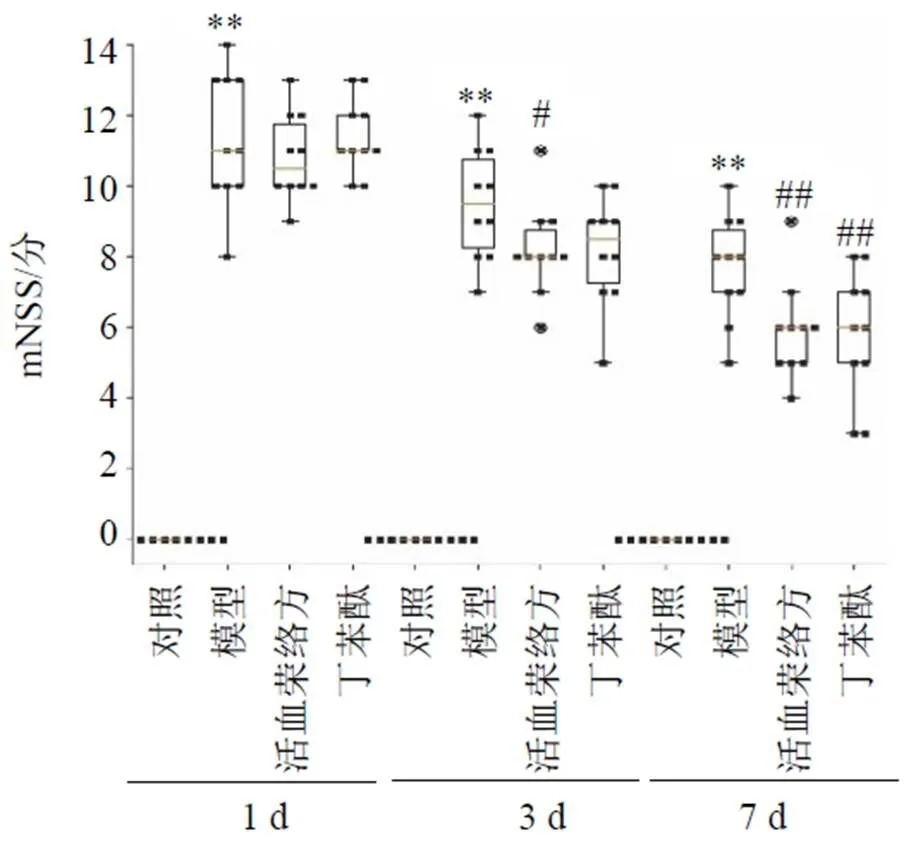
如图1所示,与对照组比较,模型组大鼠mNSS显著升高(<0.01),神经功能缺损严重;与模型组比较,活血荣络方组3 d mNSS显著降低(<0.05),各给药组7 d mNSS显著降低(<0.01),神经功能明显改善。
3.2 活血荣络方对MCAO/R大鼠脑组织海马区CD34和皮质区VEGF表达的影响
如图2所示,与对照组比较,模型组大鼠海马区MVD数量和皮质区VEGF表达显著升高(<0.01);与模型组比较,各给药组海马区MVD数量和皮质区VEGF阳性表达均显著升高(<0.01)。
与对照组比较:**P<0.01;与模型组比较:#P<0.05 ##P<0.01,下同
3.3 活血荣络方对MCAO/R大鼠脑组织KLF4和VEGF蛋白表达的影响
如图3所示,与对照组比较,模型组脑组织中KLF4和VEGF蛋白表达水平显著升高(<0.01);与模型组比较,各给药组KLF4和VEGF蛋白表达水平均进一步升高(<0.01)。
3.4 活血荣络方对MCAO/R大鼠脑组织miR-34a、miR-34b和miR-34c mRNA表达的影响
如图4所示,与对照组比较,模型组脑组织、、mRNA表达水平均显著升高(<0.01);与模型组比较,各给药组脑组织、、mRNA表达水平均显著降低(<0.01)。
3.5 大鼠脑组织中miR-34家族基因与mNSS、KLF4和VEGF的相关性
如图5所示,mNSS与、、呈高度正相关,相关系数()分别为0.60、0.56、0.56(<0.05);VEGF与、、呈高度负相关,分别为−0.58、−0.58、−0.69(<0.05);KLF4与呈高度负相关,为−0.64(<0.05),与呈高度负相关,为−0.88(<0.01)。
图2 活血荣络方对MCAO/R大鼠脑组织海马区CD34和皮质区VEGF表达的影响 (×400)
Fig. 2 Effect of Huoxue Rongluo Recipe on expressions of CD34 in hippocampus and VEGF in cortex of MCAO/R rats (× 400)
4 讨论
脑梗死疾病发生后,局部低氧致血管新生诱导因子在脑组织中高表达,推进由诱导因子与抑制因子组成的血管新生平衡向促进修复的方向移动,启动内源性血管新生,形成大量微血管,为缺血缺氧脑组织提供灌注与营养。VEGF作为血管新生诱导因子,脑梗死后低氧环境能诱导其应激性表达增高,进而促进ECs增殖、迁移、分化成管,调控血管通透性,改善脑微循环,是脑梗死后血管新生的标志蛋白之一[18]。KLF4/VEGF轴可介导下游磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)通路[19]、磷脂酶C-γ1(phospholipase C γ-1,PLCγ-1)-蛋白激酶C(protein kinase C,PKC)通路[20]、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路[21],促进ECs增殖、迁移、分化成管,调控Rho家族蛋白促进血管伪足形成[22],在多种疾病血管新生中发挥重要作用[23]。研究发现,KLF4在脑梗死疾病中过表达[24],能够通过转录激活肺腺癌转移相关转录物1(metastasis associated lung adenocarcinoma transcript 1,MALAT1)抑制脑梗死后血管内皮细胞凋亡[25],也能够通过改善血管内皮炎性反应并调节紧密蛋白表达[26],从而减轻脑血管损伤,促进脑梗死后神经功能恢复。因此,脑梗死后血管新生的作用机制可能与低氧诱导激活KLF4/VEGF传导轴并介导下游通路、改善脑血管损伤、促进神经功能恢复有关。

图3 活血荣络方对MCAO/R大鼠脑组织KLF4和VEGF蛋白表达的影响

图4 活血荣络方对MCAO/R大鼠脑组织miR-34a、miR-34b和miR-34cmRNA表达的影响

图5 大鼠脑组织中miR-34家族基因与mNSS、KLF4和VEGF的相关性
miRNA是一类广泛长度约为22个碱基的非编码RNA,能够特异性识别下游目的基因mRNA 3’UTR,并形成不完全互补配对,裂解下游目的基因mRNA,进而阻断下游目的基因表达,参与调控ECs的增殖、迁移、分化成管的过程[27]。miR-34家族基因由、、组成,能够靶向负调控血管新生,为抗血管新生药物的开发提供了前景[28]。何灏龙等[29]通过微阵列技术发现miR-34家族基因在脑梗死大鼠模型中差异表达,归属于MAPK、JAK2/STAT3等信号通路,参与脑梗死疾病后的神经功能恢复过程。同时本课题组前期通过Targetscan数据库[30](http://www.targetscan.org/ vert_72/)发现,KLF4的转录后翻译过程主要受miR-34家族基因调控,其中的预测分数为97分,权重分数为−0.48;的预测分数为97分,权重分数为−0.49;的预测分数为97分,权重分数为−0.49。基于此,可初步认为脑梗死疾病发生后,miR-34家族基因可能靶向调控KLF4/VEGF传导轴,参与脑梗死后血管新生进程。
《中国急性缺血性脑卒中诊治指南(2018)》[31]指出,脑梗死早期不能溶栓者,早期建议使用丁苯酞、人尿激肽原酶等药物,以改善脑循环(II级推荐,B级证据)。丁苯酞是国内开发的I类新药,能够有效改善脑梗死患者脑缺血区微循环及侧支循环,促进脑梗死后血管新生,增加脑缺血区的脑血流灌注,改善神经功能缺损[32]。但是临床上改善脑梗死患者侧支循环药物相对较少,临床疗效有待进一步提升,因此以脑梗死后3级侧支循环血管新生为切入点,在中医荣气气化理论指导下,研究活血荣络方促脑梗死后血管新生的分子机制,应用于临床转化,具有重要的意义。
本研究表明,活血荣络方与丁苯酞均能够改善脑梗死大鼠神经功能缺损症状,且随着给药时间延长,效果越明显。CD34、VEGF被认为是血管生成的间接标志物[33],CD34是ECs首选标志物,是ECs损伤后修复的重要物质之一,VEGF与缺血区周围新生血管数量密切相关,血管新生发生时CD34与VEGF正相关。杨洋等[34]采用CD34标记海马区新生血管,证实脑梗死大鼠模型中细胞外信号调节蛋白激酶1/2(extracellular regulated protein kinases 1/2,ERK1/2)通路的激活能够启动内源性血管新生;Chan等[35]采用VEGF标记皮质区新生血管,证实硫酸乙酰肝素能够促进脑梗死后血管新生,进而改善神经功能。免疫荧光结果显示,脑梗死大鼠海马区CD34阳性细胞数目与皮质区VEGF平均荧光强度较对照组明显升高,且药物干预作用下,二者表达水平进一步升高,提示脑梗死疾病发生后,机体可启动内源性血管新生,且活血荣络方与丁苯酞能够进一步促进脑梗死后血管新生。Western blotting结果显示,脑梗死大鼠脑组织中KLF4和VEGF蛋白表达较对照组升高,且药物干预作用下,二者表达水平进一步升高,提示脑梗死后血管新生的作用机制与激活KLF4/VEGF传导轴有关。qRT-PCR结果显示,脑梗死大鼠脑组织中、、mRNA表达水平均显著升高,且药物能降低其表达水平,结合Pearson相关性分析结果,提示活血荣络方与丁苯酞改善脑梗死大鼠神经功能缺损症状与miR-34家族基因调控KLF4/VEGF传导轴相关。Jauhari等[36]研究发现miR-34家族基因在分化和衰老的脑细胞中高表达;Pandey等[37]研究发现miR-200与miR-34家族基因能够靶向KLF4,在神经元的增殖分化中发挥关键作用;Li等[38]研究发现缺血缺氧环境下,抑制表达,能够激活KLF4/VEGF轴,促进人脐静脉内皮细胞HUVEC增殖、迁移、分化成管;Peng等[39]研究发现异氟醚能够激活转化生长因子-β2(transforming growth factor-β2,TGF-β2)/SMAD3通路,增加VEGF与CD34表达,促进脑梗死后血管新生,改善脑梗死大鼠神经功能缺损症状,在一定程度上与本研究结果相互佐证。
综上所述,活血荣络方能够促进脑梗死后血管新生,改善神经功能缺损症状,可能与抑制、、mRNA表达,进而激活KLF4/VEGF传导轴有关,本研究为中药改善脑循环、防治脑梗死疾病提供了依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 肖波. 神经病学[M]. 第4版. 北京: 人民卫生出版社, 2019: 179-189.
[2] GBD DALYs and HALE Collaborators. Global, regional, and national disability-adjusted life-years (DALYs) for 359 diseases and injuries and healthy life expectancy (HALE) for 195 countries and territories, 1990-2017: A systematic analysis for the Global Burden of Disease Study 2017 [J]., 2018, 392(10159): 1859-1922.
[3] 杨仁义, 周德生, 傅馨莹, 等. 基于STAT3/miRNA反馈环路探讨中医药促脑梗死后血管新生的调控机制 [J]. 中国实验方剂学杂志, 2020, 26(20): 221-228.
[4] 高长玉, 吴成翰, 赵建国, 等. 中国脑梗死中西医结合诊治指南(2017) [J]. 中国中西医结合杂志, 2018, 38(2): 136-144.
[5] 周韩, 周德生, 刘利娟, 等. 缺血中风荣气虚滞病机源流 [J]. 中医学报, 2019, 34(9): 1844-1849.
[6] 周德生, 张雪花, 谭静. 荣气虚滞论 [J]. 中医药通报, 2005, 4(2): 22-25.
[7] 杨仁义, 周德生, 傅馨莹, 等. 基于“荣气理论-促血管新生”探讨脑梗死的防治策略 [J]. 湖南中医药大学学报, 2020, 40(12): 1562-1566.
[8] 李中, 周德生, 江元璋, 等. 活血荣络颗粒联合针刺八脉交会穴治疗脑梗死痉挛性瘫痪临床研究 [J]. 中国中医药信息杂志, 2017, 24(5): 22-26.
[9] Zhou D, Li M, Hu H,. Huoxue Rongluo Tablet reduces matrix metalloproteinase-9 expression in infarcted brain tissue [J]., 2013, 8(34): 3216-3224.
[10] 周颖璨, 王洪海, 周德生, 等. 活血荣络方对大鼠脑缺血再灌注损伤JAK2、STAT3表达的影响 [J]. 时珍国医国药, 2017, 28(9): 2111-2114.
[11] 周德生, 刘利娟, 寇志刚, 等. 活血荣络片对大脑中动脉缺血模型大鼠脑组织微囊蛋白-1表达的影响 [J]. 河北中医, 2016, 38(1): 80-84.
[12] 周德生, 刘利娟, 寇志刚, 等. 活血荣络片对大鼠MCAO模型脑组织MVD表达的影响 [J]. 河南中医, 2015, 35(5): 956-959.
[13] 杨仁义, 刘利娟, 康蕾, 等. 基于网络药理学的活血荣络方对脑梗死血管新生作用机制研究 [J]. 中国中医药信息杂志, 2020, 27(8): 98-105.
[14] 康蕾. 基于GEO数据库筛选脑梗死大鼠血清生物标志物及活血荣络方干预作用研究 [D]. 长沙: 湖南中医药大学, 2020.
[15] Longa E Z, Weinstein P R, Carlson S,. Reversible middle cerebral artery occlusion without craniectomy in rats [J]., 1989, 20(1): 84-91.
[16] Hu G J, Feng Y G, Lu W P,. Effect of combined VEGF165/SDF-1 gene therapy on vascular remodeling and blood perfusion in cerebral ischemia [J]., 2017, 127(3): 670-678.
[17] Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors [J]., 1995, 36(2): 169-180.
[18] Jiang Y L, Liu W W, Wang Y,. MiR-210 suppresses neuronal apoptosis in rats with cerebral infarction through regulating VEGF-notch signaling pathway [J]., 2021, 25(1): 2.
[19] Cheng S Y, Zhang X X, Feng Q,. Astragaloside IV exerts angiogenesis and cardioprotection after myocardial infarction via regulating PTEN/PI3K/Akt signaling pathway [J]., 2019, 227: 82-93.
[20] Matsushima S, Shimizu A, Kondo M,. Anosmin-1 activates vascular endothelial growth factor receptor and its related signaling pathway for olfactory bulb angiogenesis [J]., 2020, 10(1): 188.
[21] Icli B, Li H, Pérez-Cremades D,. MiR-4674 regulates angiogenesis in tissue injury by targeting p38K signaling in endothelial cells [J]., 2020, 318(3): C524-C535.
[22] Hoang M V, Whelan M C, Senger D R. Rho activity critically and selectively regulates endothelial cell organization during angiogenesis [J]., 2004, 101(7): 1874-1879.
[23] Mai J, Zhong Z Y, Guo G F,. Polo-Like Kinase 1 phosphorylates and stabilizes KLF4 to promote tumorigenesis in nasopharyngeal carcinoma [J]., 2019, 9(12): 3541-3554.
[24] Sakuma R, Takahashi A, Nakano-Doi A,. Comparative characterization of ischemia-induced brain multipotent stem cells with mesenchymal stem cells: Similarities and differences [J]., 2018, 27(19): 1322-1338.
[25] Yang H J, Xi X X, Zhao B,. KLF4 protects brain microvascular endothelial cells from ischemic stroke induced apoptosis by transcriptionally activating MALAT1 [J]., 2018, 495(3): 2376-2382.
[26] Zhang X Y, Wang L, Han Z X,. KLF4 alleviates cerebral vascular injury by ameliorating vascular endothelial inflammation and regulating tight junction protein expression following ischemic stroke [J]., 2020, 17(1): 107.
[27] Wade S M, Ohnesorge N, McLoughlin H,. Dysregulated miR-125a promotes angiogenesis through enhanced glycolysis [J]., 2019, 47: 402-413.
[28] Maroof H, Salajegheh A, Smith R A,. Role of microRNA-34 family in cancer with particular reference to cancer angiogenesis [J]., 2014, 97(2): 298-304.
[29] 何灏龙, 郑慧娥, 高音来, 等. 针刺调控脑缺血再灌注损伤大鼠缺血侧海马差异miRNA信号归属通路及mir-34c-3p表达的研究 [J]. 中国康复医学杂志, 2020, 35(11): 1290-1295.
[30] Agarwal V, Bell G W, Nam J W,. Predicting effective microRNA target sites in mammalian mRNAs [J]., 2015, 4: e05005.
[31] 中华医学会神经病学分会, 中华医学会神经病学分会脑血管病学组. 中国急性缺血性脑卒中诊治指南(2018) [J]. 中华神经科杂志, 2018, 51(9): 666-682.
[32] Wei H, Zhan L P, Zhang B,. Dl-3n-butylphthalide reduces oxygen-glucose deprivation-induced endothelial cell damage by increasing PGC-1α [J]., 2019, 23(10): 4481-4490.
[33] Carmeliet P, Jain R K. Molecular mechanisms and clinical applications of angiogenesis [J]., 2011, 473(7347): 298-307.
[34] 杨洋, 刘晓楠, 马超, 等. ERK1/2信号传导通路在大鼠局灶性急性脑缺血再灌注中的作用 [J]. 中国动脉硬化杂志, 2013, 21(11): 987-992.
[35] Chan S J, Esposito E, Hayakawa K,. Vascular endothelial growth factor 165-binding heparan sulfate promotes functional recovery from cerebral ischemia [J]., 2020, 51(9): 2844-2853.
[36] Jauhari A, Singh T, Singh P,. Regulation of miR-34 family in neuronal development [J]., 2018, 55(2): 936-945.
[37] Pandey A, Singh P, Jauhari A,. Critical role of the miR-200 family in regulating differentiation and proliferation of neurons [J]., 2015, 133(5): 640-652.
[38] Li Y Z, Wen L, Wei X,. Inhibition of miR-7 promotes angiogenesis in human umbilical vein endothelial cells by upregulating VEGF via KLF4 [J]., 2016, 36(3): 1569-1575.
[39] Peng L, Yin J W, Wang S,. TGF-β2/Smad3 signaling pathway activation through enhancing VEGF and CD34 ameliorates cerebral ischemia/reperfusion injury after isoflurane post-conditioning in rats [J]., 2019, 44(11): 2606-2618.
Mechanism of Huoxue Rongluo Recipe on promoting angiogenesis after cerebral infarction based on miR-34 regulating KLF4/VEGF conduction axis
YANG Ren-yi1, YAN Si-yang1, ZHOU De-sheng2, FU xin-ying1, MA Qiang1, ZHANG Yu-xing1, GAO Xiao-feng2, LIU Li-juan2
1. Hunan University of Chinese Medicine, Changsha 410208, China 2. The First Hospital of Hunan University of Chinese Medicine, Changsha 410007, China
Based on the correlation between miR-34 family genes and Kruppel-like factor 4 (KLF4)/vascular endothelial growth factor (VEGF) conduction axis to investigate the mechanism of Huoxue Rongluo Recipe (活血荣络方) on promoting angiogenesis after cerebral infarction.SD rats were randomly divided into control group, model group, Huoxue Rongluo Recipe (11.7 g/kg) group and butylphthalide (60 mg/kg) group, 10 rats in each group. Middle cerebral artery occlusion/reperfusion (MCAO/R) rats model were established, and rats were ig drugs for 7 d. Modified neurological severity score (mNSS) was used to evaluate the symptoms of neurological deficit in rats; Immunofluorescence staining was used to observe the expression of CD34 in hippocampus and VEGF in cortex; Western blotting was used to detect the expression of KLF4 and VEGF in infarcted brain tissue; qRT-PCR was used to detect the expression of miR-34 family genes in brain tissue; Pearson correlation analysis was used to observe the correlation between miR-34 family genes and mNSS, KLF4 and VEGF.Huoxue Rongluo Recipe significantly improved the symptoms of neurological deficits in rats (< 0.01), increased expression of CD34 positive cells in hippocampus and expression of VEGF in cortex (< 0.01), enhanced expression of KLF4 and VEGF protein in brain tissue (< 0.01), inhibited mRNA expressions of,and(< 0.01); mNSS was highly positively correlated with,and(< 0.05); VEGF was highly negatively correlated with,and(< 0.05); KLF4 was highly negatively correlated with(< 0.05), highly negatively correlated with(< 0.01).Huoxue Rongluo Recipe can inhibit expressions of,and, activate KLF4/VEGF conduction axis, promote angiogenesis after cerebral infarction, and then improve the symptoms of neurological deficits.
Huoxue Rongluo Recipe; cerebral infarction; angiogenesis; KLF4; VEGF; miR-34
R285.5
A
0253 - 2670(2021)16 - 4873 - 09
10.7501/j.issn.0253-2670.2021.16.012
2021-02-04
国家自然科学基金资助项目(81874463);湖南省科技厅科技创新平台与人才计划项目(2017SK4005);湖南省重点研发计划项目(2020SK2092);湖南省财政中医药项目名院工程(rsk-010-013/006-09);湖南省教育厅一般项目(20C1405);湖南省卫健委科研项目(202103071190);湖南省中医药管理局资助项目(202038,202046,2021218);湖南省研究生创新项目(CX20190587);湖南中医药大学中西医结合一流学科开放基金项目(2019ZXYJH08,2018ZXYJH10);湖南中医药大学研究生培养质量工程专项(2020CX62)
杨仁义(1996—),男,硕士研究生,从事神经系统疾病的中医药防治研究。Tel: 15700726938 E-mail: 792799735@qq.com
刘利娟(1985—),女,博士,主治医师,从事中医药对脑血管病及其并发症的防治研究。Tel: (0731)85369768 E-mail: 601264967@qq.com
[责任编辑 李亚楠]
