多肽胶束负载二氢卟吩e6促进小鼠骨髓源性树突状细胞抗原呈递功能的研究①
2021-08-21王策吴莹娟苏少玩李富荣深圳市人民医院暨南大学第二临床医学院南方科技大学第一附属医院转化医学协同创新中心深圳518020
王策 吴莹娟 苏少玩 李富荣(深圳市人民医院(暨南大学第二临床医学院,南方科技大学第一附属医院)转化医学协同创新中心,深圳518020)
基于蛋白质/肽载体构建的治疗性癌症疫苗作为一种有前途的癌症免疫疗法通过激发患者的抗癌免疫消除癌细胞[1]。有效的抗癌疫苗应该能触发CD8+T细胞活化及抗肿瘤细胞毒T淋巴细胞(cytotoxic T lymphocyte,CTL)反应,需要MHCⅠ类(MHCⅠ)抗原提呈细胞如树突状细胞(dendritic cells,DCs)和巨噬细胞[1-2]。获得最佳MHCⅠ抗原呈现,蛋白质/肽抗原需要降解变成小肽,主要通过蛋白酶体途径。然而肿瘤衍生的蛋白质或肽抗原通常经过内/溶酶体途径,更有利于MCHⅡ而不是MHCⅠ抗原呈递[2-3]。因此,增强肿瘤抗原的MHCⅠ类抗原提呈有望提高癌症疫苗的功效。
活性氧(reactive oxygen species,ROS)作为细胞内的副产物氧化磷酸化,参与先天性和适应性免疫反应[4]。既往研究表明,激光或过氧化氢引发的ROS可作为一种“危险”信号促进DC成熟并增强其促进T细胞增殖的能力[5]。近期研究表明,ROS不仅会导致细胞内蛋白质的氧化损伤,也可增强蛋白酶体的激活,从而成为病毒感染组织中增强MHCⅠ递呈的关键机制[6-7]。然而,ROS是否参与抗原提呈细胞中可溶性抗原的交叉递呈尚不清楚。
ROS诱导剂种类多样,其中二氢卟吩e6(chlorin e6,Ce6)因其产生单线态氧的效率很高被广泛应用,故适合开发用于光动力治疗[8]。迄今为止,大部分光敏剂都表现为疏水性,在溶液中容易聚集,故在实际应用中面临困难。由此以纳米颗粒、聚合物类、糖类、脂类等为基础的纳米探针逐渐发展,成为Ce6实际应用的新型模式[9-11]。
多肽所具备的惰性使其性质相对稳定且安全,同时具有合成方法简单、易修饰、生物相容性好等优点[12]。聚多肽作为一种研究较为成熟的纳米材料,不仅是一种理想的光热转换材料,且可作为药物载体,因此在多种疾病诊疗一体化的研究中得到广泛应用[13-15]。
本研究将多肽作为载体,与光敏剂Ce6物理吸附后形成多肽胶束(polypeptide micelles,PM)@Ce6。本文比较PM@Ce6与Ce6对DC的抗原呈递效果,及其在治疗肺癌中潜在的应用价值。
1 材料与方法
1.1 材料O-(2-氨基乙基)-O'-(2-甲基)聚乙二醇(PEG-NH2,Mw=2 000)购自Sigma公司;L-亮氨酸(LLeu)和ε-苄氧羰基-L-赖氨酸(LLZ)购自德国劳氏生物化工有限公司;卵清蛋白(OVA,V级)购自Sigma公司;Ce6购自百灵威公司;DMEM高糖培养基购自Hyclone公司;X-vivo 15培养基购自Lanza公司;新生牛血清(NBS)购自Gibco公司;Annexin VFITC/PI细胞凋亡检测试剂盒购自翊圣生物公司;MTT及Hoechst 33342染色液购自Sigma公司;2,7-二氯二氢荧光素乙酸酯(DCFH-DA)购自Sigma公司;5,6-羧荧光素二乙酸酯琥珀酰亚胺酯(CFSE)购自Invitrogen公司;氯化二亚苯基碘(DPI,NADPH氧化酶抑制剂)购自Sigma公司;重组小鼠GM-CSF、IL-4和IL-2购自Peprotech公司;荧光标记抗鼠单克隆抗体购买抗体(CD8和CD11c)购自eBioscience公司;蛋白酶体活性荧光分析试剂盒购自Biovision公司;小鼠细胞因子ELISA试剂盒(IFN-γ)购自BioLegend公司;CD8+T细胞纯化试剂盒购自Miltenyi Biotec公司;6~8周龄C57BL/6J小鼠购自广东省实验动物中心;紫外分光光度计购自美国Agilent公司;酶标仪购自美国Thermo Fisher公司;TCS SP5Ⅱ型激光共聚焦显微镜购自德国Leica公司;Beckman-Coulter型流式细胞仪购自美国贝克曼公司。
1.2 方法
1.2.1 PM@Ce6的制备及其形态学观察采用N-羧酸酐(NCA)开环聚合法合成PEG-PLL-PLLeu共聚物。首先以PEG-NH2为引发剂,通过开环聚合法合成PEG-PLLZ共聚物。其次,采用PEG-PLLZ引发L-亮氨酸N-羧酸酐(LLeu-NCA)的开环聚合,合成了PEG-PLLZ-PLLeu共 聚 物。PEG-NH2与LLZ-NCA、LLeu-NCA的摩尔比为1:30:40。然后用冷冻干燥法收集产物,用Bruker-400 mhz核磁共振仪进行分析。最后将适量的Ce6加入PM溶液,37℃恒温振荡箱中避光孵育12 h,离心洗涤得到PM@Ce6。取适量合成的PM@Ce6悬液,通过粒径仪检测平均粒径及分布情况。PM@Ce6浓度以负载上的Ce6计算:通过紫外分光光度计测定并得到Ce6标准曲线,计算包封率。
1.2.2 小鼠骨髓来源树突状细胞(BMDC)的培养和刺激BMDC来源于C57BL/6小鼠骨髓[16]。小鼠骨髓在含GM-CSF(20 ng/ml)和IL-4(10 ng/ml)的X-vivo 15培养基中37℃培养6 d,获得未成熟DC。
1.2.3 PM@Ce6经激光后对BMDC产生ROS的作用首先,BMDCs以1×106个/孔接种于预先包被多聚赖氨酸的共聚焦培养皿,在37℃、5%CO2条件下培养24 h。实验分成5组:①OVA处理组:10µg/ml OVA处理20 h;②Ce6/OVA处理组:15 µg/ml Ce6和10 µg/ml OVA作用20 h;③Ce6/OVA+DPI处理组:提前2 h加入5 mmol/L DPI,再加入15 µg/ml Ce6和10 µg/ml OVA作用20 h;④PM@Ce6/OVA处理组:15µg/ml的PM@Ce6和10µg/ml OVA作用20 h;⑤PM@Ce6/OVA+DPI处理组:提前2 h加入5 mmol/L DPI,再 加 入15 µg/ml的PM@Ce6和10 µg/ml OVA作用20 h。吸弃上清,PBS洗涤2次后,加入1 ml培养基,用波长为633 nm的He-Ne NIR照射6 min后继续避光孵育4 h。吸弃上清,PBS洗涤2次后,加入含20 mmol/L DCFH-DA无血清培养基1 ml,于37℃下孵育30 min。吸弃上清,PBS洗涤2次,激光共聚焦观察ROS表达情况。另取一部分BMDCs以1×106个/孔接种于24孔板,重复上述操作,流式细胞术检测各组细胞荧光强度,以平均荧光强度代表ROS含量,实验重复3次。
1.2.4 PM@Ce6经激光后对DC蛋白酶体活性的影响为了测定蛋白酶体活性,将实验按1.2.3中方法分成5组。然后利用荧光分析试剂盒评估蛋白酶体活性。吸弃上清,PBS洗涤2次后,样本孔加入50µl含0.5%NP-40的PBS裂解细胞,补加蛋白酶体分析缓冲液至100µl。设阳性对照孔:10µl阳性对照物,补加蛋白酶体分析缓冲液至100µl。另设抑制剂对照组:重复上述操作,每孔加1µl蛋白酶体抑制剂。对应孔加1µl蛋白酶体分析缓冲液。最后将上述各孔均加入蛋白酶体底物1µl,避光混匀。37℃下酶标仪检测Ex/Em=350/440 nm处各孔30~60 min荧光动力学变化。T1读取不含蛋白酶体抑制剂孔的蛋白酶体活性值RFU1和含蛋白酶体抑制剂孔的非蛋白酶体活性值iRFU1。30 min后,读取T2时的RFU2和iRFU2。蛋白酶体活性产生ΔRFU=(RFU2–iRFU2)-(RFU1-iRFU1),然后将ΔRFU应用于AMC标准曲线得到B值。T1和T2间产生的蛋白酶体活性=B/(T2-T1)/预处理样本体积×样本稀释倍数。
1.2.5 PM@Ce6经激光后对DC抗原提呈的作用检测BMDC诱导的CD8+和CD4+T细胞增殖[17]。首先按1.2.3中方法,分别获得OVA、Ce6/OVA、Ce6/OVA+DPI、PM@Ce6/OVA、PM@Ce6/OVA+DPI处理的BMDCs。其次获得OVA特异性T细胞,6~8周雌性C57BL/6小鼠腹腔注射20µg OVA+20µg佐剂PolyI:C,每周1次,连续免疫3次[17-18]。最后1次免疫后7 d,获取小鼠脾脏,制备脾细胞悬液,用CD8+T细胞纯化试剂盒负性分选纯化脾脏中CD8+T细胞,CD8+T细胞纯度大于90%。具体方法:将细胞悬液300 g离心10 min,吸去上清。加入40µl/107个细胞的缓冲液和10µl/107个细胞的生物素抗体混合物,混合均匀后,4℃孵育10 min。然后加入30µl/107个细胞的缓冲液和20µl/107个细胞的抗生物素磁珠,混合均匀后,4℃孵育15 min。加入2 ml缓冲液,300 g离心10 min。以500µl缓冲液重悬细胞。先将色谱柱置于MACS分离器的磁场中,然后将细胞悬液滴入柱内,收集流出未标记的细胞,表示CD8+T细胞。另外回收柱内细胞,利用CD4作为表面标志通过分选型流式细胞仪进一步纯化,获得CD4+T细胞。
最后分别将上述获得CD8+T细胞和CD4+T细胞进行CFSE预标记。5 µmol/L CFSE溶液制备细胞悬液(1×107个/ml),室温下避光孵育10 min后,加入等体积全培养液混匀,4℃下1 400 r/min离心5 min,重复洗涤1次。分别将CFSE标记的CD8+T细胞和CD4+T细胞与上述获得的不同处理的BMDCs按10:1和5:1接种于24孔培养板,于37℃、5%CO2条件下用培养48 h。流式细胞术检测CFSElowCD8+T细胞的增殖代表BMDC的MHCⅠ抗原呈递,CF SElowCD4+T细胞的增殖代表BMDC的MHCⅡ抗原呈递。ELISA法检测培养上清液中IFN-γ含量。
1.3 统计学处理采用Graphpad Prism软件进行数据统计,组间数据资料对比采用ANOVA分析,以P<0.05表示差异具有统计学意义。
2 结果
2.1 PM@Ce6的表征
2.1.1 PM@Ce6的粒径使用粒径仪检测合成的PM/OVA、PM@Ce6和PM@Ce6/OVA的粒径大小。PM@Ce6的粒径分布情况如图1所示,PM@Ce6粒径在170 nm左右,且粒径较均一。

图1 PM@Ce6粒径分布Fig.1 Size distribution of PM@Ce6
2.1.2 PM@Ce6的形态对PM/OVA、PM@Ce6和PM@Ce6/OVA纳米复合物在PBS溶液中的稳定性进行检测,结果表明PM/OVA、PM@Ce6和PM@Ce6/OVA纳米复合物在4℃的PBS溶液中放置2周后,颗粒大小均一,稳定性良好(图2)。
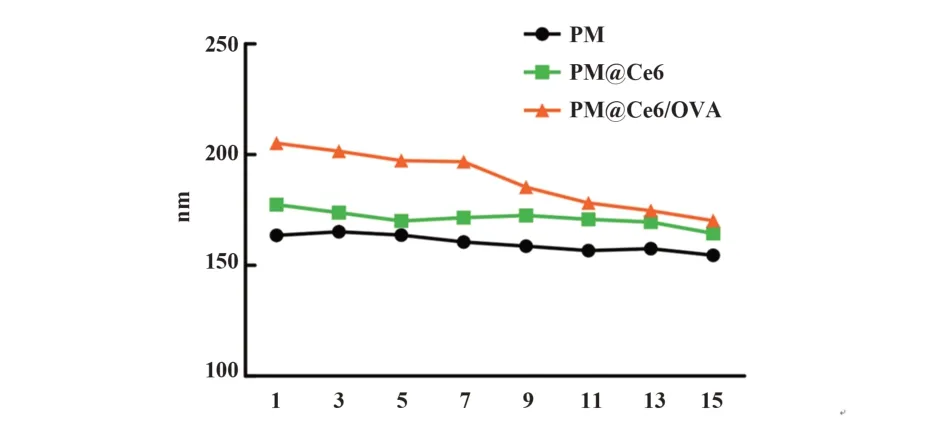
图2 PM@Ce6的稳定性Fig.2 Stability of PM@Ce6
2.1.3 探针PM@Ce6包封率Ce6的标准曲线如图3所示,y=0.000 825x+0.135,该曲线中各点较均匀地分散在曲线两侧,分散系数为0.999,说明该标准曲线拟合程度高,误差小,可以进一步应用。本研究计算得出PM@Ce6中Ce6的包封率约为47%。
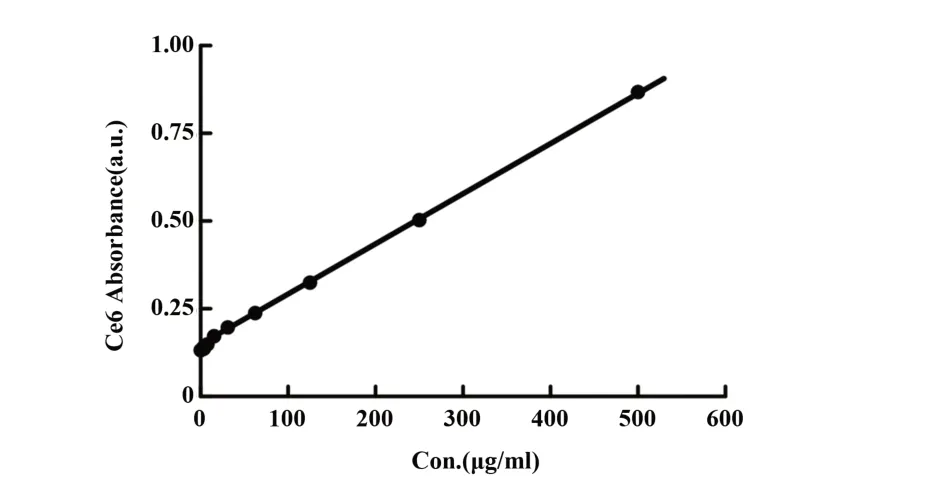
图3 Ce6的标准曲线Fig.3 Standard curve of Ce6
2.1.4 紫外分光光度计表征分别将Ce6和PM@Ce6溶液分散于超纯水中,紫外分光光度计测定情况如图4。Ce6在波长400 nm和660 nm有特征峰,探针PM@Ce6在相应波长处也出现了与Ce6相同的特征峰,说明Ce6已成功负载到该纳米多肽PM@Ce6中。

图4 Ce6和PM@Ce6的紫外可见吸收光谱Fig.4 UV-Vis spectrophotometry of Ce6 and PM@Ce6
2.2 PM@Ce6通过增强ROS激活蛋白酶体活化PM@Ce6或Ce6与DC细胞共孵育20 h后,经NIR照射,再孵育4 h。共聚焦观察结果显示,Ce6单独轻微诱导ROS产生,而PM@Ce6显著增强ROS产生。表明在激光照射下,PM@Ce6较Ce6对BMDC有更好的增强ROS的效果。另外,采用抗氧化剂DPI阻断后,明显抑制ROS产生(图5A)。流式检测结果显示,PM@Ce6/OVA组与OVA组相比,ROS表达上调2.5倍。抗氧化剂DPI阻断后PM@Ce6/OVA组ROS表达显著降低(P<0.01,图5B)。
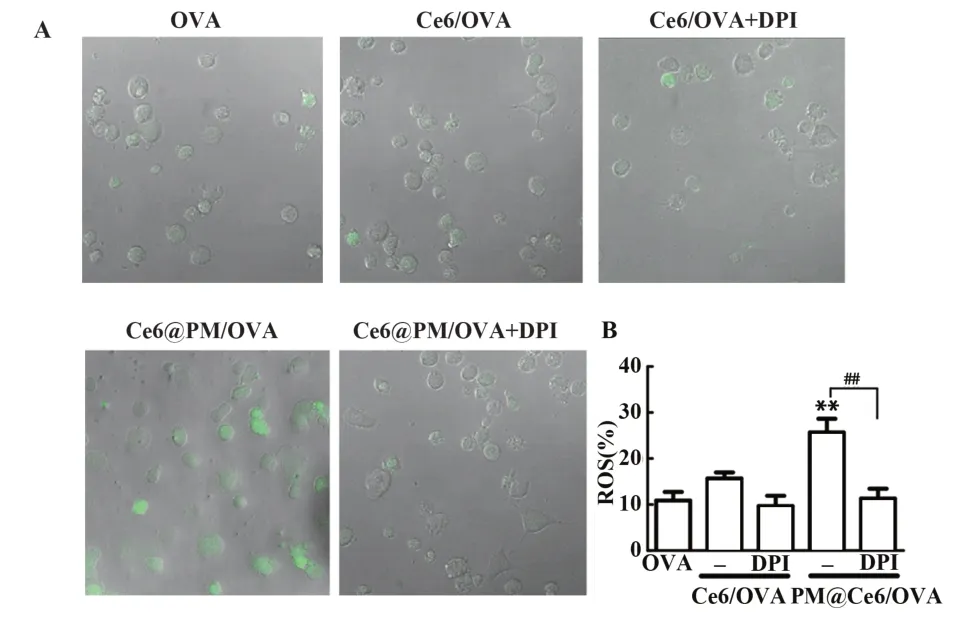
图5 PM@Ce6对BMDCs产生ROS的影响Fig.5 Effect of PM@Ce6 on ROS production by BMDCs
此外,如图6所示,PM@Ce6/OVA 2倍提高蛋白水解酶活性,而预处理DPI后显著降低蛋白酶体活性。且蛋白酶体活性与BMDC中的ROS含量成正相关(图7)。这些数据表明,PM@Ce6/OVA可通过触发ROS提高蛋白酶体活性。

图6 PM@Ce6对BMDCs蛋白酶体的活化影响Fig.6 Effect of PM@Ce6 on proteasome activity by BMDCs

图7 蛋白酶体与ROS相关性分析Fig.7 Correlation analysis of proteasome and ROS
2.3 PM@Ce6显著增强DC抗原呈递效果图8A~C显示,PM@Ce6显著增强MCHⅠ抗原呈递,而DPI预处理后,CD8+T细胞增殖明显受到抑制(图8B),同时降低IFN-γ产生(图8C)。此外,研究结果显示,Ce6和PM@Ce6也能增强CD4+CFSElowT细胞增殖,并上调IFN-γ表 达。但PM@Ce6比Ce6更 显 著 地 增 强CD4+CFSElowT细胞增殖。值得注意的是,DPI预处理后,PM@Ce6和PM对CD4+T细胞增殖并没有受到抑制,同时对IFN-γ表达也没有明显改变(图8D、E)。

图8 PM@Ce6对MHC抗原呈递作用Fig.8 Effect of PM@Ce6 on MHC antigen presentation
3 讨论
随着纳米技术的发展,一系列基于自组装纳米胶束的非病毒载体为实现基因治疗的临床应用提供了重要思路和保障[19]。其中,以两亲性多肽共聚物为骨架的纳米颗粒在结构上与天然蛋白相似,具有生物安全性好和可生物降解等优点,因而成为研究者近年来关注的焦点[20]。多肽共聚物纳米载体的核酸负载和转染能力与其氨基酸序列直接相关。RYU等[21]报道在精氨酸-缬氨酸纳米胶束中增加精氨酸的数量可显著提高其转染效率。张先正课题组合成了一系列聚组氨酸-赖氨酸纳米颗粒,结果表明改变氨基酸的序列和数量均可显著改善纳米颗粒的核酸负载能力及转染效率[22]。我们前期的研究发现,改变PEG-PLL-PLLeu多肽纳米胶束中疏水性氨基酸聚合度不但可改善纳米颗粒的生物相容性,还能提高其核酸负载能力。与此同时,增加赖氨酸的数量则显著提高纳米胶束在体内外的转染效率[23]。
本研究先用PEG-NH2与N-羧酸酐(NCA)以开环聚合法合成PEG-PLL-PLLeu共聚物,再物理吸附上光敏剂Ce6,形成具有光敏功能的PM@Ce6。根据粒径仪观察结果表明PM@Ce6颗粒大小约为170 nm,粒径均一,4℃存放2周稳定性良好。本研究中PM@Ce6浓度以负载上的Ce6计算,得到Ce6的包封率约为47%。Ce6和PM@Ce6溶液的紫外分光光度图显示,纳米颗粒PM@Ce6在波长400 nm和660 nm处与光敏剂Ce6具有相似的特征峰,说明PM@Ce6中已成功负载光敏剂Ce6[24]。
越来越多的证据表明ROS在调节先天免疫和适应性免疫,如多形核白细胞和巨噬细胞迁移、淋巴细胞活化和分化以及炎症应答中发挥重要作用[4]。近期研究也发现纳米颗粒诱导产生的ROS也是一种诱导DC成熟的重要调控因子[16,25]。本研究发现,在NIR照射下,PM@Ce6较Ce6更能显著上调BMDC产生ROS,通过DPI对BMDC进行预处理可有效阻止ROS的产生。
另一方面在抗原递呈细胞中,如DC和巨噬细胞,蛋白酶体也是抗原的关键酶,限制性处理MHC I抗原提呈[6]。有研究表明,自由基,如ROS和过氧亚硝酸盐,可提高蛋白酶体活性,继而促进去氧化发生,从而维持细胞内蛋白质稳定[26-27]。然而,ROS是否参与可溶性抗原的交叉表达仍不清楚。在本研究中,BMDC被OVA、Ce6/OVA或PM@Ce6/OVA作用20 h,结果表明PM@Ce6/OVA与OVA相比,可显著增强蛋白体活性,而预处理DPI后蛋白酶体活性显著降低。
此外,本研究表明,蛋白酶体活性与BMDC中的ROS呈正相关。表明在激光照射下,PM@Ce6/OVA通过触发ROS产生提高蛋白酶体活性。PM@Ce6较Ce6更显著地增强MCHⅠ抗原呈递,而DPI预处理后,CD8+T细胞增殖明显受到抑制,同时也降低IFN-γ产生,这结果也与上述蛋白酶体活性的抑制作用一致。值得注意的是,DPI预处理后,PM@Ce6和Ce6对CD4+T细胞增殖并没有受到抑制,对IFN-γ表达也没有明显改变。提示ROS可能不是影响MHCⅡ抗原呈递的关键条件。
综上所述,本文基于多肽胶束PM负载光敏剂Ce6制备新型NIR刺激响应的PM@Ce6载体,其通过NIR照射产生ROS,从而增强DC中蛋白酶体活性和下游MHCⅠ抗原呈递。因此,光敏响应的PM@Ce6有望成为肿瘤疫苗研制的有效载体。
