过敏性疾病体内外模型构建研究进展
2021-08-21郝瑞瑞庞菲靳洪涛
郝瑞瑞庞 菲靳洪涛
(1.中国医学科学院药物研究所,新药安全评价研究中心,北京 100050;2.北京协和建昊医药技术开发有限责任公司,北京 100176)
过敏反应是一种Ⅰ型变态反应,就目前的认识而言,其发生机制主要为两种,一种是以IgE抗体为主参与的IgE依赖性过敏反应,另一种是有IgG抗体参与的非IgE依赖性过敏反应[1-2]。IgE依赖性过敏反应发生分为2个阶段,致敏阶段:抗原初次进入机体,刺激机体产生免疫球蛋白 E(Immunoglobulin E,IgE)抗体,与体内肥大细胞和嗜碱性粒细胞表面IgE高亲和力Fc受体(FcεRI)结合;激发阶段:当致敏阶段相同的抗原再次刺激机体时,抗原与IgE抗体的Fab段结合,两个或两个以上IgE抗体交联,进而FcεRI发生微集聚,启动肥大细胞及嗜碱性粒细胞活化,释放已储存与新合成的生物活性物质,这些生物活性物质会造成平滑肌收缩、腺体分泌增加、毛细血管扩张、通透性增加等一系列效应[3]。IgG抗体引起的过敏反应与IgE引起的被动全身皮肤过敏反应(PSA)相似,主要是低温、血管扩张和心肺变化。其发生机制是在抗原进入机体后,刺激机体产生IgG抗体,IgG抗体与嗜碱性细胞、巨噬细胞、中性粒细胞和肥大细胞表面IgG高亲和力Fc受体(FcγR)形成交联,进而启动上述细胞活化,释放血小板活化因子(PAF)、半胱氨酰白三烯(CysLTs),进而引发全身过敏反应[1]。根据2013年世界变态反应组织白皮书[4],全球过敏性疾病的患病率约为10%~40%,其中有3亿支气管哮喘患者、4亿过敏性鼻炎患者、1.5亿药物过敏患者以及大量荨麻疹、湿疹、结膜炎、血管神经性水肿、昆虫过敏、结膜炎、过敏性休克患者。随着城市化、工业化进程的不断加快,过敏性疾病的发病率呈现上升趋势[5],因此,过敏性疾病探索研究与有效治疗对于提高人类生存质量显得尤为重要。在过敏性疾病研究中,模型的构建极为重要。但当前对于过敏性疾病体内、体外模型构建进行系统的总结、评价性文章并不多见,因此,本文分别从皮肤、呼吸系统、消化系统、神经系统、药物过敏不同系统过敏性疾病以及体内外模型造模方式相结合的角度出发,分别阐述并评价目前研究中所应用的各种不同模型的构建方法、优势与不足,以期对过敏性疾病研究模型的构建提供一定的启发与帮助。
1 皮肤及其附件过敏性疾病模型
皮肤及其附件症状是机体发生过敏反应后最常见的表现之一,包括皮肤瘙痒、泛红、水肿、疼痛等炎症反应。皮肤过敏症状大多是由直接接触药物、粉尘等过敏原或紫外线照射等原因造成的,但也存在机体其他器官系统发生过敏反应后表现为皮肤症状[6-7]。皮肤及其附件的过敏症状原因不是单一的,在建模过程中,要根据实验目的选择最适模型。皮肤及其附件过敏型疾病模型主要分为两大类,一是通过注射变应原引起皮肤过敏反应的相关模型,二是变应原通过直接接触引起的皮肤过敏反应模型。
1.1 被动皮肤过敏反应模型
4-氨基吡啶(4-AP)致敏皮肤瘙痒模型[8]:KM小鼠背部皮下注射1 mL 4-AP(0.2 mg/kg),每隔10 min记录用药部位的舔舐频率,使用舔舐频率来表示小鼠背部皮肤的瘙痒程度。组胺诱导足肿胀模型[8]:KM小鼠右足皮下注射20μg/kg组胺生理盐水(0.25 mg/kg),分别于注射15 min和60 min后用千分尺测定小鼠右足厚度,用注射组胺前后小鼠右足厚度差来表示肿胀度。角叉菜碱诱导小鼠皮下组织炎症反应[9]:将角叉菜碱(每爪300μg)注射到ICR小鼠右后爪的足底表面,使用机械撤退阈值反应皮下组织炎症严重程度。蜱幼虫提取物诱导绵羊耳部皮肤过敏模型[10]:雌性绵羊在蜱虫出没的天然草原牧场放牧,推测其已预先致敏,测量每只绵羊耳朵厚度,并在每只绵羊右耳上侧距耳缘1 cm处皮内注射蜱幼虫提取物制剂0.1 mL。分别在接种后1、6、24、48和72 h用电子卡尺测量母羊个体耳厚。蜱幼虫提取物诱导Nguni牛皮肤超敏反应模型[11]:小牛提前1个月在已知有蜱虫出没的天然牧场上放牧。小牛左耳剃毛区域皮内注射蜱幼虫提取物,测量耳厚度。完全弗氏佐剂诱导大鼠后爪炎模型[12]:雌性SD(Sprague-Dawley)大鼠左后爪皮下注射50μL完全弗氏佐剂。通过爪式热刺激系统测定热敏性,从而判定炎症程度。
上述几种模型造模思路清晰简单,但是通过舔舐频率与耳足厚度来评估过敏反应严重程度只能简单定性,而无法精确定量反应过敏原所引起过敏反应程度,需要更加精确的定量模型。
耳被动皮肤过敏反应模型[8]:KM小鼠双耳皮下注射1∶10抗卵白蛋白血清(OVA)20μL,72 h后尾静脉注射含OVA的伊文思蓝溶液。30 min后颈椎脱位法处死小鼠,剪下耳廓蓝色部分,加入0.75 mL 1 N KOH溶液,37℃过夜消化后加入3.5 mL 0.6 N磷酸溶液和丙酮混合物(按5∶13比例混合),用涡旋机摇床提取,离心,并于640 nm处测定光密度。DNP-人血清白蛋白(DNP-HSA)诱导小鼠耳被动皮肤过敏模型[13]:5周龄雌性BALB/c小鼠,DNP-IgE皮内注射入耳致敏,24 h后,DNP-HAS的0.5%伊文思蓝溶液100μL尾静脉注射激发。30 min后,伊文思蓝染色程度表示小鼠耳部皮肤反应严重程度。甲酰胺63℃隔夜孵育提取伊文思蓝,595 nm处测定吸光度。抑制率=(对照组蓝斑直径-实验组蓝斑直径)/对照组蓝斑直径×100%。弗氏完全佐剂诱导小鼠背部皮肤过敏模型[14-15]:6~8周龄18~22 g雌性BALB/c小鼠,第1天弗氏完全佐剂的生理盐水溶液(50%)100μL小鼠背部皮下注射,第4、7、10天在小鼠背部皮肤上涂抹100μL弗氏完全佐剂的生理盐水溶液(50%)继续致敏,攻击3 d后,所有小鼠CO2安乐死,在无菌环境中采集血液和肾脏进行HE染色、免疫比浊法和ELISA检测血清IL-6含量。小鼠皮肤过敏评分为:0分,完全正常;1分,散发性红斑或轻度红肿;2分,中度红肿或弥漫性红肿;3分,重度红斑或红肿。将≥1评分定义为阳性致敏,计算致敏率。外源性低分子量化合物诱导小鼠超敏反应模型[16-17]:无特异性病原体(SPF)雌性6~8周龄20~22 g BALB/c小鼠,0.5或1 mg绿原酸溶于生理盐水中皮下注射至小鼠右后足,颈椎脱位法处死小鼠,去除处理侧和未处理侧的小鼠腘窝淋巴结(PLN),放置于冰凉的1%BSA的PBS溶液中,切除多余脂肪组织后称重,采用流式细胞仪对每个分离的PLN细胞同时进行三色分析,制备PLN淋巴细胞缓冲液,进行酶联免疫吸附试验(ELISPOT)检测IgM、IgG1、IgG2a以及IgE。
上述四种被动皮肤过敏反应模型区别之处在于选用了不同的变应原刺激小鼠,测定耳部蓝染的伊文思蓝含量,免疫比浊法、ELISA法测定相关因子等都可以定量反映过敏严重程度,是较为精确的一种过敏反应模型,可应用于定量反应药物治疗皮肤过敏性疾病有效率。
1.2 皮肤及其附件接触性过敏反应模型
小鼠耳接触超敏反应模型[18]:6~8周龄BALB/cJ小鼠,手术胶带去除小鼠耳垂绒毛,每隔2 d涂抹1%2,4-二硝基氯苯(DNCB),持续1个月。每次涂抹DNCB 24 h后测量耳厚度。ELISA法进行血清IgE浓度测定,第2周末取小鼠尾静脉血使用ELISA试剂盒测定进行测定,稀释200倍后测定血清IgE浓度。小鼠耳部制成6μm厚度切片,HE染色进行组织学观察,显微镜下观察淋巴细胞浸润以及表皮增厚情况。制备单细胞悬液,分离总引流淋巴结细胞和CD4+T细胞,进行RNA提取及RT-PCR分析。2,4二硝基氟苯(DNFB)诱导局部接触性过敏小鼠模型[19]:6~8周龄雌性野生型C57BL/6小鼠,每只小鼠剃去腹部毛发,使用0.5%2,4-二硝基氟苯(DNFB)溶解于丙酮和橄榄油的混合物处理小鼠腹部皮肤。5 d后用0.2%DNFB每耳10μL刺激小鼠双耳前后部。刺激48 h后用测微仪测量小鼠耳厚,判断小鼠耳部局部接触性过敏反应严重程度,并进行细胞分离和流式细胞术分析树突细胞、T细胞以及巨噬细胞等各类免疫细胞数量在不同阶段的变化情况[20]。氢醌(HQ)接触性超敏反应小鼠模型[21]:将1%或更高浓度氢醌涂抹在小鼠耳廓上,第7天和第14天耳廓涂抹氢醌,可引起浓度依赖性耳肿胀。第二次刺激的接触性超敏反应较第一次明显更为严重,BALB/c小鼠对氢醌的敏感性高于C57BL/6小鼠。偏苯三酸酐(TMA)诱导小鼠接触性皮肤过敏模型[22]:6~8周龄雄性BALB/c小鼠,第0天,50μL 10%TMA剃毛致敏;第5~10天开始,每天用20μL 3%小鼠左耳后部刺激;第5~7天,用数字千分尺测定耳廓肿胀度。通过左耳(过敏原激发)减去右耳(溶剂对照)来计算耳肿胀的净增加。邻苯二甲酸酐(PA)诱导小鼠特应性皮炎[23]:HR-1小鼠,8周龄,将5%PA溶液100μL涂抹于小鼠耳背及背部皮肤,每周3次,持续4周。实验过程中,电子天平每周测量1次小鼠体重。4周后处死小鼠,测定小鼠淋巴结重量,测厚仪测量耳厚,从而评估PA引起的过敏性皮肤炎症的严重程度。取小鼠耳背部皮肤,切片,甲苯胺蓝染色检测肥大细胞脱颗粒情况;ELISA法测定血清IgE浓度、血清TNF-α、IL-6、IL-1β水平。接触型超敏反应评价[24]:SPF雄性6~10周龄BALB/c(H-2)小鼠,腹部胸部剃毛,25μL 0.5%二硝基氯苯(丙酮:橄榄油=4∶1)溶液涂抹,千分尺测量耳朵厚度,刺激24 h后再次测量。增加的耳朵厚度以平均数±标准差(±s)表示。测量耳重、血管通透性实验、耳提取物中干扰素-γ体外测定、髓过氧化物酶(MPO)法间接定量嗜中性粒细胞等方式判定接触性超敏反应发生程度。
上述几种都是变应原直接涂抹于动物皮肤所构建的皮肤接触性过敏反应模型,小鼠耳部皮肤是观察皮肤反应的较为理想的位置,因此诱导皮肤接触性过敏反应多选取小鼠耳部皮肤,通过耳部皮肤的肿胀度或耳厚度来评估过敏反应的强烈程度,但耳肿胀度与耳厚度作为定量指标仍然不够严谨,同时可以通过采集模型动物血液、制备细胞悬液,制备切片等方式进行定量分析以及可视化观察,从而更加准确的评估模型动物反应程度。上述模型详细对比见表1。

表1 皮肤及其附件过敏反应模型对比Table 1 Comparison of allergic reaction models of skin and its accessories
2 呼吸系统过敏性疾病模型
呼吸系统的过敏性疾病主要包括吸入过敏原引起的咳嗽、气道过敏以及哮喘等。柠檬酸诱导豚鼠咳嗽模型[25]:豚鼠暴露于柠檬酸环境下,0.5 mol/L雾化吸入10 min,豚鼠置于允许自由移动的室内,并配备内部麦克风和压力传感器测量咳嗽,用气速仪记录呼吸和咳嗽引起的气流变化,咳嗽声被放大并记录。雪松花粉诱导小鼠鼻内过敏[13]:日本雪松花粉粒(0.5 mg悬浮于20 mL PBS中)鼻腔攻击小鼠7次,每天1次,计数打喷嚏的次数。大鼠气道超敏反应模型[26]:气管内滴注嗜酸性粒细胞颗粒或合成阳离子蛋白溶液0.1 mL,使用全细胞穿孔膜片钳进行电生理记录,测定给予刺激后不同时刻膜电位的变化、动作电位数目、膜电位峰值以及电流变化。烟曲霉菌提取物蛋白诱导小鼠气道炎症模型[27]:RK小鼠,5月龄,采用50 mg烟曲霉菌提取物蛋白加2 mg氢氧化铝稀释的烟曲霉IgE溶于PBS缓冲液中,分别于第0天和第10天皮下注射致敏RK小鼠。随后,小鼠在第18天至第25天暴露于烟曲霉菌孢子污染的环境中,第25天处死小鼠,取支气管肺泡灌洗液(BALF)和肺组织进行组织学分析,建模过程如图1所示。热凝固蛋清(HEW)诱导小鼠晚期反应(LPR)模型[6,28]:6周龄BALB/c小鼠,皮下注射HEW(40 mg),14 d后在足垫内注射50μL热聚卵白蛋白(20 mg/mL),立即出现以足垫肿胀和嗜酸性粒细胞浸润为特征的超敏反应。
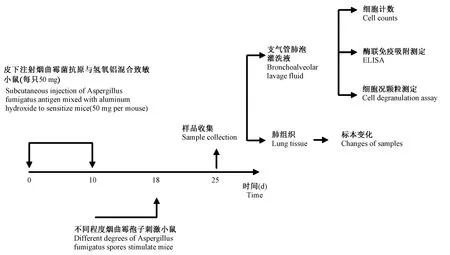
图1 烟曲霉诱导小鼠气道炎症模型建模过程Figure 1 Modeling process of Aspergillus fumigatus-induced airway inflammation model in mice
呼吸系统过敏性疾病模型构建主要通过吸入变应原或直接气管滴注的方式诱导动物发生呼吸系统过敏反应,取BALF和肺组织分析,测定咳嗽次数、气流变化以及电生理指标等多适用于呼吸系统模型,同时也可以通过ELISA法检测血清IgE浓度、各类细胞因子浓度等免疫相关指标,制备切片显微镜下观察,流式细胞仪分析淋巴细胞等定性定量评估模型动物过敏反应严重程度。
3 消化系统过敏性疾病模型
口服药物诱导大鼠胃肠超敏模型[29]:5周龄Brown Norway大鼠,将受试药物混悬液或溶媒(0.5%甲基纤维素溶液)口服28 d,每日给药量阿莫西林(AMX)和磺胺甲噁唑(SMX)为500 mg/kg,D-青霉素胺(D-Pen)和磺胺甲噁唑(SMX)为500 mg/kg、苯妥英钠(PHT)为300或450 mg/kg,每周测量一次体重,每天记录2次动物临床体征,包括任何异常的外表或行为。大鼠安乐死,异氟醚吸入麻醉后腹主动脉采血,ELISA法测量血清IgE浓度,并检测血液中白细胞、中性粒细胞、单核细胞、嗜酸性粒细胞、淋巴细胞和大的未染色的细胞的数量,流式细胞仪对淋巴细胞进行分析;采血后,取脾、肠系膜淋巴结和小肠切片,苏木精伊红(HE)染色镜检。结肠过敏大鼠模型[30]:250~350 g雄性SD大鼠,腹腔注射1 mL溶有10μg卵白蛋白(抗原)和10 mg氢氧化铝(佐剂)的生理盐水溶液。注射后第3天至第5天,使用抗原液以50μL/min进行大鼠结肠灌流30 min,再使用30 mm级汞柱重复刺激大鼠结肠过敏5次,间隔为3 min。抗原液由10μg/mL卵白蛋白、40 mmol/L D-葡萄糖组成,与氯化钠等渗。对三硝基苯磺酸(TNBS)诱导大鼠结肠炎模型[31]:180~200 g成年雄性SD大鼠,2%异氟醚麻醉,将TNBS(100 mg/kg)和50%乙醇(体积比2∶1)经直肠注入远端结肠腔(距肛门近端7 cm)。通过对体重、大便稠度和肠出血评分(0~4分),获得疾病活动指数(DAI)。所有动物在TNBS后第7天和第14天进行评估;为评价TNBS灌服引起的躯体痛觉过敏,于第7天和第14天测定大鼠的机械和热行为实验,使用机械拔爪(PWL)时间和热痛阈值来反应躯体痛觉过敏程度,从而反应内脏超敏程度。对三硝基苯磺酸(TNBS)诱导小鼠结肠炎模型[32]:雄性18~20 g C57BL/6小鼠,麻醉条件下将TNBS(1.75 mg/只,含50%乙醇)经距肛门近端4 cm的细导管一次性注入结肠,诱导小鼠结肠炎模型。经TNBS处理后,小鼠倒立5 min。对小鼠结肠组织进行髓过氧化物酶检测(MPO),并在诱导结肠炎后第7天取结肠组织进行HE染色。内脏超敏反应程度(内脏痛阈)利用腹壁退缩反射(AWR)程度来间接反映:肛门连接球囊扩张器,采用维持球囊扩张所需注气量(0.1~1.0 mL)来反应AWR,即腹部离开平台时突然而持续的腹部肌肉收缩。铝诱导大鼠内脏超敏模型[33]:大鼠口服1.5 mg/kg柠檬酸铝,通过诱发痛觉过敏所需平均压力不同来反应内脏超敏反应严重程度。结直肠扩张(CRD)诱发大鼠内脏超敏模型[34]:断奶前雄性SD大鼠(小于8日龄),与成年雌性大鼠共同饲养至25日龄,体重到达200~250 g时分组,新生CRD模型构建:大鼠出生第8、10、12天使用插入降结肠和直肠上部的血管成形术球囊。球囊在60 mmHg压力下用0.3 mL水膨胀1 min,然后放气退出。间隔30 min,重复扩张两次。假手术组除不施加压力外,处理方式与CRD置入组相似。成年CRD组不进行扩张,8周后,将成年CRD应用于所有大鼠,其中80 mmHg(1 min)扩张2次,间隔5 min。通过腹部戒断反射[35](AWR)评估大鼠膨胀痛阈值。将30日龄大鼠下丘脑组织切片进行免疫荧光标记。将下丘脑室旁核和垂体在50 mmol/L盐酸缓冲液(pH=7.4)中匀浆,采取ELISA法测定促炎因子水平。
消化系统过敏性疾病造模主要通过腹腔注射、结肠灌流等方式诱导,由于消化系统器官的特点,无法直接观察其过敏反应程度,需要一些间接的指标来反映,上述几种消化系统过敏性疾病模型中,可间接通过对内脏发生过敏反应后所产生痛觉的评估(如:机械拔爪时间、热痛阈值和腹壁退缩反射等)或者疾病活动指数,但这些间接指标仍无法精确定量,定量检测仍需ELISA法检测血清IgE浓度[36]、各类细胞因子浓度等免疫相关指标,流式细胞仪分析淋巴细胞等途径评估模型动物过敏反应严重程度,随着动物成像技术的进步和设备的应用,可以探索将成像技术用于消化系统病变的直接观察。
4 神经系统过敏疾病模型
脂多糖(LPS)诱导小鼠疼痛过敏、脊髓炎症模型[37]:5日龄SD大鼠幼鼠腹腔注射LPS(2 mg/kg),注射LPS 5 min后,注射总体积为0.1 mL含0.1%牛血清白蛋白(BSA)的无菌生理盐水溶液。注射后24 h测量体重并测试记录行为。每组16只幼鼠,断头处死8只,采集新鲜腰髓组织,剩余8只经心脏灌注生理盐水,制备脊髓切片进行免疫组化染色。采用冯弗雷纤维丝试验[38-39](von fery filament test)评估大鼠机械性痛觉。摇尾实验测定尾闪潜伏期平均值,评估大鼠热伤害阈值。采用ELISA法检测大鼠脊髓中IL-1β、IL-6、TNF-α、COX-2、CORT和PGE浓度,并将上述指标作为炎症反应标记物。辣椒素诱导小鼠机械过敏模型[40]:雄性CD-1小鼠,6~8周龄,右后掌足底中部注射辣椒素增敏,注射15 min后测定机械刺激的戒断潜伏期。同样采用冯弗雷纤维丝试验评估小鼠机械性痛觉。芬太尼诱导大鼠超敏模型[41]:雄性SD大鼠,50~100 g,芬太尼(60 mg/kg)每隔15 min皮下注射,共注射4次,总剂量为240 mg/kg(为模拟人类手术中使用的大剂量阿片类药物治疗)。分别于给药后第0、1、5、6、6.5、7、8 h,以及给药后第1、2、3、4、5天测定机械刺激和热刺激的伤害性阈值。机械敏感性评估采用冯弗雷纤维丝试验;采用Hargreavs法[42]评估热敏感性,即测量引起足底缩足所需的潜伏期(以s为单位)。咖啡因诱导大鼠肾上腺素(HPA)轴超敏模型[43]:无特定病原体(SPF)Wistar大鼠(8周龄雌性200~240 g,10周龄雄性260~300 g),实验条件下适应一周,大鼠从妊娠第0天(GD)至出生后12周(PW)的处理如图2所示。两只雌性大鼠与一只雄性大鼠过夜,观察到交配证据(即阴道栓或精细胞阴道图片)的日期定位妊娠第0天(GD 0),从GD 9~GD 20对孕鼠进行灌胃咖啡因给药120 mg/(kg·d)[44];16只孕鼠在GD 20异氟醚麻醉下安乐死,取出胎盘组织,称量胎儿体重,断头处死胎鼠,取血离心备用,在解剖学范围内解剖并收集胎鼠脑组织(每性别4例)进行免疫荧光分析;其余孕鼠正常分娩,标准化幼仔数量为8只,出生后第1周(PW 1)称重,评估幼鼠是否存在慢性应激;对照组和模型组进行冰水游泳试验,取脑组织进行免疫组织化学和免疫荧光分析,血样进行血清ACTH和皮质酮(CORT)检测,从而评估咖啡因对HPA轴活性产生的影响作用。白藜芦醇(RTX)诱导神经源性炎症导致小鼠足水肿模型[45]:8周龄雄性ICR小鼠,腹腔注射RTX溶液,1小时后测量后爪厚度;为消除测量偏差,每隔5 min测量双侧后爪3次,后爪厚度用6个测量值的平均值表示。部分坐骨神经结扎(PSNL)诱导小鼠机械超敏模型[46]:雄性DDY小鼠,25-35 g,腹腔麻醉注射0.4 mg/kg美地托咪啶、2.0 mg/kg咪达唑仑和5.0 mg/kg布托啡诺。根据Stelzer法[47],暴露左侧坐骨神经,并用外壳缝线紧密结扎。同样采用冯弗雷纤维丝试验[36]评估大鼠机械性痛觉。结果的反应评分为0~3分(0:无反应,1:后足抬起,2:后爪快速拔除。3:后爪摇动和舔)。每次试验间隔至少5~7 s的七项试验总评分记录为疼痛评分[48];取出脑组织,进行免疫组化可视化切片进行观察。

图2 大鼠从妊娠第0天(GD 0)至出生后12周(PW 12)的处理过程Figure 2 Treatment process of rats from the 0th day of pregnancy(GD 0)to 12 weeks after birth(PW 12)
上述神经系统过敏性疾病模型通过外源性药物、内毒素或手术进行诱导,评估过敏反应程度多采用痛觉指标,通过冯弗雷纤维丝试验评估机械刺激伤害阈值,通过Hargreavs法评估热刺激伤害阈值。由于神经系统的特殊性,想要通过模型定量精确评估过敏反应仍然存在一定的难度,动物模型与临床疾病的对应性也需要科研工作者们继续探索确证。
5 基因工程动物来源过敏性疾病模型
Il-36r拮抗剂缺陷型(IL-36R antagonistdeficient,Il-36rn-/-)银屑病小鼠模型[49]:使用含咪喹莫特(IMQ)的乳膏局部涂抹Il-36r拮抗剂缺陷型(Il-36rn-/-)和Il-36r基因缺陷型(IL-36R-deficient,Il-36r-/-)小鼠耳部皮肤,两种小鼠进行对比;观察小鼠耳肿胀、棘皮病、红斑、皮肤剥落和角化过度;采用流式细胞术对炎性耳浸润进行定性与定量分析。基因敲除肥大细胞缺陷型小鼠模型[50]:6~8周龄C57BL/6背景的G蛋白偶联受体X2(MRGPRB2)基因敲除(MUT)小鼠,腹腔注射70 mg/kg戊巴比妥钠,实验前静脉注射50μL伊文思蓝染液(12.5%生理盐水,w/v),用游标卡尺测量足爪厚度,使用丙酮生理盐水提取伊文思蓝染料,于620 nm处测定OD值。体温试验:采用野生型(WT)或Mrgprb2基因敲除(MUT)6~8周龄小鼠,用生物功能实验系统记录小鼠体温,并将探针插入小鼠肛门,得到直肠温度,3 min测量1次,共持续30 min。血管活性肠肽(VIP)基因缺乏小鼠后足超敏模型[51]:成年C57BL/6Vip-/-小鼠,Vip+/+作为对照,小鼠接受不同的神经损伤:备用神经损伤(SNI)、正中神经损伤(MNI),采用冯弗雷纤维丝试验评估小鼠机械伤害阈值,并进行后足触觉刺激;取脊髓进行促炎因子表达及淋巴细胞分析。不同基因缺陷小鼠脂质过氧化过敏模型[52]:野生型(WT)、Xpa-/-、Ercc1-xpf内切酶复合物基因(Ercc)亚纯突变体(Ercc-/Δ,表达正常补体Ercc1-xpf的5%,但Ercc-/-小鼠寿命仅4周,而Ercc-/Δ小鼠寿命为7个月[53-57],小鼠皮下注射0.5 mL/kg CCL4,制成1∶1橄榄油悬浮液,每周2次,共5周;当小鼠被判定为晚期或自发活动减少时,处死、分离组织进行组织学分析,评估受试小鼠肝中脂质过氧化水平,对小鼠肝、肾和胰腺切片并进行评分。2,4,6-三硝基氯苯(TNCB)诱导EomesGfp/tx Rorc(gt)-CreTgx Rosa26RYfp/t小鼠接触性皮炎[58]:测定不同时间点耳肿胀反应、皮肤天然淋巴样细胞(固有淋巴样细胞,ILCs)数和细胞因子的产生;半抗原刺激小鼠诱导皮肤和耳部引流淋巴结中自然杀伤细胞的早期增加,分别与不同时间点耳部肿胀反应的峰值相对应。两条曲线对比从而反映小鼠过敏反应过程中ILCs、细胞因子不同时刻的变化规律。
基因工程动物模型较之传统动物模型目的性与针对性更强,但仍然不能完全模仿人类过敏性疾病的病理生理过程,相较于人类,基因工程动物模型不具有免疫细胞和因子的系统性改变,疾病的靶基因也不一定具有特异性,只有不断期待基因工程技术的进步,争取早日构建出更加贴合人类过敏特性的基因工程动物模型[59]。
6 体外模型
大鼠嗜碱性白血病细胞系(RBL-2H3细胞)模型[13]:10%胎牛血清培养基培养细胞,使用1.0 ng/mL抗二硝基苯酚(DNP)敏化RBL-2H3细胞,培养8 h,PBS去除未结合IgE,1.25 ng/μL DNP-BSA Tyrode’s缓冲液(MT缓冲液)加入细胞培养孔,孵育30 min,细胞经4℃冷冻10 min,离心收集上清液。裂解细胞使细胞释放组胺,使用组胺EIISA试剂盒检测组胺含量,Wallac 1420 ARVOsx多标签计数器测定RBL-2H3细胞脱颗粒后Ca2+内流情况,在DNP-BSA刺激下,每隔1 min测定1次,共10 min。C48/80诱导小鼠肿瘤细胞肥大细胞株(P815肥大细胞)脱颗粒模型[60]:10%胎牛血清培养基培养细胞48 h,Tyrode’s缓冲液冲洗3次,平衡10 min。以50μL C48/80(10μg/mL)进行刺激,45 min后离心收集上清液和细胞,测定生物活性介质。采用组胺ELISA试剂盒测定并分析上清液中组胺水平。测定β-氨基糖苷酶浓度、染色测定细胞脱颗粒率。氟喹诺酮类药物诱导人肥大细胞系2(LAD 2)超敏模型[50]:10%胎牛血清培养基培养细胞,以 每毫升2×106个细胞密度进行细胞培养,并使用氟喹诺酮类药物孵育建立LAD 2细胞超敏模型,进行细胞内钙动员实验、β-己糖苷酶释放实验、组胺释放实验、小干扰RNA(siRNA)转染实验,从而判定LAD2细胞模型超敏反应程度。LPS刺激小鼠巨噬细胞株RAW 264.7模型[18]:使用添加10%胎牛血清改良和100 U/mL青霉素100μg/mL链霉素的10%胎牛血清Eagle’s培养基培养细胞适应一段时间后,1 μg/mL LPS刺激8 h进行分析。采用台盼蓝染色法进行细胞毒性试验,通过流式细胞术分析细胞内TNF-α水平。半抗原特异性LN细胞模型[61-62]:加入0.5 mmol/L DNBS后培养LN细胞72 h,收集上清液进行ELISA检测,采用流式细胞术分析细胞内IL-36α表达水平。烟曲霉菌可溶性蛋白诱导肥大细胞脱颗粒模型[27]:3月龄SD大鼠,使用肝素化Hank’s平衡盐溶液10 mL腹腔灌洗获得新鲜肥大细胞,混合洗涤两次,并在含10%胎牛血清的RPIM-1640培养基中以所需浓度悬浮,加入烟曲霉菌可溶性蛋白孵育15 min,固定细胞后使用0.1%甲苯胺蓝染色测定肥大细胞脱颗粒百分率[63-64]。
过敏反应研究体外细胞模型大多使用肥大细胞模型,也有巨噬细胞、RBL-2H3细胞株等其他细胞模型,肥大细胞脱颗粒模型是一种能较为直观反映细胞过敏程度的一种方法,P815细胞相较于RBL-2H3细胞适合作为一种早期、稳定、敏感的肥大细胞脱颗粒体外检测模型[59]。
总体来讲,体外细胞模型的构建思路主要为选择适宜的细胞株进行适应性培养后加入致敏原进行孵育,进而再通过染色,流式细胞术分析等检测手段分析模型细胞相关检测指标,从而反映该模型过敏程度和过敏机制。
研究中常用的过敏性疾病体内外模型需要满足以下几点:①模型构建尽可能贴合人类过敏性疾病发生发展病理生理过程。②满足研究所需的定性定量要求。③能够确定反应过敏性疾病的相关免疫指标,并能够找到一定的方法精确、经济的测量。④符合动物伦理、福利要求并进行评估。本文通过汇总、分析常用过敏性疾病研究模型,通过分析各类模型的异同与优劣之处,希望为研究者选择合适的过敏性疾病模型或者进行改进提供参考和启发。
