食管癌小鼠模型研究进展
2021-08-21宋韶鹤苗晋鑫张春敭苗明三
宋韶鹤,苗晋鑫,王 峥,张春敭,苗明三
(1.河南中医药大学第一附属医院,郑州 450000;2.河南中医药大学,郑州 450046;3.郑州大学第一附属医院,郑州 450052)
食管癌(esophageal cancer,EC)是消化道常见的恶性肿瘤之一,其发病率和死亡率分别居全球恶性肿瘤的第8位和第6位,且逐年上升和趋于年轻化[1]。我国是食管癌高发地区,食管癌发病率和死亡率均居世界首位,且新发病例占据世界新发食管癌病例一半以上[2]。食管癌主要有两种病理组织类型,食管腺癌(esophageal adeno-carcinoma,EAC)和食管鳞状细胞癌(esophageal squamous cell carcinaoma,ESCC)[3],我国食管癌类型主要是食管鳞癌[4]。尽管现代治疗技术取得了新的进展,但是食管癌预后仍然很差,5年生存率不足20%[5-6]。现今,中药防治肿瘤受到更多关注,临床研究显示中药能显著提高食管癌患者免疫能力、逆转化疗药物的耐药性以及改善预后[7-8]。但是,中药防治食管癌的分子机制尚不完全清楚。因此,了解这些机制对中药改善食管癌患者的预后至关重要。食管癌小鼠模型是研究EC发生、发展、转移和治疗肿瘤策略进行临床前测试重要的实验工具。本文回顾了目前常用的EC小鼠模型,包括化学诱导性食管癌模型、移植性食管癌模型、基因工程小鼠模型。对每种EC小鼠模型的制备方法、模型特点及使用范围进行阐述和比较,为食管癌小鼠模型的发展和中医药防治食管癌的研究提供科学依据。
1 诱发性食管癌小鼠模型
诱发性食管癌小鼠模型多为致癌因素与动物的食管直接或间接接触,使食管发生癌变,形成食管癌动物模型。化学法是诱发动物食管癌常用的方法之一,通过化学致癌物使小鼠致癌,建立化学诱导小鼠食管癌模型。化学致癌物的剂量、给药方案、小鼠品系和年龄等诸多因素影响化学致癌物诱发肿瘤发生率。亚硝胺类致癌物是食管癌诱发模型的诱癌剂,但是相关法律规定亚硝胺类化学物不在用于动物实验。本文重点介绍,4-硝基喹啉-N-氧化物(4-NQO)诱发小鼠食管癌以及致癌物结合转基因小鼠模型研究食管癌。
4-NQO是一种水溶性的喹啉衍生物,在体内4-NQO主要在还原酶的作用下引起DNA单链断裂、碱基缺失和氧化碱基等DNA的损伤而产生癌变。由于食管分布较多的4-NQO还原酶,所以食管是4-NQO作用的主要靶器官之一。Tang等[9]首先用100μg/mL的4-NQO放入水中,使C57BL/6或CBA小鼠自由饮水16周,然后用正常水继续喂养12周,28周病理组织观察所有的小鼠食管出现扁平的鳞状异型增生,外生性乳头鳞状肿瘤和浸润性鳞状细胞癌等食管鳞癌特征。杜展等[10]用同样的方法建立食管癌模型,利用食管拉网的方法检测12周的小鼠食管,病理组织学发现食管上皮不典型增生,且分别在第16、20和24周观察到浸润性食管鳞癌的发生。研究人员利用复方化浊润燥降气方能有效减轻4-NQO诱导的小鼠食管癌前病变模型的病理损害程度,确定复方化浊润燥降气方能够预防和治疗小鼠食管癌前病变[11]。Zheng等[12]在饮水中用18μg/mL 4-NQO处理雌雄各8只129J/C57B6/L小鼠8周,然后换成常规饮用水处理10周,结果在第18周结束时,小鼠食管既有腺癌又有鳞状细胞癌两种类型,且雄性小鼠对ESCC的肿瘤发生更敏感。吕翠田等[13]利用六君子汤对4-NQO诱导的食管癌小鼠干预,六君子汤组小鼠活动较正常,体重下降不明显;与模型组相比,六君子汤组显著提高CD4+/CD8+T细胞比例,提高IL-10等细胞因子水平提升机体免疫功能,纠正CD4+/CD8+T细胞比例改善免疫功能失衡及免疫抑制。
许多基因工程小鼠对4-NQO诱导的食管癌变表现出更高的敏感性。王立群等[14]利用4-NQO诱导SLC39A5基因敲除的C57BL/6小鼠和野生C57BL/6小鼠食管癌模型的成瘤情况,SLC39A5基因敲除小鼠诱导成瘤率低于野生小鼠,确定SLC39A5基因对食管癌发生有影响。另外,miR-31过表达转基因小鼠模型和Cyclin D1过表达转基因小鼠,Nrf2基因敲除小鼠模型和p53突变小鼠模型结合4-NQO饮水诱导更易于诱发食管鳞状细胞癌[15]。以上研究提示,诱发性食管癌模型制备方法稳定,致癌部位集中在上消化道,成模率高,模拟了食管癌动态发展过程,有助于食管癌变机制与形态学的研究。但是化学诱导的食管癌病变演变迅速和成瘤部位难确定,需要控制造模时间。
2 移植性食管癌小鼠模型
移植性食管癌小鼠模型是将食管癌组织或细胞系接种于小鼠体内形成食管癌动物模型。根据不同的移植部位,分为异位移植(皮下或腹腔)与原位移植(食管)[16-17];根据不同的移植肿瘤处理方式,分为细胞移植和组织块移植。同种移植(动物之间)模型在食管癌中研究很少,我们不做阐述。异种移植(人与动物之间)食管癌小鼠模型是目前应用最多的食管癌动物模型,主要将人食管癌细胞或人食管癌组织接种于免疫缺陷小鼠而建立的模型。本文主要介绍皮下异种移植瘤模型与原位异种移植瘤模型。
2.1 皮下异种移植瘤模型
皮下异种移植瘤是指将人的食管癌细胞系或患者食管癌组织接种于免疫缺陷小鼠的皮下,使免疫缺陷小鼠皮下形成肿瘤。多种人食管鳞癌细胞株KYSE-270、KYSE-70、KYSE-30以及食管腺癌细胞株OACM5.1和SK-GT-4等用于皮下细胞系异种移植(cell-line-derived xenograft,CDX)模型的建立[18]。彭海燕等[19]将食管鳞癌Eca109细胞接种裸鼠皮下,建立食管鳞癌移植瘤模型,体内评价槲寄生碱抑制食管癌移植瘤生长和延长荷瘤小鼠的生存期。利用Eca109建立裸鼠皮下异种移植瘤模型评价启膈化痰合剂对顺铂治疗小鼠有增效作用[20]。Crescenzi等[21]将1×106食管鳞癌Kyse-30细胞皮下接种重度联合免疫缺陷(SCID)小鼠双背外侧,成功建立了ESCC皮下移植瘤模型。Ma等[22]利用食管Eca109细胞皮下异种移植裸鼠建立食管癌小鼠模型,通过体内模型阐明双氢青蒿素(青蒿素衍生物)可能通过细胞阻滞诱导自噬。柏文等[23]利用绿色荧光蛋白(GFP)和荧光素酶(Luc)双标记ECA109细胞建立光学EC肿瘤模型,动态观察ECA109食管癌细胞在裸鼠皮下生长过程。虽然远处转移是EC的常见现象,但是极少有研究报道食管癌皮下异种移植模型发生远端转移。Liu等[24]比较了8种食管癌细胞分别接种4种不同类型的免疫缺陷小鼠,发现5×106的食管腺癌FLO-1细胞皮下接种12只NOD-SCID IL-2RγKO(NSG)小鼠和5只NOD-SCID小鼠均能皮下成瘤,但只有11只NSG小鼠发生了肝转移。细胞系移植皮下肿瘤生长速度快且可以直接评估肿瘤的生长,但是细胞系缺乏肿瘤异质性,无法反应有限数量细胞引起的人类肿瘤发展等局限性。
由于皮下CDX移植模型的局限性,研究人员开发患者来源的异种移植(patient-derived tumor xenograft,PDX)模型用于肿瘤的研究。Zou等[25]利用EC患者手术切除的新鲜食管鳞癌组织皮下植于SCID小鼠,成功建立ESCC PDX移植小鼠模型,结果发现ESCC PDX在组织病理学特征和化学敏感性与原发性肿瘤高度吻合。PDX保留了人类肿瘤的原始结构和基质成分,并保留了人肿瘤的异质性,产生PDX的原始组织可以在体内连续扩增等优势。但是较长的模型建立时间和需要免疫缺陷宿主限制了该动物模型的扩大应用。
2.2 原位异种移植瘤模型
皮下移植瘤模型不是自然形成的肿瘤,难以模拟人类食管癌原位生长的情况以及远处转移的特征,与皮下模型相比,原位移植模型是研究EC更好的选择。原位移植是在食管接种人的食管癌细胞或组织,数周后肿瘤形成并发生肿瘤侵袭及远处器官转移。Gros等[26]利用质粒转染方法获得GFP稳定表达的人食管腺癌PT1590细胞,将PT1590-GFP细胞皮下注射裸鼠,肿瘤发生后无菌切除、破碎,通过手术将1 mm3的肿瘤块植入小鼠腹部食管胞浆,建立模拟EAC患者原发肿瘤生长以及肝、肺和淋巴结转移模型。另有研究利用荧光素酶标记人食管鳞癌TE8细胞,2×106细胞注射裸鼠腹段食管,利用小动物活体成像发现3周开始出现食管肿瘤,表明成功建立了ESCC原位移植模型[27]。有报道利用生物发光成像技术建立ESCC原位移植模型,用于评价药物作用[28]。原位移植模型模拟了患者食管癌发生的局部和转移特征,且能够短期内检测药物的疗效及治疗策略。但是由于解剖部位特殊和移植手术的复杂,此模型应用受到限制。另外,由于是免疫缺陷小鼠,无法研究肿瘤与宿主相关因素。
3 基因工程食管癌小鼠模型
诱发性食管癌小鼠模型是研究环境因素的必要动物模型,而肿瘤的发生和发展还受体内多基因的变化和多因素的累积等综合影响。因此,需要基因工程小鼠模型的建立,该模型加强了对癌症生物学的理解,可用于明确基因功能以及鉴别新的癌症基因和肿瘤生物标志物在食管癌的作用,提高对食管癌发病机制的认识[29]。基因编辑技术可构建基因敲入和敲除以及条件/诱导动物模型[30-31]。本文主要阐述转基因食管癌小鼠模型和基因敲除食管癌小鼠模型(表1)。

表1 化学诱导和基因工程改造的食管癌小鼠模型Table 1 Comparison of mouse models of esophageal cancer
3.1 转基因食管癌小鼠模型
不同组织和细胞的特异性启动子已被用于研究食管功能。疱疹病毒(EBV)的ED-L2启动子在上皮细胞中表达,尤其在食管的基底层的分化细胞中更具活性。E D-L2在转基因小鼠模型中靶向细胞周期蛋白D1(CyclinD1),导致食管鳞状细胞发育不良和食管的癌前病变[35]。此小鼠模型具有严重的不典型增生特点,其核细胞质比例异常,导致口腔和食道发育异常,这是癌症的重要前兆。与p53基因缺失的小鼠杂交的ED-L2/Cyclin D1小鼠发生食管鳞癌,其中约三分之一的小鼠发现淋巴结转移[32]。Tetreault等[33]采用ED-L2启动子在小鼠食管上皮细胞中过表达Krüppel样因子4(Klf4)转录调节因子,建立转基因食管癌小鼠模型。该小鼠模型出现食管鳞状上皮不典型增生和鳞状细胞癌。除了转基因ESCC小鼠模型,研究人员还开发了转基因EAC小鼠模型。Quante等[34]构建ED-L2启动子驱动的细胞因子1β(IL-1β)在食管过表达的转基因小鼠,发现IL-1β过表达的小鼠在6个月时出现中度炎症,在12~15个月时出现巴雷特化生,到20~22个月时,小鼠会发展为高度不典型增生或食管腺癌。这些转基因小鼠模型可以准确地概括人类肿瘤中发现的遗传改变,并研究相关基因与食管癌发生的相互作用。
3.2 基因敲除食管癌小鼠模型
Stairs等[35]使用ED-L2启动子和条件性敲除p120-catenin基因的小鼠,在9~12个月时会导致食管、前胃和口腔发生不典型增生和浸润性鳞状细胞癌的形成。最早在L2Cre;p120ctnloxP/loxP小鼠4月龄时,即可发生食管癌浸润。p120-catenin基因敲除小鼠模型概括了人类的ESCC特征,同时验证了p120-catenin的抑癌作用。研究提示,该模型为食管和口腔鳞状细胞癌早期诊断与治疗策略提供新的动物模型。
4 其他
食管癌转移动物模型报道数量有限。静脉内注射癌细胞是通常用于癌细胞进入远端器官的造模方法。Wang等[36]通过小鼠尾静脉注射1×106食管鳞癌KYSE150细胞建立食管癌肺转移小鼠模型,发现注射肿瘤细胞35 d后出现肺转移。在肺转移模型中,云南藤黄提取的天然化合物oblongifolin C能有效抑制肺转移[36]。另一项研究将5×106YES-2食管鳞癌细胞腹腔注射SCID小鼠,导致食管鳞癌细胞在腹膜腔中定植并产生血性腹水,建立腹膜转移小鼠模型[37]。该模型用于评价三萜类化合物和抗癌药物的组合治疗效果,结果表明三萜类化合物增强5-氟尿嘧啶对食管癌的化疗作用。这些模型虽然不能模拟发生在患者上的完整转移过程和可能掩盖对转移生物学的理解,但是可用于评价抗转移中药及其化学成分的验证。
5 结论与展望
中医药对改善食管癌患者生存质量,提高生存预后有较好的作用。食管癌小鼠模型对中医理论的实践和中药抗食管癌的评价至关重要。比较分析食管癌小鼠模型特征发现(表2),诱发性食管癌小鼠模型能很好模拟人类食管癌发生和发展病理过程,是良好的食管癌及其癌前病变的诱发性食管癌模型,用于研究特定化学物对食管的致癌作用及多种中医药(化浊润燥降气方、六君子汤)抗食管癌及癌前病变的研究[13,38];移植性食管癌小鼠模型较好模拟食管癌的主要临床特征,可用于研究食管癌生长和转移研究以及为食管癌开发新的疗法,为临床实践做出贡献;基因工程食管癌小鼠模型可用于研究特定基因功能对食管癌的影响,以及食管癌发生的细胞与分子机制,有助于了解肿瘤生物学特性。移植性小鼠模型是肿瘤研究、开发和评价中医药抗肿瘤应用最多的动物模型[39-42]。皮下移植模型易操作、成瘤快和成功率高,但较少的转移限制其应用;原位移植模型模拟食管癌体内发生发展及转移的过程,符合食管癌临床实际。以上常见的食管癌小鼠模型各具特色,应根据实验目的选择合适的小鼠模型。最大化的发挥食管癌小鼠模型的潜力,多种模型相结合,更好地了解食管癌发病机理及中药防治抗肿瘤的分子机制。随着对食管癌研究的不断深入和技术的进步,食管癌小鼠模型能更好的模拟人类患者食管癌,探索食管癌发病及中药治疗机制。为食管癌小鼠模型的开发及抗食管癌中药的评价提供理论基础和科学依据。
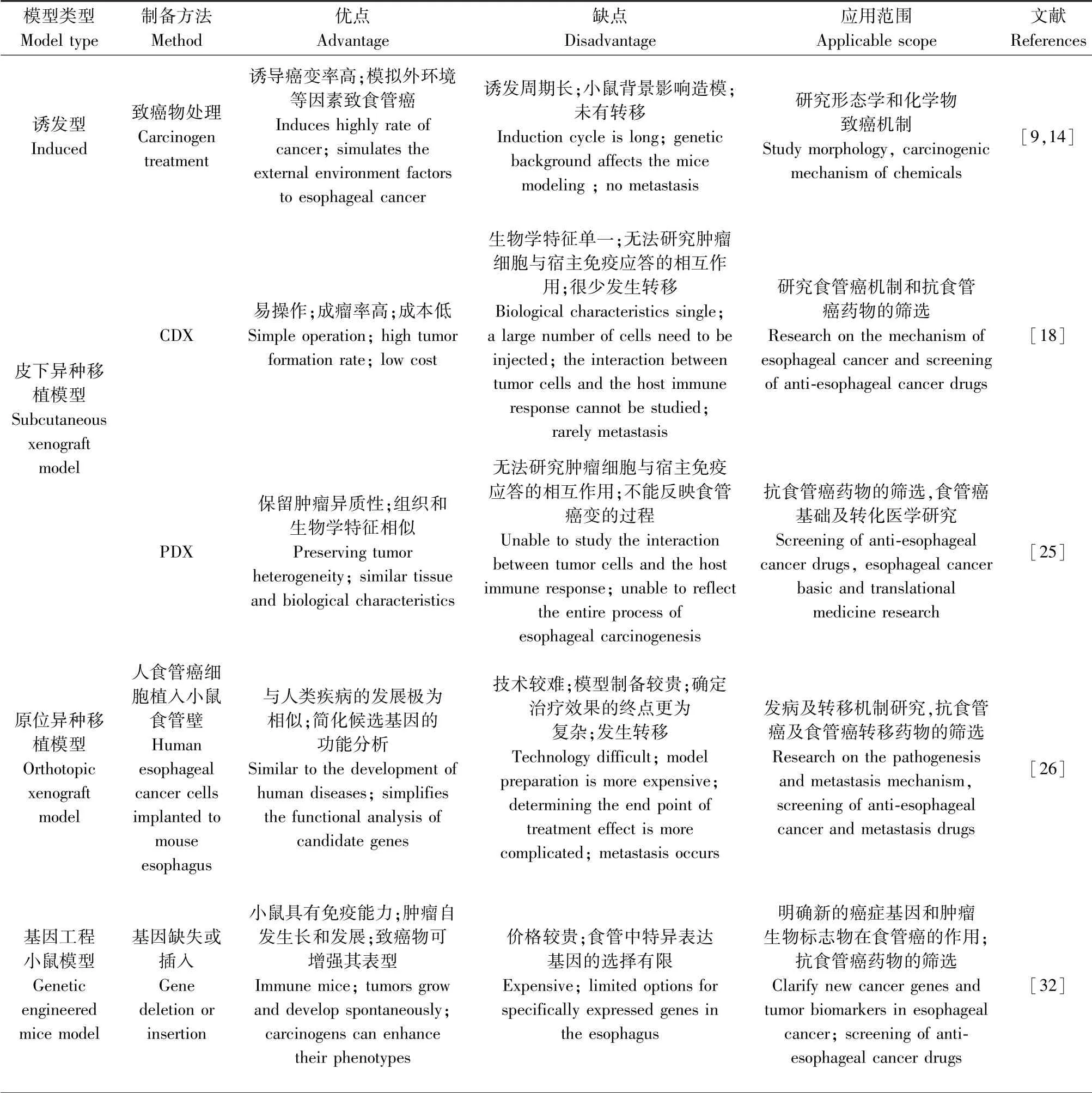
表2 食管癌小鼠模型Table 2 Mouse models of esophageal cancer
