转录激活因子4过表达在内质网过度应激所致骨质疏松中的意义
2021-08-21李少华张铁山邢克炎何新庄李玉伟
李少华,张铁山,邢克炎,何新庄,李玉伟
1.永煤集团总医院骨科,商丘 476600
2.漯河市中心医院骨科,漯河 462000
骨质疏松症是一种以骨量减少、骨微结构退化和骨脆性增加为特点的骨代谢疾病[1-2]。正常的骨代谢是一种由成骨细胞产生新骨组织和破骨细胞吸收旧骨组织构成的动态平衡[3]。成骨细胞的分化涉及多种转录因子,如Runt相关转录因子2(Runx2)、成骨相关转录因子(Osx)、骨钙素(Ocn)和转录激活因子4(ATF4)等。有研究[4]显示,ATF4基因敲除小鼠失去形成成熟骨架的能力。在成骨细胞中,ATF4通过与ATF3结合,促进下游C/EBP 同源蛋白(CHOP)的表达,从而影响骨形成[5]。CHOP是骨骼发育的必需因子,有研究[6]发现其可与骨形态发生蛋白(BMP)相互作用,但CHOP的过表达会使骨组织受损。
内质网应激(ERS)是细胞内的一种重要防御机制[7],主要通过未折叠蛋白反应(UPR)发挥作用,而UPR主要的经典通路包括双链RNA依赖的蛋白激酶样内质网激酶(PERK)/ATF6/肌醇需求酶1(IRE1)[8]。在骨代谢过程中,内质网对细胞内稳态的维持至关重要[9-10]。既往研究[11-13]证明,ERS与骨质疏松症密切相关,但ERS过度导致骨质疏松的分子机制仍不清楚。本研究通过ERS通路激动剂衣霉素(TM)模型和ATF4过表达模型,研究ATF4在ERS导致骨质疏松中的调控作用,为临床防止ERS过度导致骨质疏松提供依据。
1 材料与方法
1.1 动物和试剂
雌雄2对ATF4过表达杂合子C57BL/6J小鼠由美国Jackson实验室提供(货号:013072)。小鼠进行扩增繁殖后,通过鼠尾裂解法在新生小鼠中筛选出ATF过表达纯合子小鼠和野生型小鼠,待小鼠生长至12周龄即可进行下一步实验。戊巴比妥(生工生物工程股份有限公司,上海);TM(Selleck生物科技有限公司,美国);4%多聚甲醛溶液(碧云天生物技术有限公司,上海);TRIzol试剂盒(Invitrogen公司,美国)、反转录试剂盒(Thermo Fisher Scientific公司,美国);PCR试剂盒(宝生物工程有限公司,大连);RIPA裂解液和聚偏二氟乙烯(PVDF)膜(碧云天生物技术有限公司,上海);BCA试剂(Thermo Fisher Scientific公司,美国);Runx2、Osx、Ocn、ATF4、CHOP和GAPDH抗体(Santa Cruz公司,美国);二抗(赛信通生物试剂有限公司,上海 );SDS-PAGE试剂(Thermo Fisher Scientific公司,美国);超敏型ECL发光液(四正柏生物科技有限公司,北京)。
1.2 动物分组与模型建立
实验小鼠分为4组,每组10只。对照野生组:野生型小鼠鼠尾静脉注射生理盐水0.2 μL。TM野生组:野生型小鼠鼠尾静脉注射0.2 μL ERS通路激动剂TM(1 mg/kg)。ATF4过表达纯合子组(ATF4+/+组):ATF4过表达纯合子小鼠鼠尾静脉注射生理盐水0.2 μL。TM干预ATF4过表达纯合子组(TM ATF4+/+组):ATF4过表达纯合子小鼠鼠尾静脉注射0.2 μL TM(1 mg/kg)。干预周期为6周。
1.3 影像学分析
干预6周后,采用2%戊巴比妥钠将各组小鼠麻醉后,迅速剥离小鼠左股骨,用4%多聚甲醛溶液固定24 h后,换取新4%多聚甲醛溶液。将固定的股骨擦干,使用小动物显微影像系统(microCT,Hiscan XM)进行检测。扫描条件:60 kV,133 μA,单次曝光时间1.2 s,扫描分辨率9 μm,扫描角度间隔0.5°,扫描360°。待扫描成功后,拷贝文件,采用重建软件Hiscan Reconstruct software和分析软件Hiscan Analyzer software进行分析。分析小鼠股骨骨密度(BMD)、骨小梁骨体积分数(Tb.BV/TV)、骨小梁数量(Tb.N)和骨小梁间隔(Tb.Sp)。
1.4 苏木精-伊红(HE)染色
所有小鼠的左股骨microCT扫描完成后,放入4%多聚甲醛中继续固定24 h。用14% EDTA溶液脱钙14 d,常规脱蜡、包埋、石蜡切片,切片厚度为3~4 μm。用苏木精溶液染色1 min,流水冲洗5 min;0.5%伊红染色3 min,流水冲洗;梯度乙醇脱水,二甲苯透明,中性树胶封片。使用Image J软件计算骨小梁相对面积。
1.5 成骨相关蛋白和CHOP的表达检测
将小鼠的右股骨迅速剥离后,放入EP管中,于-20℃保存。分别取各组5只小鼠的右股骨用液氮碾磨至粉末后,使用RIPA缓冲液提取骨组织中总蛋白。利用BCA试剂检测蛋白质总浓度后将其变性,保存于-20℃冰箱,以备蛋白质印迹检测。取出骨组织总蛋白,采用SDS-PAGE分离蛋白条带,再转移至PVDF膜。PVDF膜用5%脱脂牛奶封闭1 ~ 2 h后,再用TBST洗涤3次,每次10 min。然后将膜放入以1∶1 000稀释的一抗(Runx2、Osx、Ocn、ATF4、CHOP和GAPDH抗体)中,4℃ 孵育10 h以上。再用TBST洗涤3次后,加入以1∶4 000稀释的相应二抗中,室温孵育2 h。TBST 洗涤3次,每次10 min。将超敏ECL发光液滴在膜上,立即放入化学发光成像仪(Invitorgen公司,美国)进行化学发光。通过Image J软件分析结果,以GAPDH标准化目的蛋白为相对表达量。
1.6 成骨相关基因和CHOP的表达检测
取各组剩余的5只小鼠右股骨用液氮碾磨至粉末后,使用TRIzol试剂提取细胞的总RNA。用分光光度计检测RNA的纯度和浓度后,将其逆转录合成cDNA。随后在ABI 7500实时PCR系统(ABI公司,美国)上进行实时荧光定量PCR检测。引物序列:Runx2正 链 引 物5'-GTACTAGCTTAACGTA-3',反链引物5'-GATCAGGTAACAATCA-3';Osx正链引物5'-AGTCACCGTACCCATG-3',反链引物5'-GTAACGTACGTAAAGTCC-3';Ocn正链引物5'-GCTAGGTCAAGTCAATCAA-3',反 链 引 物5'- GTAACGTAACCCGTAT-3';ATF4正链引物5'-CTAGACTAGTTCAGATTCCA-3',反 链 引 物5'-AGTCTTATTAGTCAGGTCA-3';CHOP正 链引物5’-TGATCGTGGTAACTAATT-3',反链引物5'-TGATGCATTAGCTAGAAT-3';GAPDH正链引物5'-AGTCGTTACGTACCGT-3',反链引物5'-TAGTCA GTAAGGTCATATT-3'。PCR扩增条件:95℃ 5 min;95℃ 20 s、60℃ 50 s、72℃ 35 s,38个循环。GAPDH作为mRNA的标准内参,基因表达结果均以2-△△ct进行统计。
1.7 统计学处理
采用GraphPad Prism 7软件对数据进行统计分析,计量资料以±s表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验;以P< 0.05为差异有统计学意义。
2 结 果
2.1 ATF4在各组小鼠的表达
蛋白质印迹检测和实时荧光定量PCR结果显示,与对照野生组比较,其他3组小鼠股骨中ATF4蛋白和基因表达量增加,差异均有统计学意义(P< 0.05,图1)。与TM野生组和ATF4+/+组比较,TM ATF4+/+组的ATF4蛋白和基因表达量增加,差异均有统计学意义(P< 0.05,图1)。
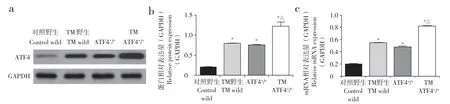
图1 4组小鼠股骨中ATF4蛋白和基因表达Fig. 1 Expression of ATF4 protein and gene in femur of 4 group mice
2.2 小鼠股骨影像学结果
MicroCT结果显示,与对照野生组相比,其他3组小鼠股骨BMD、Tb.BV/TV和Tb.N降低,Tb.Sp升高,差异均有统计学意义(P< 0.05,表1,图2)。与TM野生组和ATF4+/+组相比,TM ATF4+/+组小鼠的BMD、Tb.BV/TV和Tb.N降低,Tb.Sp升高,差异均有统计学意义(P< 0.05,表1,图2)。
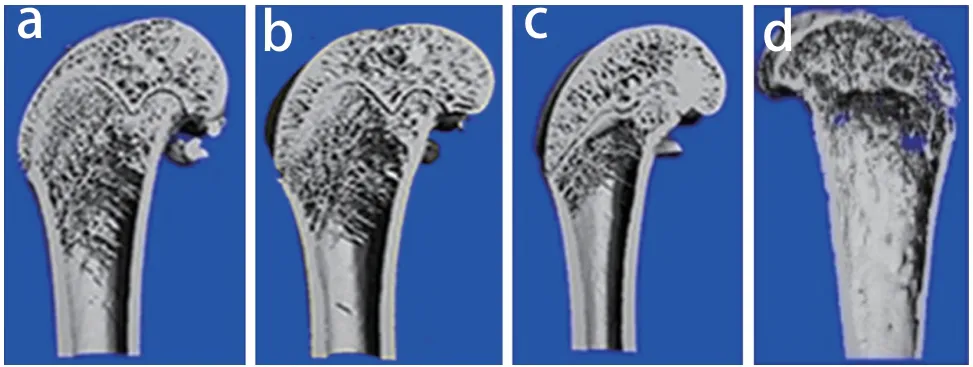
图2 4组小鼠股骨microCT扫描三维重建Fig. 2 MicroCT three-dimensional reconstruction of femur in 4 group mice
表1 4组小鼠骨密度相关指标Tab. 1 Related indexes of bone mineral density of 4 group mice n=10,±s
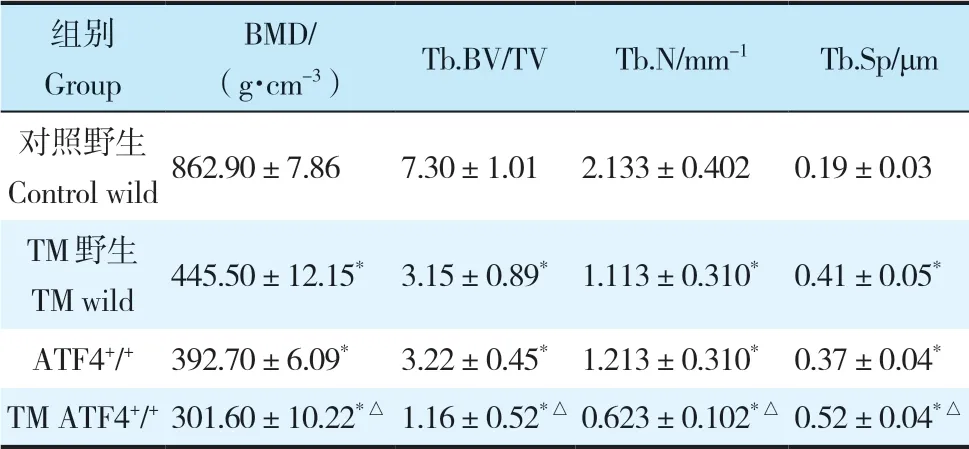
表1 4组小鼠骨密度相关指标Tab. 1 Related indexes of bone mineral density of 4 group mice n=10,±s
注:*与对照野生组比较,P < 0.05;△与TM野生组和ATF4+/+组比较,P < 0.05。Note:* P < 0.05,compared with control wild group;△P < 0.05,compared with TM wild group and ATF4+/+ group.
组别Group BMD/(g·cm-3) Tb.BV/TV Tb.N/mm-1 Tb.Sp/μm对照野生Control wild862.90±7.86 7.30±1.01 2.133±0.402 0.19±0.03 TM野生TM wild 445.50±12.15* 3.15±0.89* 1.113±0.310* 0.41±0.05*ATF4+/+ 392.70±6.09* 3.22±0.45* 1.213±0.310* 0.37±0.04*TM ATF4+/+ 301.60±10.22*△1.16±0.52*△0.623±0.102*△0.52±0.04*△
2.3 HE染色结果
HE染色结果显示,对照野生组小鼠股骨干骺端镜下骨小梁呈网状,排列整齐,骨微结构完整。与对照野生组小鼠相比,其他3组小鼠股骨干骺端骨小梁变细,结构断裂混乱,骨小梁数量减少;并且骨小梁相对面积减少,差异有统计学意义(P<0.05,图3)。与TM野生组和ATF4+/+组小鼠相比,TM ATF4+/+组的股骨干骺端骨小梁更加细小,骨小梁数量明显减少,骨髓腔间隙变大;并且骨小梁相对面积减少,差异有统计学意义(P< 0.05,图3)。
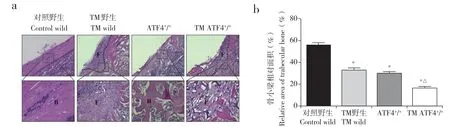
图3 4组小鼠股骨HE染色结果Fig. 3 HE staining results of femur in 4 group mice
2.4 成骨相关因子表达
蛋白质印迹分析和实时荧光定量PCR检测结果显示,与对照野生组比较,其他3组小鼠的成骨相关因子Runx2、OSX、Ocn的蛋白和基因表达量降低,差异均有统计学意义(P< 0.05,图4)。与TM野生组和ATF4+/+组比较,TM ATF4+/+组的Runx2、Osx、Ocn蛋白和基因表达量降低,差异均有统计学意义(P< 0.05,图4)。

图4 4组小鼠股骨中成骨相关因子蛋白和基因表达Fig. 4 Protein and gene expressions of bone formation related factors of femur in 4 group mice
2.5 CHOP表达
蛋白质印迹分析和实时荧光定量PCR检测结果显示,与对照野生组比较,其他3组小鼠CHOP的蛋白和基因表达量增加,差异均有统计学意义(P< 0.05,图5)。与TM野生组和ATF4+/+组比较,TM ATF4+/+组的CHOP的蛋白和基因表达量增加,差异均有统计学意义(P< 0.05,图5)。

图5 4组小鼠股骨中CHOP蛋白和基因表达Fig. 5 Protein and gene expressions of CHOP of femur in 4 group mice
3 讨 论
ERS是一种细胞自我保护反应,适度的应激可减轻损伤,维护细胞内的稳态,但过度或长期的应激会导致细胞的凋亡[14]。在骨代谢过程中,内质网对细胞内稳态的维持至关重要,一方面,轻度的ERS通过促进Runx2等成骨因子表达维持骨内成骨细胞和破骨细胞生长及骨髓间充质干细胞的分化,并抑制细胞凋亡发生[9];另一方面,在高强度长时间的应激状态下,骨内多种信号通路诱导细胞凋亡,加速骨钙丢失[10]。ERS相关基因参与骨骼细胞的生长和分化,是导致骨质疏松的重要因素之一[15]。
ATF4是ERS影响成骨细胞增殖分化和骨代谢过程的重要因素[6]。ERS通过磷酸化eIF2α促进 ATF4的转录,从而激活CHOP信号通路[16]。在ERS过度状态下,ATF4/CHOP途径被激活,可促进Bax、Caspase等凋亡信号分子大量生成,进而诱导成骨细胞凋亡,抑制成骨分化,导致骨质疏松、骨发育不全等一系列病理过程[17]。
基于以上研究基础,本研究通过构建体内模型探讨ATF4过表达在ERS所导致骨质疏松中的作用,以及ATF4/CHOP信号通路的变化。研究结果发现,ATF4在骨质疏松小鼠骨组织中表达上调;激活小鼠骨组织的ERS后,ATF4表达增加,而骨相关因子和骨密度均降低;进一步使ATF4过表达后,发现其能抑制小鼠骨代谢,导致小鼠骨质疏松。实验证明,ATF4可通过ATF4/CHOP信号通路参与ERS进而导致小鼠骨质疏松。
综上所述,ERS可能通过促进ATF4过表达激活CHOP 信号通路,从而导致骨质疏松的发生。因此,ATF4/CHOP信号通路的激活可能对骨质疏松的发生有重要意义。本研究为动物实验,更具体的分子机制仍需通过体外实验进一步验证。
