超声波植冰对L-02肝细胞低温保存的影响
2021-08-20李维杰宋立勇刘宝林
李维杰 宋立勇 刘宝林 宗 果
(1 上海理工大学生物系统热科学研究所 上海 200093;2 上海明悦医疗科技有限公司 上海 200120)
细胞低温保存是用于现代再生医学、器官移植和辅助生殖的一项关键技术,细胞治疗是目前公认对抗癌症等疑难杂症的有效手段,受到各方的广泛关注。细胞的冷冻保存一般是将细胞冷冻至较低的温度(通常为-196 ℃),细胞在低温下无生命活动,因此能够长期保存,但在冷却过程中可能会发生严重的细胞损伤。为了减轻冷冻损伤,现在普遍采用的细胞冷冻方案是在细胞溶液中加入一定浓度的低温保护剂,采用慢速冷冻或玻璃化的方法进行冷冻。对于慢速冷冻,降温速率会对细胞的存活率和继续发育造成巨大的影响。根据两因素假说理论,认为细胞低温损伤主要是胞内冰损伤[1]和溶液损伤[2-3],冷却速率过快,导致胞内冰晶产生,冷却速率越快,该损伤越大;冷却速率过慢,导致细胞长期暴露于高浓度溶液中造成溶液损伤,冷却速率越慢,损伤越大。在降温速率主导的两种损伤因素共同作用下,细胞低温保存必然存在一个最佳的降温速率,使得在该速率下既能够减少胞内冰晶的产生,又能避免溶液损伤。但在实际降温过程中,细胞溶液会出现过冷现象[4-5],较大的过冷度会使细胞溶液因释放潜热而温度上升,导致细胞的降温速率远高于最佳的降温速率,较高的降温速率会引起细胞不可控的结晶,细胞突然结冰,脱水不充分,胞内冰大量生长,导致细胞大量死亡。
降低过冷度是提高低温保存效果的关键。目前降低过冷度主要通过植冰操作完成,植冰是指通过人为操作使细胞溶液在较高的零下温度提前结冰的过程,该过程可以避免较大过冷度下的胞内冰损伤[6]。传统的植冰方法主要是用预冷探针(如金属棒或手术钳)来接触容器的侧面,从而提供局部过冷诱发成核[7-9],也可以在细胞溶液中添加冰核细菌诱发冻结[10-12],还可以通过电极诱导[13-15],摇晃、振动、超声[16-18]等机械能,或改变降温速率[19]、压力[20]等方式诱导成核。目前关于超声波诱导冰晶生成的研究,仅限于食品材料的冻结,例如,用于冰淇淋制造,珍贵食品、药物、疫苗的冷冻浓缩和冷冻干燥等[21-23],但在细胞低温保存领域,鲜有文献报道。
关于超声波影响结晶的作用机理尚不明确,针对超声成核有三种理论模型,第一种理论模型,R.Hickling[24]认为在空化气泡破裂的最后阶段会发生大于1 000 MPa正压力波,由于较高的压力下空化气泡附近的液体短暂进入亚稳态的过冷状态,从而增加水的平衡冻结温度并导致冰成核;第二种理论模型,J.D.Hunt等[25]认为空化气泡破裂的负压会增加水的平衡冻结温度并导致成核;第三种理论模型,R.Chow等[26]认为当空化气泡产生剧烈的循环运动,气体进出气泡以及周围的流体中形成强涡流时均会形成微流,微流可以增强伴随冷冻过程的传热和传质过程,溶液达到一定过冷度,可能会触发成核。三种理论模型中,空化气泡在冰的成核中起着重要的作用。
本实验选取人肝细胞为研究对象,利用自行设计的超声波植冰装置研究超声波诱导成核对肝细胞低温保存的影响,同时探索超声波成核的相关机理。
1 材料和方法
1.1 实验装置
本文超声波植冰装置如图1所示,由4个部分组成。1)超声容器:多个细胞冻存管和对照冻存管可盛放于样本槽管中,样本槽管安置在超声内盒体中。2)温度检测系统:由第一热电偶电极、第二热电偶电极和温度数据采集模块组成,第一热电偶电极放在对照冻存管内,用于实时检测细胞溶液的温度,第二热电偶电极放在超声内盒体的相变液溶液中,用于实时检测控温相变液的温度。3)超声波诱导成核系统:由超声波振子和超声波发生器组成,其中超声波振子均匀的粘结在样本槽管的底部,超声波从样本槽管底部向上传播至冻存管中,超声波频率为40 kHz,超声波强度由低到高分别为0.032 9、0.104 1、0.208 8、0.331 2、0.392 5、0.431 6、0.460 7、0.502 6 W/cm2。4)冷却循环系统:配制体积分数为38.5%的乙二醇控温相变液,该溶液可降温至-20 ℃不结冰,超声内盒体和低温恒温槽中加载配制好的控温相变液,超声容器内冷冻液与低温恒温槽内冷冻液组成一个闭合循环回路,低温恒温槽自带制冷循环系统,超声容器内的温度分布均匀。

1超声波发生器;2超声波振子;3超声内盒体;4、5 控温相变液;6低温恒温槽;7第一热电偶;8第二热电偶;9温度数据采集模块;10对照冻存管;11细胞冻存管;12流量控制阀。图1 超声波冷冻植冰系统Fig.1 The ultrasonic ice seeding system
1.2 材料和试剂
实验所用主要材料和试剂:L-02原代肝细胞(购于上海富衡生物科技有限公司),胎牛血清(Gemini公司),培养基RPMI-1640(Gibco公司),胰蛋白酶(TBD公司),二甲基亚砜Me2SO(阿拉丁公司),PBS缓冲液(TBD公司),乙二醇(麦克林),T-25培养瓶(NEST耐思),50 mL离心管(NEST耐思),15 mL离心管(NEST耐思),1.5 mL离心管无菌(Axygen公司),2 mL冻存管(NEST耐思),AO/PI双染试剂盒(BestBio)。
1.3 仪器和设备
本文所用仪器设备:光学显微镜(日本尼康公司),荧光显微镜(日本尼康公司),低速台式离心机(上海安亭),CO2细胞培养箱(上海博讯公司),程序降温盒(赛默飞世尔生物化学制品有限公司),超低温冰箱(青岛海尔特种电器有限公司),低温恒温槽(宁波天恒仪器厂),智能多路温度测试仪(常州安柏精密仪器有限公司),差示扫描量热仪(德国耐驰公司)。
1.4 细胞培养
在补充有体积分数为10%胎牛血清的1640培养基中培养L-02肝细胞。将它们放在37 ℃,体积分数为5% CO2的培养箱中进行培养。实验时,先观察培养瓶中的数量,待细胞长满底壁时,轻轻吸弃培养瓶里的上清液,向长满底壁的L-02细胞培养瓶中加入1 mL PBS缓冲液,轻柔洗涤两次后吸弃PBS,加入800 μL胰蛋白酶,将培养瓶置入培养箱中进行消化3 min,待光学显微镜下观察到细胞形态已成圆状,轻轻拍打培养瓶的侧面,细胞能够完全脱离壁面,加入2 mL完全培养基终止消化。利用1 mL的移液枪吸取培养液对培养瓶底壁进行轻柔均匀的反复吹打,确保细胞脱离底壁已全部进入溶液中,将细胞从培养瓶中取出,以1 000 r/min的转速离心4 min,然后重悬于培养基中备用。
1.5 保护剂结晶温度测量
使用差式扫描量热仪(DSC)测量体积分数分别为0%、3%、5%的Me2SO保护剂的结晶温度。将DSC程序设定为:30 ℃等温1 min,以30 ℃/min速率降温至-80 ℃,平衡1 min,再以10 ℃/min速率升温至30 ℃。参比侧放置一个空白坩埚,每组保护剂实验重复三次。采用DSC分析软件PYRIS Manager分析相变温度。
1.6 肝细胞的冷冻保存
肝细胞冻存方法包括两种,分别采用超声波植冰冻存和程序降温慢速冻存,每组设置3个平行组。超声波植冰冻存的方法如下:提前准备载冷剂,该液体为体积分数38.5%的乙二醇,温度最低可降至-20 ℃。将含有不同体积分数(3%、5%、10%)的Me2SO细胞溶液重悬后,各取500 μL分装到3个2 mL的冻存管中,每个冻存管肝细胞悬液体积为500 μL,另取冻存管作为对照冻存管,并添加等量不含肝细胞的保护剂溶液,将对照冻存管和3个细胞冻存管同时放置在超声波植冰装置的样本槽中。植冰时,首先将搭载好的超声容器与低温恒温槽连接,将配制好的体积分数为38.5%的乙二醇载冷剂注入超声内盒体和低温恒温槽中,开启低温恒槽的制冷循环系统,待第二热电偶检测到超声容器内控温相变液温度达到指定需要的温度并保持恒温状态,通过第一热电偶实时监测冻存管温度,当冻存管温度达到指定植冰温度时,启动超声波发生器电源,超声波启动,植冰结束后关闭超声波,细胞冻存管在控温相变液中平衡5 min使冰晶生长完全,平衡结束之后盖上降温盒的盖子,将降温盒转移至-80 ℃冰箱进行低温保存过夜,第二天再将冻存管转移至液氮冻存24 h。程序降温慢速冷冻组方法是将含有体积分数分别为3%、5%、10% 的Me2SO的细胞重悬后,等份分装到3个2 mL的冻存管中,每支含有500 μL肝细胞悬液的冻存管直接装入程序降温盒置于-80 ℃的冰箱过夜,第二天转移至液氮深低温保存。
1.7 肝细胞的复苏
低温保存24 h后,将冻存管从液氮中取出,放入37 ℃水浴锅中摇晃振荡2~3 min进行细胞复苏。最后,将冻存管中细胞溶液转移至15 mL离心管中,以1 000 r/min离心4 min,去除上清液,再加入PBS缓冲液清洗一遍,以1 000 r/min转速离心4 min,加入完全培养基重悬,以进一步检查细胞存活率。
1.8 肝细胞计数和存活率测定
细胞离心后用培养基重悬1 mL,吸取10 μL的细胞重悬液到血球计数板一侧凹槽内,加盖盖玻片后在光学显微镜下进行细胞计数,计数方法如式(1)所示,计数要求按照:计上不计下,计左不计右的原则,细胞浓度为1×105~1×106个/mL。由于AOPI染料比台盼蓝染料精确度更高,本实验采取AOPI染料检测细胞的存活率。为评估冷冻保存后细胞的存活率,将离心后细胞用培养基稀释成细胞悬液,用15 μL移液枪吸取15 μL细胞悬液至1.5 mL离心管中,避光加入15 μL AOPI染液。AOPI染液的配制方法:取100 μL试剂C用900 μL的PBS缓冲液稀释,充分混匀后,加入10 μL的AO染色液和20 μL的PI染色液。当避光加入体积比为1∶1的AOPI染色液后,轻轻混匀在4 ℃避光孵育10~20 min,孵育完成后吸取15 μL细胞染色液在载玻片的中央,盖上盖玻片在荧光显微镜下进行观察,荧光显微镜激发光源波长为488 nm,接受光波长为520 nm。明场里找到细胞后,再打开荧光在暗室里观察,最后利用Image Pro Plus 6.0软件进行计数。细胞存活率如式(2)所示。
(1)
式中:β为细胞浓度,个/mL;a为4个大方格总数;b为稀释倍数。
(2)
式中:γ为细胞存活率;m为活细胞数;n为死细胞数。
1.9 统计分析
获得的荧光图片采用Image Pro Plus 6.0软件进行分析。数据采用IBM SPSS Statistics 22.0软件处理。每个样本重复3次,数据以平均数±标准差(SD)表示,以p<0.05作为差异显著评判标准,有统计学意义。
2 结果与讨论
2.1 植冰温度上阈的确立
利用DSC分析软件Pyris Manager计算出不同体积分数Me2SO溶液的熔融温度,结果如图2所示,此处每组仅展示不同体积分数Me2SO中的一次熔融温度曲线,其中体积分数为0%、3%、5%的Me2SO熔融温度分别为(-3.77±0.2)℃、(-5.84±0.49)℃、(-7.37±0.81)℃。当溶液温度高于熔融温度,溶液不会结冰,只有当溶液温度低于熔融温度时,溶液才有结冰的可能。根据相变温度,可以确定超声波植冰的温度范围。体积分数为0%、3%、5%的Me2SO溶液植冰温度上阈分别为-4、-6、-7 ℃。

图2 不同体积分数Me2SO肝细胞溶液复温相变熔融曲线Fig.2 Melting curves of phase transition in different volume concentrations of Me2SO hepatocyte solution
2.2 超声植冰对细胞冻存的影响
对使用体积分数分别为5%和10%的Me2SO肝细胞悬液进行传统慢速冷冻和超声波植冰操作,预冷温度为 -9 ℃,超声波强度为0.331 2 W/cm2,结果如图3所示(不同字母代表有显著性差异。显著性:p<0.05;误差:SD,下同)。由图3(a)可知,两个超声植冰组均取得较好的保存效果,几乎无死细胞,体积分数为10%的Me2SO组作为实验室最常用的保存方式,效果相对较好,但也有部分细胞死亡,而体积分数为5%的Me2SO组保存效果较差,有较多的死细胞。结合图3(b)可知,10%Me2SO+超声植冰组和5%Me2SO+超声植冰组与新鲜组细胞存活率无显著性差异,传统的保护剂方案,加入10%Me2SO的细胞溶液冻存后,细胞存活率也能够达到(87.2±5.6)%,但与新鲜组对照有显著差异。当降低悬液中Me2SO体积分数为5%时,细胞存活率仅为(62.2±2.9)%,这也验证经典的细胞保存方案为何使用体积分数为10%的Me2SO。但5%Me2SO+超声植冰组细胞存活率能达到(93.4±1.1)%,与传统保存方案相比,细胞存活率大幅提高,且与新鲜对照组无显著性差异,表明超声植冰有效改善了细胞低温保存。

图3 超声植冰对肝细胞存活率的影响Fig.3 The effect of ultrasonic ice seeding on the survival rate of hepatocytes
2.3 超声波植冰与传统植冰方式的对比
图4所示为传统植冰与超声植冰对肝细胞存活率的影响。当添加体积分数为10%Me2SO,预冷温度为-9 ℃时,传统植冰细胞存活率为(88.81±1.6)%,超声植冰细胞存活率为(92.98±1.7)%,存在显著性差异;当添加体积分数5%Me2SO,预冷温度为-9 ℃时,与传统植冰方式相比,超声植冰存活率大幅提高,细胞存活率达到(93.4±1.1)%,而传统植冰方式细胞存活率仅为(76±1.4)%,显然超声植冰在不同体积分数Me2SO下要比传统植冰更具优势。与传统保存方案相比,传统植冰在-9 ℃植冰能略微提高细胞存活率,但降低Me2SO的体积分数为5%时,传统植冰在较低预冷温度下植冰的效果不显著,而超声植冰在较低的植冰温度下发挥了更大的改善细胞存活率的作用。原因可能是超声波植冰操作过程中无需将冻存管从冰盒中取出,植冰成功率较高,而传统植冰需要将冻存管反复取出,温度波动大,且成功率低,充分体现了超声波植冰一致性强、成功率高、保存效果好的特点。
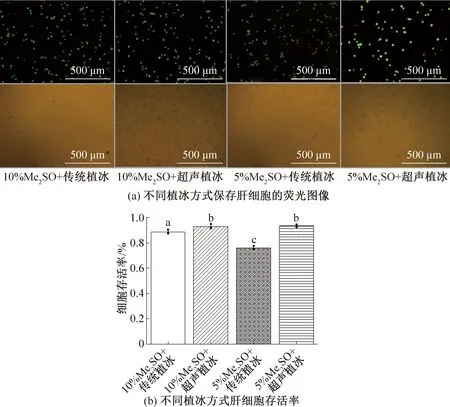
图4 传统植冰与超声波植冰对肝细胞存活率的影响Fig.4 The effect of traditional ice seeding and ultrasonic ice seeding on the survival rate of hepatocytes
2.4 不同超声波强度对肝细胞冻存的影响
图5所示为不同超声波强度对肝细胞存活率的影响。当使用体积分数为5%的Me2SO,植冰温度为-9 ℃时,超声波强度分别为0.032 9、0.104 1、0.331 2、0.431 6、0.502 6 W/cm2对细胞进行保存,检测细胞的冷冻存活率。当超声波强度小于0.431 6 W/cm2时,细胞均得到较好的保存,存活率均在90%以上,满足样本库等细胞库的需求,组别间无著性差异,当超声波强度大于0.431 6 W/cm2时,细胞存活率显著下降。这是由于超声波植冰利用了空化效应,空化气泡中的气压会增至气泡无法承受的程度而发生破裂[27],气泡生长、收缩、破裂的过程可以增强伴随细胞冷冻过程中的传热和传质过程[28-29],降低界面能[30-33],触发成核,大功率的超声波对植物细胞膜产生破坏[34],在合适的超声强度范围,对细胞冻存均有积极影响。

图5 不同超声波强度对肝细胞存活率的影响Fig.5 The effect of different ultrasonic intensities on the survival rate of hepatocytes
2.5 植冰温度对细胞存活率的影响
当使用体积分数为5% Me2SO,超声波强度为0.104 1 W/cm2时,不同植冰温度(-7、-8、-9 ℃)时的细胞存活率如图6所示。由图6可知,当植冰温度为-7 ℃和-8 ℃时,细胞得到较好保存,几乎全部存活,存活率分别为(97±2.6)%、(95.9±0.2)%。当植冰温度为-9 ℃时,细胞存活率略有下降,为(90.8±1.9)%,可知不同温度对保存效果存在显著性差异。这是由于植冰温度越低,细胞的过冷度越高,由于过冷度是造成细胞死亡的重要因素,应尽量提高植冰温度,减少过冷度,但植冰温度不能无限制提升,必须低于溶液结晶温度。
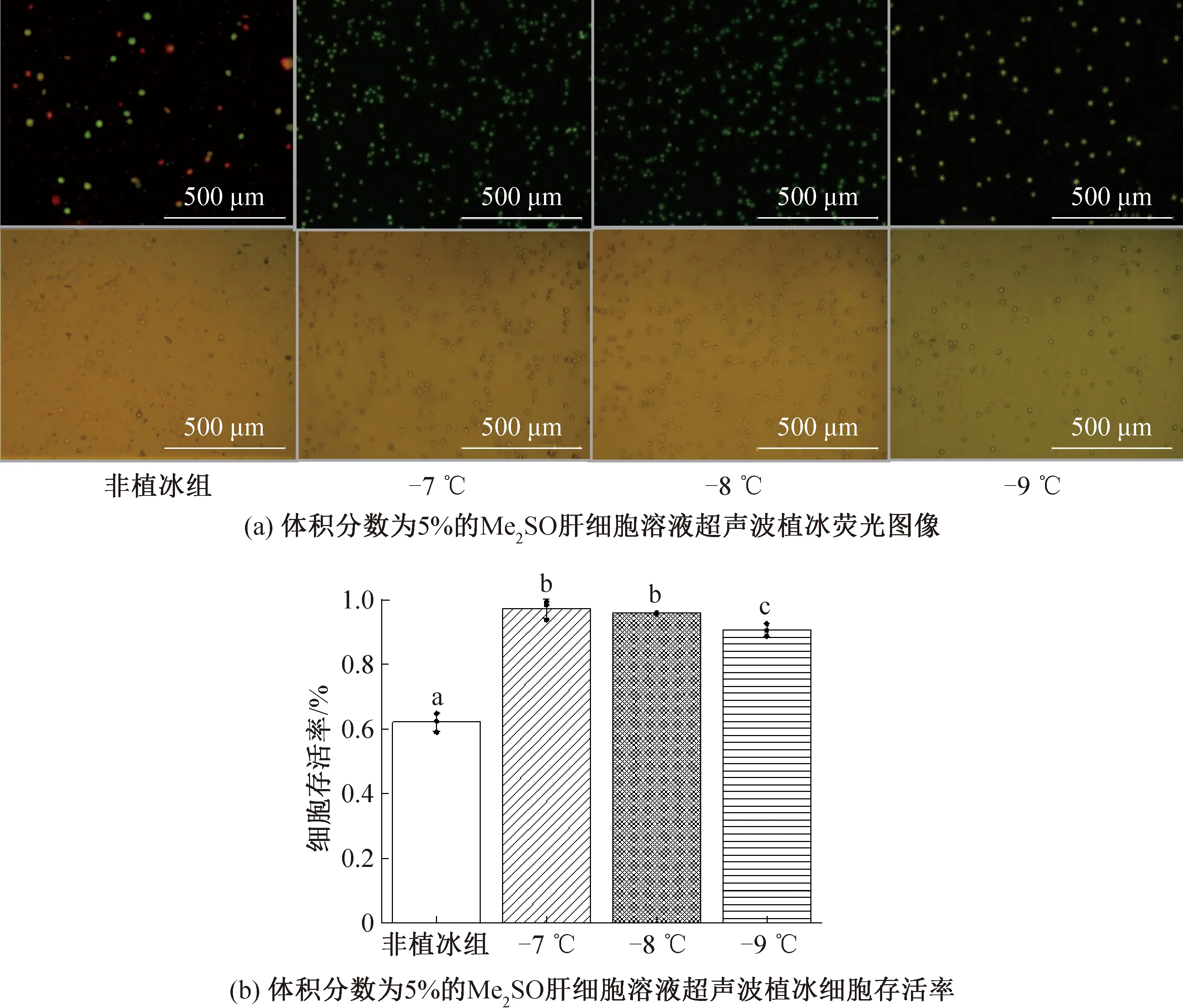
图6 不同预冷温度下超声波植冰对肝细胞存活率的影响Fig.6 The effect of ultrasonic ice seeding on hepatocytes survival rate under different pre-cooling temperatures
2.6 最优体积分数Me2SO的确立
使用超声波强度为0.104 1 W/cm2,对不同体积分数Me2SO(0 %、3 %、5 %)的细胞悬液进行低温保存,根据2.5的结论,在保证植冰成功的前提下,植冰温度应尽量高,即采用对应体积分数的上阈温度(-4、-6、-7 ℃)进行植冰。结果如图7所示,当Me2SO体积分数为0%时,细胞依然有存活,存活率高达(11.7±2.0)%,而体积分数为3% Me2SO细胞存活率为(91.32±1.3)%,低于5% Me2SO细胞存活率为(97±2.6)%时的保存效果,各组别之间均有显著性差异。可知,超声波植冰可以降低细胞溶液过程中的过冷度,改变较大过冷度下因释放潜热而与周围环境温度形成较大温差,细胞内外形成应力,最后形成较快的降温速率,防止胞内冰的形成。Me2SO作为一种小分子的渗透性保护剂,可以渗透到细胞内,它们以比水慢的速度进入细胞,使细胞因渗透而失水,使胞内冰减少,减少胞内冰的损伤,有一定的毒性,但植冰操作仍然无法消除Me2SO的使用。
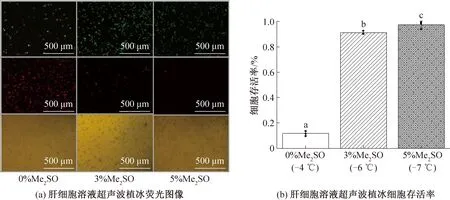
图7 熔融温度下超声植冰对肝细胞存活率的影响Fig.7 The effect of ultrasonic ice seeding on hepatocytes survival rate at melting temperature
3 结论
为了提高传统慢速冷冻方案过程中细胞低温保存后的存活率,降低渗透性保护剂Me2SO的添加量,本文设计的超声波植冰系统诱导冰晶成核,与传统的保护剂方案进行对比,研究了在慢速冷冻过程中超声植冰,不同超声波强度、不同植冰温度、不同保护剂浓度对肝细胞存活率的影响,得到如下结论:
1)当超声波频率为40 kHz,超声波强度为0.104 1 W/cm2,预冷温度为-9 ℃时,10%Me2SO+超声植冰组和5%Me2SO+超声植冰组低温冻存后复苏肝细胞存活率分别为(92.98±1.7)%、(93.4±1.1)%,与新鲜组(98.4±1.1)%相比,无显著性差异(p<0.05),比对应保护剂非植冰操作方案有显著提高;与10%Me2SO+传统植冰组和5%Me2SO+传统植冰组低温冻存后复苏肝细胞存活率分别为(88.81±1.6)%、(76±1.4)%相比,有显著性差异(p<0.05),比传统植冰组存活率高。
2)当超声波频率为40 kHz,超声波强度为0.032 9~0.431 6 W/cm2,预冷温度为-9 ℃时,细胞存活率均在90%以上,组间无显著性差异(p<0.05),当超声波强度大于0.431 6 W/cm2时,肝细胞存活率显著下降。
3)使用体积分数为5%的Me2SO在-7 ℃超声植冰,超声波强度为0.104 1 W/cm2,肝细胞存活率最高,存活率达到(97±2.6)%,与新鲜组无显著性差异。
