脑缺血/再灌注损伤小鼠生物学特性及稳定性
2021-08-20陈晓雪陈雅婧贾宇臣
赵 凯,陈晓雪,陈雅婧,贾宇臣*
(1.呼和浩特市第一医院,呼和浩特 010030;2.内蒙古医科大学分子生物学研究中心,呼和浩特 010059)
目前,脑血管病已成为世界范围内主要疾病之一,其具有高发病率、高致残率、高死亡率的特点[1],成为中国第一位致死和致残的原因,给社会和家庭带来了沉重的经济负担[2]。全球范围内每年新发脑卒中病例高达1 030万[3]。中国面临着世界上最大的卒中挑战,卒中死亡排名第三[4-5]。脑血管病分为缺血性脑卒中和出血性脑卒中,其中缺血性脑卒中发病率更高,约占85%,缺血性脑卒中是由脑部血管内狭窄或形成血栓, 栓子脱离堵塞血管,引起脑内局灶性缺血[6]。临床上缺血性脑卒中的首要治疗方式主要是尽快静脉溶栓,然而只有少部分患者能在卒中发生后6 h时间窗内入院接受静脉溶栓治疗[7],并且在治疗过程中往往会导致缺血再灌注损伤[8]。因此,卒中的治疗与预防成为神经科学研究领域的热点之一。如何简单、快速、稳定地建立卒中动物模型一直是一个棘手问题。大脑中动脉线栓法制备脑缺血模型是经典的栓塞模型,可以很好地阻断大脑中动脉远端缺血,与临床血管闭塞部位类似度高[9]。但由于不同的操作手术程序,不同的处理对模型的成功和稳定性影响差异显著。现参照Longa线栓法[10],在线栓的插入方式、血管的分离及处理等方面进行探讨,旨在建立一种操作简单且稳定性高、成功率高、术后生存率高的脑缺血再灌注(cerebral ischemia/reperfusion,CI/R)损伤小鼠模型的方法。
1 材料与方法
1.1 材料
1.1.1 实验动物及分组
健康清洁级 C57BL/6小鼠70只,雄性,周龄5~6周,体重25~30 g,购于内蒙古大学动物中心[许可证号:SCXK(蒙)2016-0001],适应性饲养1周以上,保持室温25 ℃,相对湿度55%。采用随机分组方式分为:假手术组(n=10)、颈总动脉(common carotid artery,CCA)进线组(n=30)及颈外动脉(external carotid artery,ECA)进线组(n=30)。
1.1.2 实验试剂
水合氯醛(国药集团化学试剂有限公司),2,3,5-氯化三苯基四氮唑TTC(2,3,5-triphenyhetrazolium chloride,TTC,sigma Aldrich,T8877),4%多聚甲醛(北京索莱宝科技有限公司,Cat#P1110)。
1.1.3 实验仪器及材料
体式解剖显微镜(江西凤凰光学科技有限公司,XTL-165),电凝笔(德国台电,V50),手术显微器械(张家港青松公司,77002、77007),硅胶线栓(广州佳灵生物科技有限公司,2000-20)。
1.2 实验方法
1.2.1 缺血再灌注小鼠模型的制备
(1)ECA进线组小鼠模型制作过程。术前禁食24 h,自由饮水。4%水合氯醛按10 g体重0.1 mL剂量腹腔注射麻醉小鼠,5~10 min小鼠翻正反射消失后,将小鼠仰卧位固定于手术板上,75%医用酒精消毒处理手术区,沿颈部正中偏右侧约2 mm处剪开表皮,钝性分离右侧胸锁乳突肌内侧缘,分离右侧颈总动脉(CCA)、颈外动脉(ECA),枕动脉,颈内动脉(internalcarotid artery,ICA);在CCA近心端处和ICA远心端分别备手术缝合线一根,前者打活结,用于牵拉或防渗血,后者用于栓塞后固定线栓;用微血管动脉夹夹闭CCA、ICA,接着凝断枕动脉,在ECA靠近颈动脉分叉(carotid bifuracation,CB)中间端用显微剪剪一小口,将头部直径0.20 mm的线栓经该剪口插入,向CCA方向插入。确认线栓进入CCA后,使用电凝笔电灼ECA的远心端后,牵拉ECA游离端及线栓一同反折,使之与ICA走向一致时,顺势缓慢将线栓推入ICA,当微感阻力时即停止送线,自CB处算起,线栓进入长度在9~10 mm,用预留在ICA远心端的备用手术缝合线固定住线栓;在线栓推进过程中,若在大约5 mm处线栓感到强烈阻力,即可能是误入了ICA的颅外唯一分支翼腭动脉(pterygo palatineartery, PPA),此时将CCA提紧后,反复抽出、插入线栓,尝试几次后即可使线栓继续顺利深入;插入90 min后再灌注时再次麻醉小鼠,打开切口将线栓拔出,电凝ECA游离端,打开CCA近心端处活结,观察颈总动脉恢复搏动,实现再通后缝合肌肉和皮肤[10]。术后,将小鼠置于37 ℃恒温电热毯上保温。
(2)CCA进线组小鼠模型制作过程。CCA进线组血管分离与上述方法相同。分离出各血管后,在CCA远心端和ICA远心端备一根缝合线,线一用于牵拉阻断血流,线二用于栓塞后固定线栓,微血管动脉夹夹闭CCA、ICA,在CCA靠近分叉处2~3 mm处剪一小口,线栓经该剪口顺CCA插入ICA,当进栓深度9~10 mm微感阻力即停止送线,用预留手术缝合线固定住线栓,结扎CCA远心端,90 min后再灌注时再次麻醉小鼠,打开切口,抽出线栓,永久结扎CCA与ICA,缝合肌肉和皮肤。术后,将小鼠置于37 ℃恒温电热毯上保温。
(3)假手术组制作过程。假手术组将CCA、ECA、ICA分离后依次缝合肌肉和皮肤即可,不插入线栓。
1.2.2 神经缺损评分即成功率、存活率计算
术后24 h,参照Zea Longa方法进行神经功能评分:0分,无神经功能损伤表现;1分,表现为提尾悬空左前肢不能伸展,为轻度神经损伤;2分,表现为行走时向左侧转圈,为中度神经损伤;3分,行走困难,且向左侧倾倒,为重度神经损伤;4分,无法自主行走或昏迷。1~3分为模型成功。剔除造模死亡及没出现神经功能障碍的小鼠[11-12]。计算公式如下。
V=A1/A2×100%
(1)
S=B1/B2×100%
(2)
式中:V为模型成功率;A1为成功动物数量;A2为实验动物总数;S为存活率;B1为存活动物数量;B2为实验动物总数。
1.2.3 各组小鼠缺血再灌注后体重变化率情况
在术前、术后24 h测量各组小鼠体重,小鼠体重变化率计算公式为
W=(W1-W2)/W1×100%
(3)
式(3)中:W为小鼠体重变化率;W1为术前体重;W2为术后体重。
1.2.4 脑梗死体积的检测
术后24 h后予以腹腔注射4%水合氯醛麻醉小鼠,立即断头取脑,去除嗅球、小脑和脑干,-20 ℃冷冻20 min后,从前往后行冠状连续切片,厚度约为2 mm,将脑片浸泡于0.5% TTC染色液中,37 ℃避光孵育20 min。拍照,染色后正常脑组织呈红色,梗死区呈白色。采用Image-Pro Plus6.0软件测量计算脑梗死体积,相对脑梗死体积计算公式为
I=[(S′1+S′2+…+S′n)-(S1+S2+…+Sn)]/(S′1+S′2+…+S′n)×100%
(4)
式(4)中:S′1,S′2,…,S′n为各层正常侧脑组织面积;S1,S2,…,Sn为各层梗死侧非梗死区脑组织面积。
1.2.5 脑组织病理学观察
小鼠经腹腔注射4%水合氯醛麻醉后,将小鼠仰卧位固定于手术板上,75%医用酒精消毒处理胸部,眼科剪沿胸部正中线左侧依次剪开表皮、肌肉和肋骨,暴露出心脏,剪去右心耳,用5 mL注射器吸取生理盐水在心尖处注射,反复2~3次,直至右心耳处流出的液体不含血色后,吸取4%多聚甲醛经心尖处注入,内灌注固定,直至四肢变白,尾巴根部翘起。内灌注完成后,立即取出全脑置于4%多聚甲醛溶液24 h后,置于30%蔗糖溶液脱水过夜,石蜡包埋,行冠状连续切片,厚度为4 μm,经苏木素/伊红染色(hematoxylin-eosin staining,HE),在光学显微镜下观察脑组织形态学上的病理改变。
1.3 统计学分析
应用SPSS18.0软件进行数据处理及统计分析,计量资料采用均数±标准差表示,组间采用方差分析,计数资料采用卡方检验,P<0.05具有统计学意义。
2 结果
2.1 各组小鼠术后神经功能缺损评分及存活率、成功率比较
神经功能缺损评分可以直观判断小鼠脑损伤程度及模型成功与否。缺血再灌注24 h,采用Zea Longa方法进行神经功能评定。如表1所示,ECA进线组存活率为90%,CCA进线组存活率为66.7%,两组有显著性差异(P=0.028)。两组造模成功率为:ECA进线组83.3%,CCA进线组56.7%,差异有显著性(P=0.024)。ECA进线组在2~3分比率占70.0%,CCA进线组占43.3%,差异有显著性(P=0.037)。CCA进线组共30只,存活20只,死亡10只,其中3只为术中死亡,3只拔出线栓后2 h内死亡,4只次日死亡;ECA进线组共30只,存活27只,死亡3只,其中术中死亡1只,次日死亡2只。经解剖发现CCA进线组有5只小鼠颅底积血块,可能为蛛网膜下腔出血;ECA组次日死亡的1只小鼠也有此情况。术中死亡推测为麻药过量或神经损伤导致。
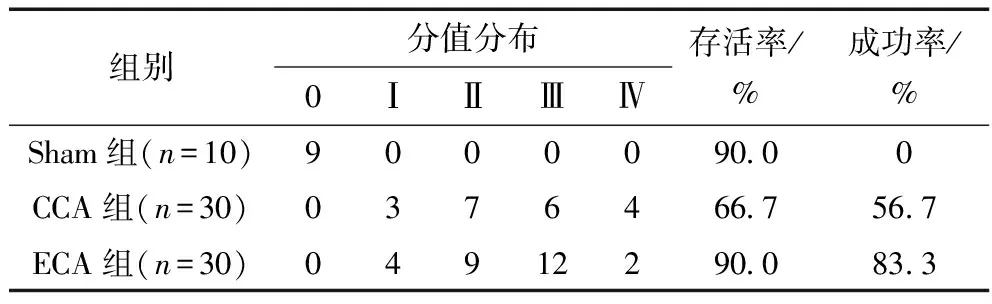
表1 小鼠模型神经功能评分及存活率
2.2 各组小鼠体重变化比较
术后24 h测量各组小鼠体重变化如图1所示,CCA进线组变化率为16.9%±0.9%,ECA进线组变化率为19.0%±1.2%,各组间均有差异。从上述结果可以看出,24 h体重变化率ECA进线组大于CCA进线组(P<0.05)。

图1 各组小鼠模型术前后体重变化率
2.3 各组小鼠脑梗死体积及稳定性的比较
脑梗死体积稳定性是判断模型稳定性的方法之一,皮层和网状体同时出现梗死灶为成功标志。术后24 h后,TTC染色结果如图2所示,梗死体积统计结果如图3所示。CCA进线组梗死体积百分比为37.20%±3.89%,ECA进线组梗死体积为33.20%±1.30%,两组差异不显著(P=0.057,P>0.05)。
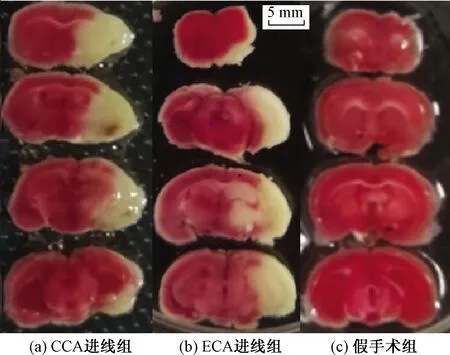
图2 各组小鼠脑组织TTC染色结果
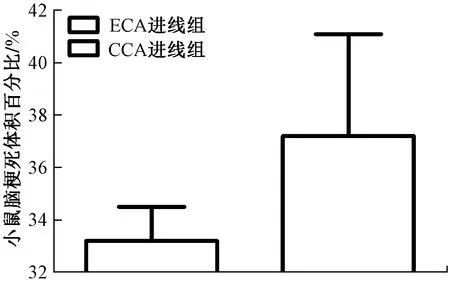
图3 各组小鼠脑梗死体积百分比
2.4 各组脑片苏木素/伊红染色病理学检测比较
脑片经苏木素/伊红染色如图4所示,在光学显微镜下可见,正常小鼠大脑皮层细胞大小一致,胞质均匀,胞膜清晰且完整。ECA组与CCA组模型小鼠梗死部位大脑皮层,细胞结构不完整,甚至完全消失,细胞出现空泡样改变,细胞间连接呈网状改变。

图4 小鼠大脑皮层HE染色结果
3 讨论与分析
脑血管病已成为中国各类疾病致死的第一病因,尤以缺血性脑卒中占绝大多数[13]。因此,如何建立一个稳定性高、操作简易的动物模型对脑血管病分子机制的研究备受关注。但由于小鼠脑血管侧枝循环比较多,大大影响了模型的成功率及稳定性,故诸多学者致力于改进方法的研究[14-15]。
利用线栓法制作大脑中动脉栓塞模型是研究脑缺血疾病重要依托,随着生命科学的发展,小鼠已经成为目前研究的热点[16]。建立稳定的小鼠缺血模型,对研究脑血管病的发生、发展机制的研究至关重要。Longa线栓法有点颇多,术中对动物的血压、体温等影响较小,且稳定性强,重复性好,被广泛应用[17-18]。
研究发现,ECA进线组与CCA进线组相比较,前者能够提高MCAO/R模型的生存率和成功率且脑梗死体积同样稳定,神经功能评分及TTC染色结果支持此研究结果。线栓法制作缺血模型,主要有两种进栓方式,一种是直接从颈总动脉经颈内动脉入颅,另一种是从颈外动脉经颈内动脉入颅。对这两种进栓方式进行了比较,CCA进线组模型采用前一种线栓插入方式,此方式操作方便,省去了剪断和电凝ECA残端这一过程,但再灌注时拔出线栓后需将颈总动脉结扎,通过前后交通动脉实现再灌注,导致再灌注血流是非正常生理性的;ECA进线组线栓插入方式采用后者,除了分离颈内动脉还需进一步分离颈外动脉,但去除线栓实现再灌注后可以电凝颈外动脉残端,进而实现四条供应脑组织血流的动脉完全再通,保证了颈总动脉的完整性,以减轻对小鼠造成的创伤,更加接近生理性再通,提高了模型小鼠的成功率和术后存活率。小鼠术后24 h体重变化率提示,ECA进线组较CCA进线组及假手术组相比体重变化更高,这可能是ECA进线组在拔出线栓实现再灌注时因未结扎颈内动脉导致出血造成的差异,但体重的变化并未影响小鼠的存活率。传统方法选择结扎PPA,研究也在前期尝试结扎了PPA,但因PPA位置较深,操作费力耗时,增加对小鼠的额外损伤,也存在血栓风险,很多实验也已不再结扎PPA[14],故正式实验时未采用。
线栓的制备是模型成功的关键,Longe法[5]选择将线栓头部用火焰烧成圆形,起到使线栓头部光滑不宜戳破血管和增大直径使大脑中动脉完全堵塞的作用。但经过前期尝试发现此种线栓处理方式不能保证每根线栓头部直径一致,增加了不稳定因素。而且由于鱼线头部没有弹性,很难稳定实现完全阻塞血流,直径过大不易进入颅内深部血管增加血管破裂风险,直径过小起不到完全阻断血流的效果。还有的研究使用石蜡包被鱼线,因石蜡包被易操作、耗时短、性质稳定不易与血液成分反应,而且石蜡表面光滑,不易损伤血管壁。但经前期实验发现在鱼线误入PPA反复抽拉鱼线时,鱼线头部包被的石蜡易脱落,反而增加栓塞风险;硅胶线栓头部包裹硅胶,直径使线栓直径增大有弹性且光滑,当线栓向深部走行至较细血管时即不会撑破血管又可有效阻断血流,同一批次的硅胶线栓可以保证直径一致。故研究采用硅胶线栓,提高了模型成功率。
实验动物的性别、体重对模型的成功也有影响,有研究发现雌激素对缺血大脑具有保护作用雄性动物大脑对缺血缺氧敏感性高于雌性动物[18],故实验采用雄性小鼠;前期实验发现体重大于35 g的小鼠造模生存率高,但TTC染色结果梗死灶却不明显,可能是体重大的小鼠血管也相应变粗,导致线栓不能完全阻塞大脑中动脉的原因。体重小于25 g的小鼠因血管太细线栓插入困难,导致模型失败。因组内小鼠体重差异越小越有利于减少实验误差,故实验采用25~30 g的小鼠,提高了模型成功率。
对水合氯醛的浓度也进行了摸索,水合氯醛是动物实验中常用的麻醉药之一,常选用的剂量为10%,0.3~0.4 mL/100 g[14-15,19],有研究建议C57BL/6雄性小鼠的手术造模实验水合氯醛按5%,0.1 mL/10 g给药[19],在实验过程中发现采用4%水合氯醛比5%和10%水合氯醛安全且同样有效麻醉,能减少小鼠术中死亡例数,提高了小鼠的存活率。
实验的不足是未进行长期的术后观察,如因CCA结扎与否是否影响了术后进食,不能得出两组模型小鼠术后长期生存率是否依旧存在差异。但研究结果提示经ECA进线方式与经CCA进线方式相比,在脑梗死体积同样稳定的情况下,经ECA进线的方法提高了术后24 h模型小鼠的成功率和生存率,有利于相关动物实验的开展。
