褪黑素对热打击后人脐静脉内皮细胞凋亡的保护作用*
2021-08-20古正涛吴启华邹志敏
龚 健,古正涛,李 莉,吴启华,方 杨,邹志敏,苏 磊
(1.深圳市龙岗区第三人民医院重症医学科,深圳 518115;2.南方医科大学第三附属医院创伤救治中心、广东省休克微循环重点实验室,广州 510630;3.南部战区总医院重症医学科、全军热区创伤救治与组织修复重点实验室,广州 510010)
中暑是发生在我国南方夏季常见的疾病,重症中暑往往会给人们的健康造成严重的危害。目前全球气温日益变暖,其发病率亦有逐渐增加的趋势[1]。重症中暑不断研究发现对于各类严重并发症而言,如多器官功能障碍综合征(MODS),血管内皮细胞(VECs)出现结构或是功能方面的受损是其十分关键的影响因素[2]。随着对重症中暑机制的深入认识,凋亡的作用受到越来越多的重视,已有研究证实热暴露后可诱导机体内发生大量的细胞凋亡[3-4]。褪黑素(Melatonin)是一种影响生物昼夜的激素,具有多种生物学功能,包括抗氧化[4-6]、抗炎[7-8]和抗凋亡[9]。本研究通过观察褪黑素对热打击后内皮细胞凋亡所产生的作用,探讨褪黑素在中暑救治中的作用及意义。
1 材料与方法
1.1 主要试剂和仪器 褪黑素、钙黄绿素(Calcein)购于MCE公司;胎牛血清、PBS以及DMEM高糖培养基购于Gibco 公司;胰蛋白酶购于Solarbio 公司;CCK-8、Caspase、线粒体膜电位检测(JC-1)等检测试剂盒购于Beyotime公司;Annexin V-FITC/PI细胞凋亡试剂盒产品购于BD 公司;激光扫描共聚焦显微镜LSM800(Carl Zeiss 公司);酶标仪(Thermo Fisher MK3);流式细胞仪(BD公司);恒温水浴锅(苏珀仪器有限公司);人脐静脉内皮细胞(HUVECs)购于中国科学院上海生命科学研究院细胞资源中心。
1.2 细胞分组及热打击 实验一分组:褪黑素0µmol/L、1µmol/L、5µmol/L、10µmol/L、20µmol/L预处理人脐细胞12 h,分37 ℃常温组及43 ℃热打击组。实验二分组:根据实验一结果选出显著有效的最低剂量作为本实验褪黑素的实验剂量,进行分组,包括43 ℃组、43 ℃+褪黑素(43 ℃+Mel)组、37 ℃+褪黑素(37 ℃+Mel)组以及37 ℃组。HUVECs置于细胞培养皿中备用,密度为1.0×105/mL。在进行热打击时,先在恒温水浴锅(温度43 ℃)内放置细胞,然后进行时长为2 h 的热打击,接着进行6 h 的常规培养(条件为含有5%的CO2,温度为37 ℃)[10-11]。
1.3 CCK-8 检测进行细胞活力 收集对数生长期的HUVECs,然后在96 孔板里进行接种(10 000 个/孔),当细胞已经稳定地贴壁之后,再进行分组。将CCK-8溶液(10 μL)添加到各个孔中,通过酶标仪测量450 nm位置的吸光度值。计算细胞存活率,细胞活力(%)=(处理组-空培组)/(阴性对照组-空培组)×100%;阴性对照组:有培养基、CCK-8溶液和细胞的孔的吸光度,空培组:有培养基和CCK-8 溶液而无细胞的孔的吸光度。
1.4 Annexinv-FITC流式细胞仪检测细胞凋亡
将细胞消化收集起来,置于1.5 mL EP 管中离心5 min 弃上清;加入1 mL PBS 轻轻震荡清洗细胞2 次,再次离心5 min 弃上清,加入binding bufferv-FITC检测200 μL轻轻悬浮细胞后加入5 μL Annexin V/FITC 室温避光孵育15~30 min,每隔10 min 轻弹细胞几下,再加入200 μL binding buffer 溶液+5 μL 的PI 溶液室温避光5 min,把孵育好的样品移至流式管中进行流式细胞仪分析。流式细胞仪测量发射波长Em=530 nm;激发波长Ex=488 nm。
1.5 线粒体膜电位(ΔΨm)检测 调整待测细胞的浓度为5×105个/mL左右,进行分组处理。按比例混合JC-1 200X 和超纯水配制工作液,再加入规定比例的5x JC-1 染色缓冲液,使最终工作液浓度为5~10 µmol/Lol/L。弃去原有的培养基用JC-1 染色缓冲液冲洗2次,添加JC-1染色工作液1 mL并混合均匀,37 ℃的培养箱里面孵育30 min。孵育结束后离心3~4 min 沉淀细胞,丢弃上清液之后使用JC-1 染色缓冲液冲洗2次,加入0.5 mL JC-1染色缓冲液洗涤重悬细胞置放冰上,流式细胞仪分析。JC-1在低浓度的时候以单体的形式存在,看到绿色的荧光显示。在高浓度的时候的存在形式是多聚体,看到红色的荧光显示。
1.6 线粒体通透性转换孔(MPTP)检测 细胞分组处理后用胰酶消化,DMEM 培养液重悬,取适量细胞离心5 min,弃上清,加入终浓度为1 µmol/L 的Calcein AM、1µmol/L CoCl2的染色工作液重悬,使细胞为单细胞悬液,且细胞密度为1×106/mL,37 ℃避光孵育30 min,离心5 min 收集细胞。每个样品加入1 mL DMEM 重悬,离心5min 收集细胞。用400 μL DMEM重悬细胞,染色后流式细胞仪检测和分析。
1.7 Caspase活性检测 细胞分组处理后在4 ℃的条件下进行5 min 的离心操作,采集细胞,吸除上清,使用PBS 冲洗1 次,依照每两百万细胞添加100 μL 裂解液的关系添加裂解液,冰浴裂解15 min,4 ℃离心10~15 min,将上清液移入冰浴预冷的离心管里面。Caspase-3 活性检测:40 μL 检测缓冲液与50 μL 待测样品/50 μL 裂解液混匀,再加10 μL Ac-DEVD-pNA(2 mmol/L),37 ℃孵120 min;Caspase-9 活性检测:40 μL 检测缓冲液与50 μL 待测样品/50 μL 裂解液混匀,再加10 μL Ac-LEHDpNA(2 mmol/L),37 ℃孵育120 min。用酶标仪测定A405,样品A405 去除空白对照A405,就是caspase催化得到的pNA吸光度。
1.8 统计学方法 采用SPSS 22.0统计软件对数据进行统计分析,计量资料采用均数±标准差()表示,每个实验至少重复3 次。方差齐时应用单因素方差分析(one-wayANOVA),组间比较采用LSD-t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 褪黑素对热打击HUVECs活力的作用 褪黑素0µmol/L、1µmol/L、5µmol/L、10µmol/L、20µmol/L对37 ℃的HUVECs 活力均无影响(P>0.05),见图1a。与褪黑素0µmol/L比较,5µmol/L能增加43 ℃热打击HUVECs 的活力(P<0.05),10µmol/L、20µmol/L显著增加43 ℃热打击HUVECs的活力(P<0.01),见图1b。提示10µmol/L褪黑素对热打击HUVECs细胞活力有显著性提高,将该剂量用于实验二。10µmol/L褪黑素能恢复43 ℃热打击HUVECs的活力,43 ℃+Mel 组与37 ℃组和43 ℃组均有显著性差异(P<0.05),见图1c。
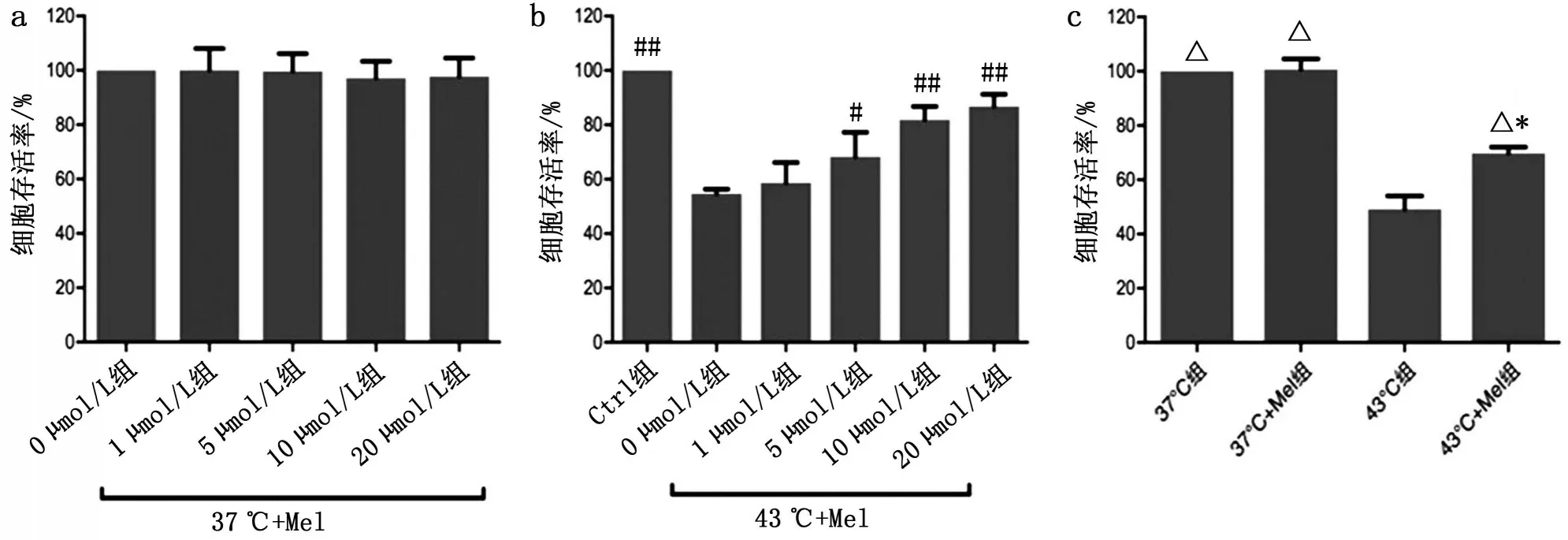
图1 褪黑素对热打击HUVECs活力的作用
2.2 褪黑素对热打击HUVECs 凋亡的作用 与37 ℃组相比,37 ℃+Mel 组细胞凋亡无统计学意义(P>0.05);与43 ℃组比较,43 ℃+Mel 组细胞凋亡减少(P<0.05);与37 ℃组、37 ℃+Mel组比较,43 ℃组细胞凋亡增多(P<0.05),见图2。

图2 褪黑素对热打击HUVECs凋亡的作用
2.3 褪黑素对于热打击HUVECs 线粒体膜电位的作用 与37 ℃组相比,37 ℃+Mel 组JC-1 单位占比差异无统计学意义(P>0.05);与43 ℃组比较,43 ℃+Mel组JC-1单体占比降低(P<0.05);与37 ℃组、37 ℃+Mel 组比较,43 ℃组JC-1 单体占比增高(P<0.05),见图3。
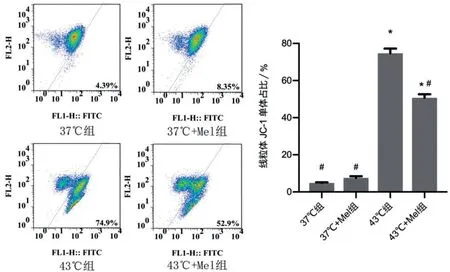
图3 褪黑素对热打击HUVECs线粒体膜电位(JC-1单体占比)的作用
2.4 褪黑素对热打击HUVECs MPTP 的作用 与37 ℃组相比,37 ℃+Mel 组钙黄绿素平均荧光强度差异无统计学意义(P>0.05);与43 ℃组比较,43 ℃+Mel 组钙黄绿素平均荧光强度增加(P<0.05);与37 ℃组、37 ℃+Mel组比较,43 ℃组钙黄绿素平均荧光强度降低(P<0.05),见图4。
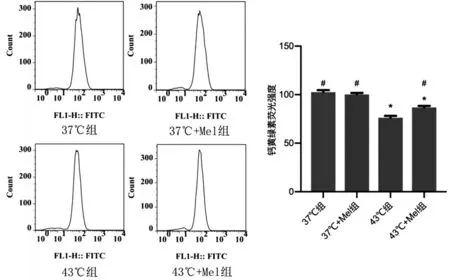
图4 褪黑素对热打击HUVECs MPTP的作用
2.5 褪黑素对热打击HUVECs caspase-3/9活性的作用 与37 ℃组相比,37 ℃+Mel 组caspase-3/9 活性差异无统计学意义(P>0.05);与43 ℃组比较,43 ℃+Mel 组caspase-3/9 活性降低(P<0.05);43 ℃组与37 ℃组、37 ℃+Mel组比较,caspase-3/9活性增高(P<0.05),见图5。
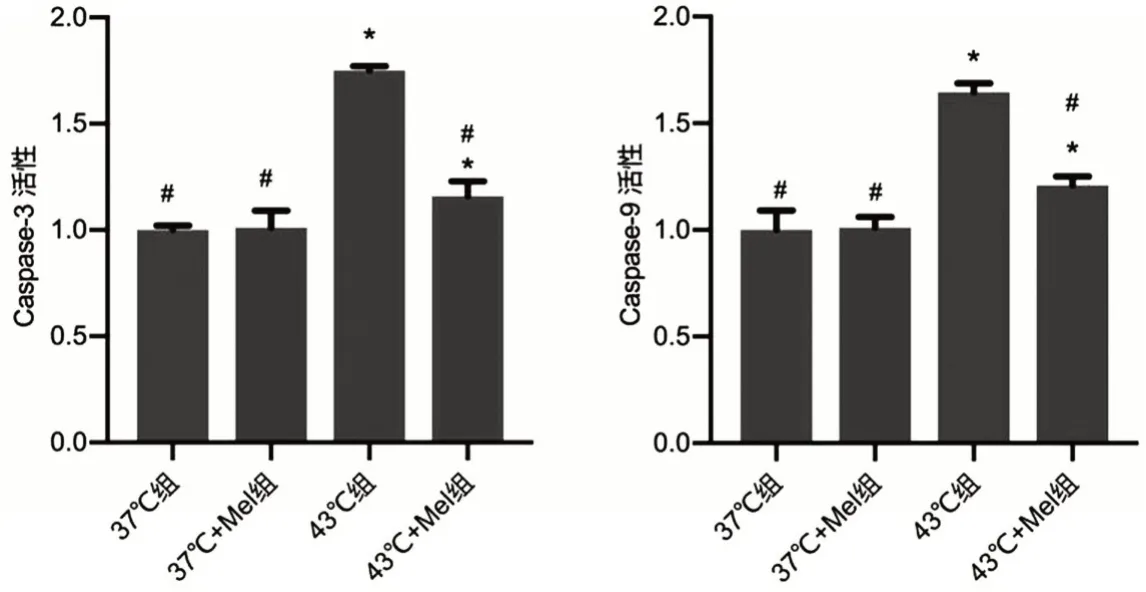
图5 褪黑素对热打击HUVECs中caspase-3/9活性的作用
3 讨论
在中暑的发病过程中,热是环境致使中暑发生最常见的诱因,会影响机体细胞的结构和功能。热打击可激活线粒体途径人脐静脉内皮细胞的早期凋亡[11]、可引起神经元细胞[12]、骨骼肌细胞的凋亡[13]。许多的研究数据显示,细胞凋亡可能在中暑的发病机制中起了重要作用。目前认为细胞凋亡主要有内源性、外源性以及内质网3条转导途径,其中外源性途径也叫做死亡受体途径;内源性途径也叫做线粒体途径[14]。线粒体凋亡通路是细胞凋亡的主要途径之一。研究证实,几乎所有的细胞凋亡中均存在细胞跨膜电位(△Ψm)下降。凋亡细胞△Ψm 的下降源于线粒体膜通透性(PT)的改变,PT 的改变受MPTP的调控[15]。许多凋亡信号可以诱导线粒体释放细胞色素-C,继而激活了起始Caspase-9,活化的Caspase-9 进一步剪切激活下游效应Caspase-3、Caspase-6、Caspase-7,提示Caspase-9是被线粒体凋亡通路所激活[16]。
松果体是人体主要产生褪黑素的组织,但褪黑素也同时存在于其它组织和器官中,例如皮肤、视网膜、造血细胞、睾丸、胃肠道等[17]。有研究显示,褪黑素具有缓解失眠、调整飞行时差、调节昼夜节律的功能[18]。深入研究后褪黑素越来越多的作用被了解,褪黑素还有它的代谢物具有广范抗氧化和清除自由基的作用,并且可以于各种生理病理状况之下调节很多种类的分子途径,如凋亡、炎症、增殖等[19]。大量研究表明,褪黑素具有显著的抗凋亡作用,可以直接对于MPTP开放起到限制的作用,进而防止细胞凋亡发生[20]。又有研究发现,体外模型中高浓度使用褪黑素会产生促氧化、促凋亡作用。褪黑素在不同细胞的研究中发现,在肿瘤细胞中起促凋亡作用,而正常细胞中起抗凋亡作用[21]。
为探究褪黑素对热打击之后的内皮细胞凋亡有无保护效果,首先需要确定褪黑素的实验剂量,选取不同浓度的褪黑素预处理HUVECs,结果显示1~20µmol/L的褪黑素对37 ℃组HUVECs活力均无影响,43 ℃组热打击后HUVECs活力随着褪黑素浓度的增加而逐渐恢复。进一步实验采用了显著有效的最低剂量,10µmol/L 褪黑素预处理HUVECs,结果表明使用褪黑素10µmol/L 预处理之后的HUVECs 在遇到43 ℃的热打击时,细胞活力能得以保持,细胞凋亡明显减少,提示热打击使HUVECs 的凋亡增多,而褪黑素能降低热打击后HUVECs的凋亡。同时线粒体膜电位降低的细胞比例(JC-1 单体比例)显著降低,表明热打击会致使HUVECs线粒体膜电位降低,而褪黑素能有助于热打击后HUVECs线粒体膜电位的稳定。43 ℃热打击会导致HUVECs 的MPTP 一直处于开放状态,通过褪黑素预处理之后发现热打击细胞里面的钙黄绿素平均荧光强度显著增加,提示褪黑素有助于减少热打击之后HUVECs 的MPTP开放减少。同时,热打击导致HUVECs 内caspase-3/9 的活性明显增高,激活了由其介导的线粒体凋亡途径,而经褪黑素预处理后caspase-3/9 释放减少,提示褪黑素能抑制由其介导的线粒体途径凋亡。
综上,褪黑素对被热打击的内皮细胞凋亡具有保护作用,其机制可能为通过抑制caspase-3/9 介导线粒体途径,使内皮细胞的线粒体膜电位及线粒体渗透性转换孔的稳定。褪黑素在热打击过程中可减少细胞凋亡并保护线粒体的作用,为临床上重症中暑的救治提供实验根据。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- CTRP3 alleviates OGD/R-induced myocardial cell injury by activating the SIRT1/FoxO3a pathway
- 舒尼替尼通过调控lncRNA ROR/miR-670-3p/MARCH5轴对胃癌细胞增殖和凋亡的影响*
- LncRNA SNHG7靶向调节miR-146a-5p对胃癌细胞增殖、迁移、侵袭和细胞凋亡的影响*
- 高糖通过上调E2F1的表达促进肝癌细胞的侵袭和转移*
- lncRNA GABPB1-IT1靶向下调miR-501抑制宫颈癌细胞增殖、侵袭和迁移的机制*
- 姜黄素通过调控miR-152对甲状腺癌细胞TPC-1增殖、凋亡、迁移和侵袭的影响*
