广西地区食管鳞状细胞癌热点基因突变谱分析*
2021-08-20王守峰吴俊伟苏刘福叶甲舟
王守峰,吴俊伟,苏刘福,叶甲舟
(广西壮族自治区肿瘤医院,南宁 530021)
食管癌(sophageal cancer,EC)在全球所有类型的癌症中的发病率为第7 位,患者的存活率低。在中国,食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)占EC 患者的95%以上。由于对于ESCC 的早期检测没有敏感的方法,所以被诊断时,大部分EC患者已经处于疾病晚期,且这些患者在诊断时有超过一半发生了癌细胞转移。因此,对于早期ESCC的预测和治疗非常重要[1]。然而,目前暂无有效的治疗方法,放、化疗是唯一的治疗选择。肿瘤靶向药物是近年来治疗的主要趋势,通过选择性作用突变蛋白或基因,有针对性地抑制癌细胞,几乎不影响正常细胞,具有“高效低毒”的特点。然而,靶向药的应用前提需要明确患者具体突变类型,以判断患者能否从中获益。同时,由于缺少肿瘤中基因突变的具体信息,针对某类肿瘤药物的靶向药物开发也会陷入困扰[2]。高通量测序能够同时检测多个基因多位点突变,融合基因,基因拷贝数变化,基因缺失/扩增等功能,已逐渐被运用在指导晚期癌症的用药中[3]。研究表明,针对患者具体的靶点选择合适的新辅助化疗手段,已被证明可提高对卵巢癌[4]、HER2 阳性乳腺癌[5]等的治疗效果。本研究将利用高通量测序分析ESCC样本的热点基因突变情况,分析主要突变位点、突变类型和频率,为寻找ESCC 的生物标志物以及潜在药物作用靶标提供基础。
1 对象与方法
1.1 研究对象 收集2020年1~12月就诊于广西壮族自治区肿瘤医院的65例ESCC患者的肿瘤组织,其中女24 例,男41 例,年龄30~75 岁,平均(55.26±8.6)岁,且排除其它肿瘤。本研究经医院医学伦理委员会批准,研究对象签署知情同意书。
1.2 DNA 的提取和文库的准备 使用QIAamp DNA 的FFPE 组织试剂盒(德国Qiagen,Hilden)提取DNA。使用Qubitds DNA HS 检测试剂盒和Qubit 3.0 测度计(Life Technologies,Eugene,Oregon,USA)定量DNA。按照Illumina 标准库建设说明构建顺序库(Illumina,Inc,美国加利福尼亚州)。根据制造商提供的方法,文库构建的最佳DNA 为20 ng(1.67 ng/μL),最小DNA为5 ng(0.41 ng/μL)。每个文库都使用KAPA SYBR®FAST 通用qPCR 工具包进行量化。
1.3 样本分析将样本送至至本医疗科技公司进行溯系列分析(Illumina 高通量测序平台),根据操作流程进行超深度测序(平均测序深度大于500×),共检测638 个癌症相关基因的全部外显子,63 个基因的部分内含子,鉴定不同类型的基因变异,如单核苷酸变异、插入或缺失、拷贝数变异和重排。
1.4 统计学方法 采用GraphPad Prism 8.0 与SPSS 19.0 统计软件进行数据分析,计量资料以均数±标准差()表示,多组间比较采用方差分析;计数资料以百分率(%)表示,组间比较采用χ²检验,以P<0.05为差异有统计学意义。
2 结果
2.1 ESCC患者不同年龄段人数统计 通过统计患者年龄、性别和发病率,本研究其中男患者分布:30~39岁,3例;40~49岁,5例;50~59岁,20例;60~69岁,11 例;70-75 岁,2 例。女患者:30~39 岁,1 例;40~49岁,3例;50~59岁,12例;60~69岁,7例;70~75岁,1 例。患者年龄主要集中于50~69 岁,男患者与女患者在此年龄段的比例分别为75.61%和79.17%。
2.2 ESCC高频突变基因 根据检测结果统计突变率(图1),突变率排名前10 的基因分别为TP53(90.77%)、CCND1(53.85%)、FGF19(52.31%)、FGF3(50.77%)、FGF4(50.77%)、CDKN2A(32.31%)、KMT2D(21.54%)、NOTCH1(21.54%)、TP63(20%)、ZNF750(18.46%)、LRP1B(18.46%)。
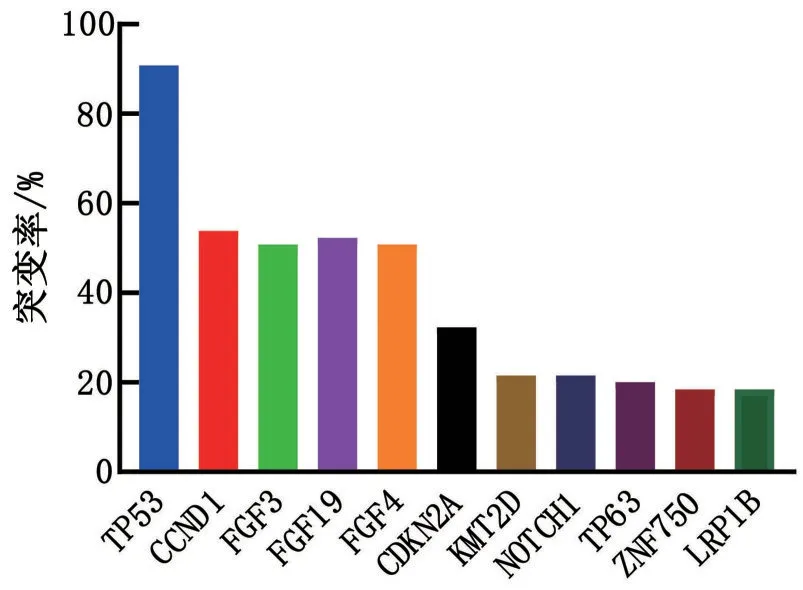
图1 ESCC中突变率前10的基因及各自的突变率
2.3 不同类型的突变在65例中的分布情况 从本研究的65 个患者基因突变类型(alternation type)分析中可以得出,92.31%(60/65)发生了拷贝数改变(copy number change)。而这60 个发生拷贝数改变(copy number change)的人中,绝大多数,即93.33%(59/60)发生了基因扩增(gene amplification),23.33%(14/60)发生了基因缺失(gene deletion),且以上同时发生了基因扩增和缺失的占23.33%(14/60)。
65例患者都发生了短变体(short variants),且都伴随着替换(substitution)。53.85%(35/65)发生在chr17(17 号染色体),其次为chr2,52.31%(34/65),chr1,chr9,chr12,chr8,chr3,chr4,chr19 和chr11 的突变率也呈现较为集中的分布。这65例中,83.08%(54/65)发生了截断突变(truncation),也以chr17上最多,占57.41%(31/54),但是具体突变的点分布均匀,未见集中改变的碱基位点。除了这2类主要的突变类型,38.46%(25/65)发生了较长片段的插入与缺失(indel,insertion 和deletion 的简称);30.77%(20/65)发生了重新排列(rearrangement),见图2~图4。
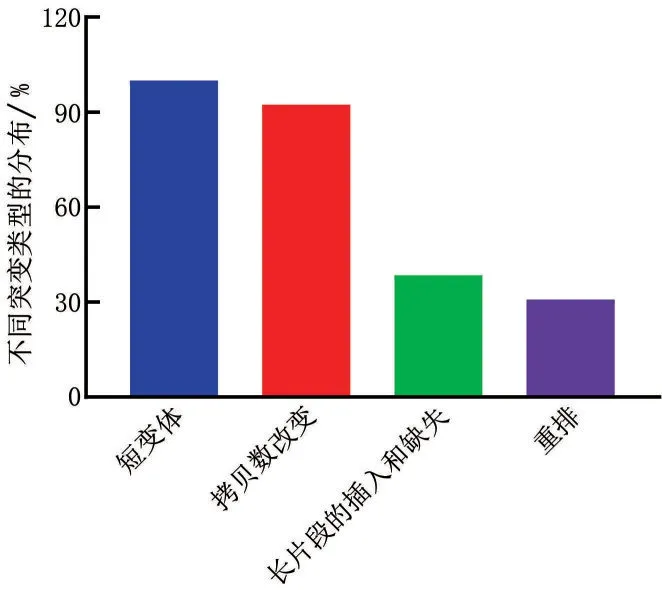
图2 基因突变类型及在样本中的突变分布
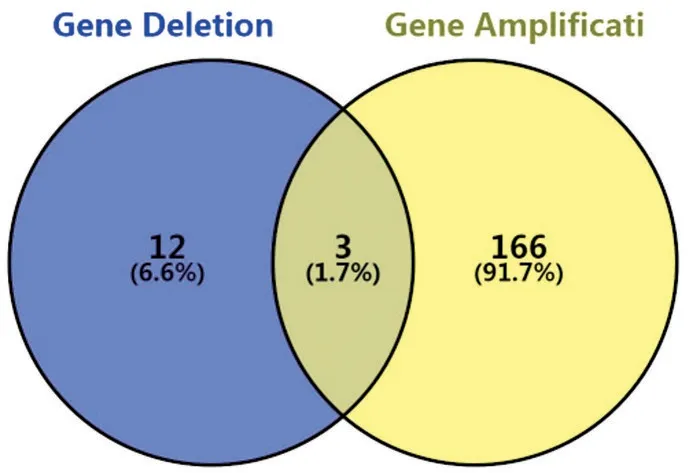
图3 发生拷贝数变异的细分类型及分布
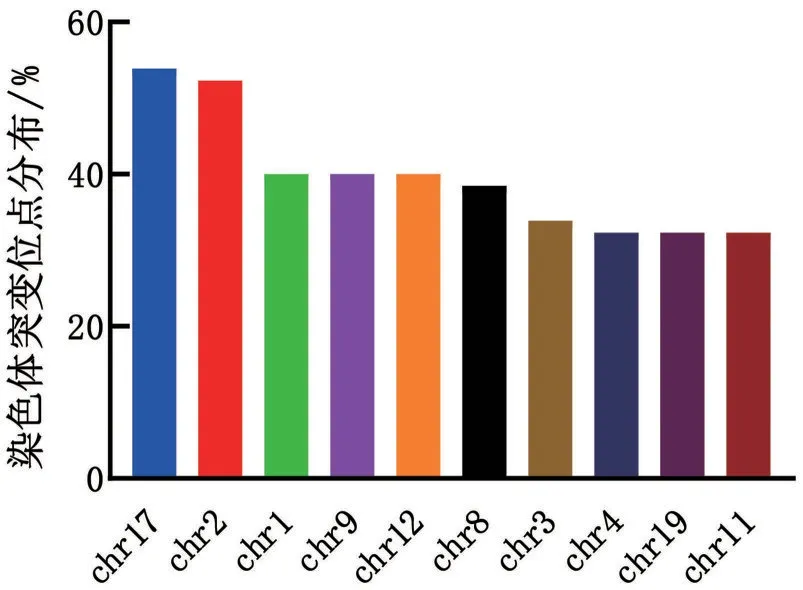
图4 ESCC患者不同染色体基因突变分布
2.4 高频突变基因的主要突变类型和位点 TP53的突变与多种癌症有关。针对TP53 突变的患者进行分析发现,59 例发生了该突变的患者中,突变类型(alternation type)皆为短变体(short variants),主要为截断突变(truncation)(44.07%,26/59)和替换(substitution)(45.76%,27/59),皆位于chr17 染色体。进一步分析发现,这27个替换样本中,40.74%(11/27)发生基因组DNA 变化。基因组DNA 中,碱基被替换成A 是主要变化,而Coding DNA 中的碱基替换成T是主要变化,见表1。

表1 TP53突变位点信息
针对CCND1 的突变进行分析发现,35 个CCND1突变的患者中,其主要是突变类型为拷贝数变化,97.14%(34/35)的该突变的患者发生基因扩增,无突变位点信息。针对FGF3 突变类型进行分析,发现96.76%(32/33)发生了拷贝数改变(基因扩增)。同样分析FGF19,97.06%(33/34)发生了拷贝数改变(基因扩增),FGF4 突变中94.76%(32/33)发生了拷贝数改变(基因扩增)。分析CDK2A突变发现,其主要发生了拷贝数改变(基因扩增),无具体突变位点。
CDKN2A的突变位点分析结果显示,该位点的突变位于chr9 上(表2),突变位点无聚集性。KMT2D 的突变位点分析结果显示,其主要为G/C碱基被替换(表3)。NOTCH1突变信息显示其主要突变为G/C碱基被替换成A/T(表4)。ZNF750突变信息无集中突变类型和位点(表4),LRP1B 突变信息显示主要突变为G/C碱基被替换成A/T(表5)。

表2 CDKN2A突变位点

表3 KMT2D突变信息

表4 NOTCH1突变信息
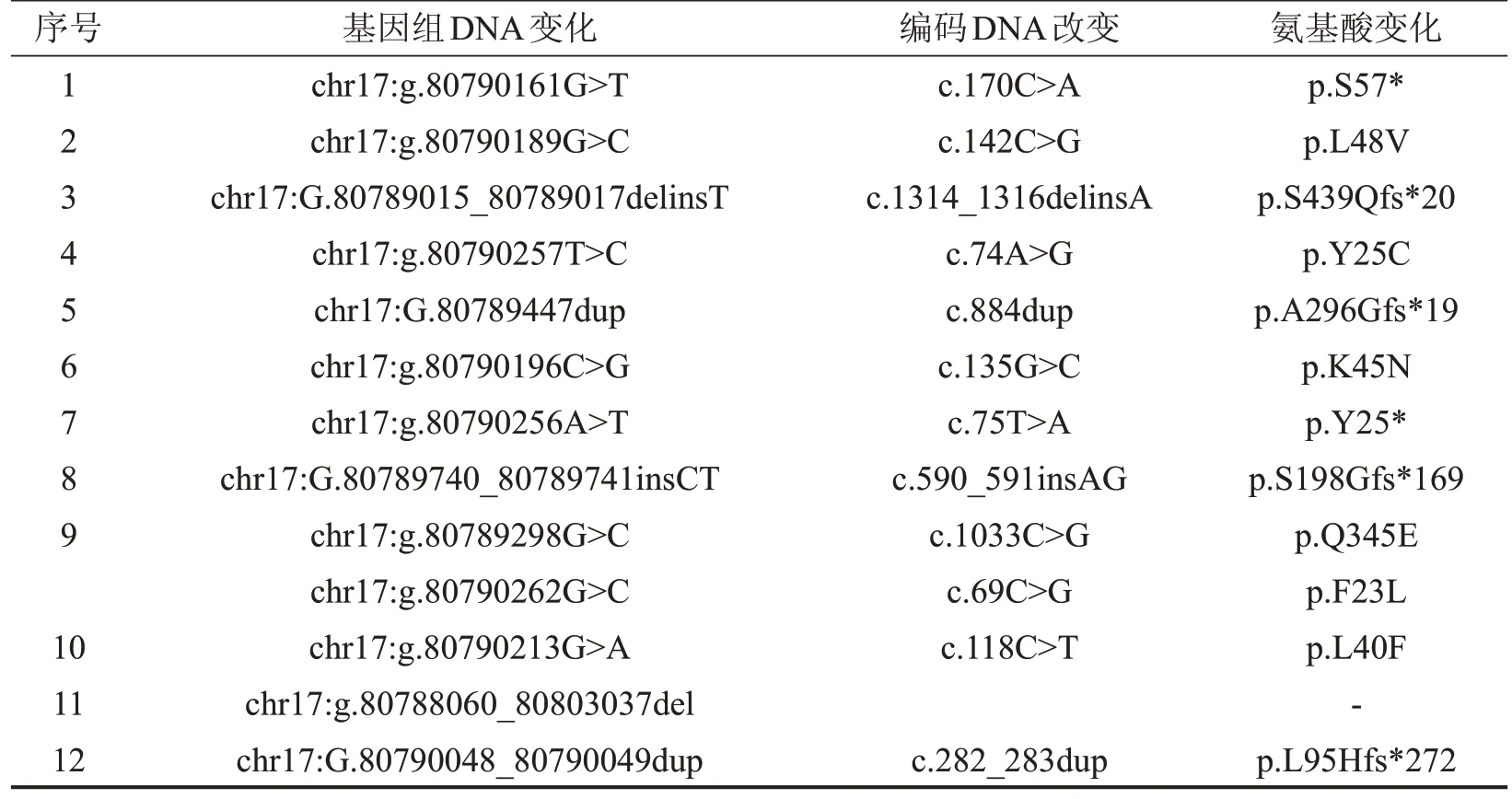
表5 ZNF750突变信息
2.5 ESCC 靶点预测 将前10 个高突变基因进行STRING分析,结果显示TP53,NOTCH1,CCND1之间存在关联。其中NOTCH1和TP63为表皮细胞调控的关键蛋白(红球),NOTCH1 和FGF4(蓝球)是细胞凋亡过程中的关键蛋白。表明ESCC的发生与NOTCH1/TP63或NOTCH1/FGF4通路相关。见图5。
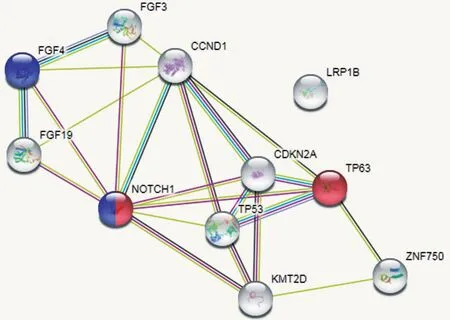
图5 STRING分析结果

表6 LRP1B突变信息
3 讨论
EC在全世界的发病率呈逐年上升的趋势,且与地理位置及饮食习惯有关,我国46%的EC 死亡可归因于吸烟和酒精摄入,且男女患者的比例接近[6]。近年来,ESCC 的治疗效果一直不尽人意,主要原因与诊断较晚,远处转移,治疗耐药,肿瘤异质性和复发有关。目前ESCC缺乏高效的靶向治疗药物[7],派姆单抗和尼鲁单抗(pembrolizumab and nivolumab)现在已被批准用于食管鳞癌,但需要更多的数据来了解这些药物如何在非转移性环境中使用。由于整体预后不佳,仍需要新的治疗方法[8]。现有的方法包括癌症疫苗和免疫检查点抑制剂[9],以及以NRF2 等信号通路为靶标的药物治疗[10],放射治疗等[11]。但由于地域不同,基因的突变类型往往也存在差异,传统的候选基因法建立在假说之上,需要进行功能验证,且通量低,无法鉴定出未知的变异位点,因此需要更加全面、高通量的测序方法选择靶点。
随着第二代测序技术的发展,关于EC 基因层面的研究也随之深入[12]。其中,Salem 等[13]揭示了225例中国河北地区患者的ESCC突变情况,发现该地区ESCC 患者中最常见的突变基因是TP53(96%)、CCND1(46%)、FGF4(44%)、FGF19(44%)、FGF3(44%)、CDKN2A(31%)、PIK3CA(26%)、NOTCH1(24%)、KMT2D(18%)、FAT1(16%)和LRP1B(16%),FGFR1 在ESCC 中扩增明显更多。并揭示了中国ESCC 患者的潜在预后生物标志物。临床靶基因分析表明,近一半的中国ESCC 患者可能会受益于基因特异性靶标药物的治疗[14]。而Song 等[15]的研究发现,广东省潮汕地区ESCC 患者中TP53、RB1、CDKN2A、PIK3CA、NOTCH1 和NFE2L2 为突变率最高的基因。因此,分析不同地区ESCC 的基因突变差异,并进一步阐明ESCC 的分子机制,对于制定更好的预防和治疗策略是非常有必要的。
分析以上研究不难发现,肿瘤蛋白p53(TP53)是ESCC 中最常见的突变基因。TP53 突变与高危疾病,对常规化疗的耐药性和预后不良有关[16]。p53在ESCC的诊断和治疗中都是一个有价值的分子靶标。本研究发现,ESCC发生的突变类型中TP53突变率最高,表明其在ESCC 的发生过程中发挥重要的作用。这与Gao 等[17]的研究结果一致,即EC 中,TP53 突变占主导,约为93%,其次为CCND1,占33%、CDKN2A 占20%。Kamata 等[18]用不同TP53突变的ESCC细胞株和两种p53靶向药物进行了细胞活力测定,发现两种细胞株的生长抑制存在差异。提示肿瘤对化合物的响应可能取决于TP53 突变类型,但仍有必要进一步研究TP53与其他基因的相互作用,以确定其作为治疗靶点的有效性。
NOTCH是指编码哺乳动物细胞中跨膜受体家族的一组基因,参与胚胎发育和正常细胞的生长调节、凋亡和分化。NOTCH1是Notch家族的成员,与许多与肿瘤发生有关的信号通路紧密相连。在啮齿动物和人类的正常食道中,NOTCH1 高度表达,在正常生理状态下,NOTCH 通路调控食管鳞状上皮的发育,特别是鳞状分化,对于维持鳞状上皮的完整性是必不可少的[19]。暴露于外在和内在因素,如胃食管反流、饮酒和炎症,都会下调NOTCH 通路,从而抑制食管鳞状上皮细胞的鳞状分化。在ESCC中,NOTCH信号通路具有抑癌和致癌的双重作用。可以通过多种方法来实现NOTCH1抑制,其中最常见的方法是产生泛NOTCH抑制作用的分泌酶抑制剂DAPT(GSI-IX),或者使用产生更特异的阻断作用的NOTCH1短干扰RNA或NOTCH1单克隆抗体。NOTCH1的下调可以单独使用,也可以与化学疗法联合使用,从而达到协同作用并降低耐药发生[20]。最近,Alvarez-Trotta 等[21]发现了一种小分子抑制剂NADI-351,能够选择性地破坏EC 细胞中NOTCH1转录,在小鼠模型中表现出强大的抗肿瘤活性,且不会引起肠道毒性。这为今后的研究提供了一定的参考。
本研究通过蛋白之间相互作用预测发现,NOTCH 突变可能和TP53 存在一定联系。研究表明,突变、缺失和扩增改变了TP53、NOTCH1、CDKN2A和CCND1等基因的正常功能,是促进食管黏膜上皮细胞向ESCC 转化的关键变化,这与本研究非常接近。Zhang等[14]研究中,河北地区ESCC患者的TP53、CCND1、FGF4、FGF19、FGF3、CDKN2A、NOTCH1、KMT2D 和LRP1B(排前10 的突变)也是较高的突变。不同的是,他们的研究中PIK3CA 和FAT1的突变率较高,而本研究中ZNF750和TP63相对较高,而Song 等[15]的研究发现,广东省潮汕地区ESCC患者中TP53、RB1、CDKN2A、PIK3CA、NOTCH1和NFE2L2(排名从高到低)为突变率最高的基因。表明不同区域ESCC 突变存在共性与差异。
对于NOTCH1 相关通路的预测发现,其在ESCC发生发展的过程中存在重要作用。正如Jia等[22]的研究发现,GASC1/NOTCH1 信号通路可能是治疗ESCC 患者的潜在治疗靶点。研究表明,NOTCH1 能够通过促进上皮-间质转化(EMT)和调节细胞周期来加速三阴性乳腺癌,抑制NOTCH1-ATR-CHK1 级联与顺铂协同杀伤TNBC,为这种致命疾病提供了有效的临床选择[23]。基于此,我们可以进一步研究其在ESCC的作用。
之前的研究已经提出了FGF19、FGF4、FGF3和CCND1在各种癌症中的重要作用[13,24-25]。在染色体不稳定的情况下发生的熔断桥循环扩增了CCND1[26]。CCND1 通常与其邻近的致癌基因CTTN 共同扩增,其产物促进ESCC 细胞的迁移[27]。此外,ESCC中的FGFR1、MYC、EGFR、KRAS、MDM2、TP63 和PRKC、SOX2 和PIK3CA、NKX2-1也都已被证实是ESCC 的驱动因素[1]。与之前的研究类似,本研究也观察到CCND1、FGF19、FGF3 和FGF4 的频繁扩增,这支持了ESCC 患者染色体11q13 不稳定的发生。EC 的发病机制涉及一个由多个因素和基因突变积累组成的级联过程。在其它研究中,与ESCC 相关高频突变基因的还包括PTEN、TOP2A、PIK3CA、XRCC1等[28]。
综上,本研究通过高通量测序展示了广西地区ESCC 高频突变基因和位点,提示不同区域之间高频突变基因存在差异,且我们预测NOTCH1 在ESCC 的发生过程中起到重要作用,可以作为进一步研究的方向。此外,本研究结果为基于广西地区ESCC的防治提供指导基础。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- CTRP3 alleviates OGD/R-induced myocardial cell injury by activating the SIRT1/FoxO3a pathway
- 舒尼替尼通过调控lncRNA ROR/miR-670-3p/MARCH5轴对胃癌细胞增殖和凋亡的影响*
- LncRNA SNHG7靶向调节miR-146a-5p对胃癌细胞增殖、迁移、侵袭和细胞凋亡的影响*
- 高糖通过上调E2F1的表达促进肝癌细胞的侵袭和转移*
- lncRNA GABPB1-IT1靶向下调miR-501抑制宫颈癌细胞增殖、侵袭和迁移的机制*
- 姜黄素通过调控miR-152对甲状腺癌细胞TPC-1增殖、凋亡、迁移和侵袭的影响*
