LncRNA DLX6-AS1调控miR-497/HMGA2对骨肉瘤细胞增殖和凋亡的影响*
2021-08-20徐德利
林 浩,徐德利
(华中科技大学协和东西湖医院 武汉市东西湖区人民医院骨科,武汉 430040)
骨肉瘤是一种常见的恶性程度高的原发性恶性肿瘤,大多数患者在确诊时已发生转移,因此患者预后差[1]。目前虽然一些化疗方案可提高骨肉瘤患者5 年生存率,但约一半的患者在术后或化疗药物治疗后出现耐受,且存在较高的转移复发风险。因此,寻找有效的骨肉瘤早期诊疗的方法尤为重要[2]。长链非编码RNA(lncRNA)是一类长度大于200 nt的非编码RNA,可通过表观遗传学、转录及转录后水平影响基因表达和翻译,进而参与肿瘤生长。近年来研究发现,多种肿瘤中lncRNA 表达异常,其异常表达与肿瘤发生发展密切相关[3-4]。lncRNA 无远端同源框6 反义1(DLX6-AS1)定位于7q21.3,目前在结肠癌、胃癌等多种肿瘤中有研究[5-6]。研究显示,lncRNA DLX6-AS1 可通过调节miR-641/HOXA9促进骨肉瘤细胞增殖及转移[7]。提示DLX6-AS1 可通过与微小RNA(miRNA)相互作用,miRNA又可调控下游靶蛋白从而影响骨肉瘤进展。miR-497是miRNA家族成员之一,在包括骨肉瘤在内的多种肿瘤中异常表达,影响肿瘤进展[8-9]。本研究旨在探讨lncRNA DLX6-AS1 调控miR-497/高迁移率族蛋白A2(HMGA2)分子轴对骨肉瘤MG63 细胞增殖、凋亡的影响,为DLX6-AS1/miR-497/HMGA2 作为骨肉瘤患者潜在的诊断标志物和治疗靶标提供实验依据。
1 材料与方法
1.1 主要试剂与仪器 胎牛血清购自杭州四季青公司;达尔伯克改良伊格尔培养基(DMEM)购自美国Hyclone公司;脂质体2000、Trizol均购自美国Invitrogen 公司;PCR 试剂盒及逆转录试剂盒均购自日本TAKARA公司;CCK-8试剂盒购自日本同仁化学研究所;细胞凋亡试剂盒、流式细胞仪均购自美国BD Biosciences 公司;RIPA 裂解液、苯甲基磺酰氟(PMSF)、二辛可宁酸(BCA)蛋白浓度分析试剂盒、增强化学发光(ECL)试剂均购自中国碧云天公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;增殖细胞核抗原(PCNA)、caspase3抗体均购自英国Abcam;酶标仪购自美国Biotek 公司;PCR仪购自美国Thermo公司。
1.2 细胞培养 人骨肉瘤细胞MG63 购自美国ATCC。MG63细胞用添加10%胎牛血清及1%青-链霉素的DMEM培养基,在5%CO2、37 ℃培养箱中培养。取对数生长期细胞用于实验。
1.3 细胞瞬时转染与分组 构建DLX6-AS1 特异性小干扰RNA(siRNA)(si-DLX6-AS1)及阴性对照(si-NC)、DLX6-AS1过表达载体(pcDNA3.1-DLX6-AS1)及空载体(pcDNA3.1)、miR-497 mimics/inhibitor 及相应对照miR-NC/anti-miR-NC 和HMGA2 过表达载体(pcDNA3.1-HMGA2)。转染前24 h,按1×104个/孔的细胞密度接种于6孔板,细胞融合度达到75%时进行细胞转染。将MG63细胞分为control组(未转染)、si-DLX6-AS1组(转染si-DLX6-AS1)、si-NC 组(转染si-NC)、pcDNA3.1-DLX6-AS1 组(转染pcDNA3.1-DLX6-AS1)、pcDNA3.1 组(转染pcDNA3.1)、miR-497 mimics组(转染miR-497 mimics)、anti-miR-497 组(转染miR-497 inhibitor)、miR-NC组(转染miR-NC)、anti-miR-NC 组(转染anti-miRNC)、si-DLX6-AS1+anti-miR-497 组(共转染si-DLX6-AS1+miR-497 inhibitor)和si-DLX6-AS1+HMGA2 组(共转染si-DLX6-AS1+pcDNA3.1-HMGA2)。细胞转染按照脂质体2000 说明书进行操作。
1.4 实时荧光定量PCR(qPCR)法检测DLX6-AS1、miR-497 和HMGA2 表达 Trizol 法提取细胞总RNA,NanoDrop检测提取的RNA浓度及纯度,逆转录为cDNA。按照PCR试剂盒说明设置反应体系为20 μL,其中逆转录产物2 μL,上、下游引物(10 μmol/L)各0.5 μL、10 μL SYBR Green Mix。反应条件为95 ℃5 min;95 ℃15 s,60 ℃1 min,共40 个循环。引物序列如下:DLX6-AS1 上游:5’-AGTTTCTCTCTAGATTGCCTT-3’,下游:5’-ATTGACATGTTAGTGCCCTT-3’;HMGA2 上游:5’-GCCAAGAGGCAGACCTAGGAAA-3’,下游:5’-CATGGCAATACAGAATAAGTGGTCA-3’;GAPDH 上 游:5’-AGCCACATCGCTCAGACAC-3’,下游:5’-GCCCAATACGACCAAATCC-3’;miR-497上游:5’-ACCAGCAGCACACTGTGGTTTGT-3’;下游:5’-ATCCAGTGCAGGGTCCGAGG-3’;U6上游:5’-CTCGCTTCGGCAGCACA-3’,下游:5’-AACGCTTCACGAATTTGCGT-3’。采用2-△△Ct法计算DLX6-AS1、miR-497和HMGA2表达。
1.5 CCK-8 法检测细胞增殖 按照5 000 个/孔均匀接种各组细胞于含有完全培养基的96孔板中,每孔100 μL,每组设置5个复孔。分别在培养24 h、48 h和72 h,每孔加入5 mg/mL的CCK8溶液10 μL,在培养箱中常规孵育2 h,用酶标仪检测490 nm 波长处各孔光密度(OD)值。OD值越大,细胞增殖能力越强。
1.6 流式细胞术检测细胞凋亡 胰酶消化转染后的细胞,调整细胞浓度为5×105个/mL。取细胞悬液1 mL,离心、洗涤。在每孔中加入5 μL Annexin V/FITC,避光室温放置15 min。检测前加入5 μL碘化丙锭(PI),流式细胞仪检测各组细胞凋亡率。
1.7 双荧光素酶报告实验检测荧光素酶活性 在线生物信息学软件显示DLX6-AS1 和HMGA2 与miR-497均存在结合位点。为了验证它们之间的靶向关系,通过PCR 扩增DLX6-AS1-野生型(WT)和HMGA2-WT 序列,通过定点诱变系统构建DLX6-AS1-突变型(MUT)及和HMGA2-MUT的3’UTR载体,并将其克隆到pmirGLO 荧光素酶载体中,分别合成DLX6-AS1-WT、HMGA2-WT、DLX6-AS1-MUT 和HMGA2-MUT 荧光素酶载体,并与miR-497 mimics共转染至MG63细胞,转染48 h,通过双荧光素酶报告基因测定试剂盒检测各组细胞荧光素酶活性。
1.8 Western blotting 法检测PCNA 和cleaved caspase3 表达 提取细胞总蛋白,BCA 法检测蛋白浓度,SDS-PAGE 分离蛋白,转移至PVDF 膜;5%脱脂奶粉封闭1 h;加入一抗稀释液(PCNA、cleaved caspase3 及内参GAPDH 稀释倍数均为1∶1 000),4 ℃冰箱摇床孵育过夜;洗膜3 次,HRP 标记的二抗(稀释倍数为1∶5 000)室温孵育1 h。ECL 显色、曝光,凝胶图像处理系统扫描条带,Image J软件分析条带灰度值。以目的蛋白条带灰度值与内参蛋白条带灰度值的比值作为目的蛋白相对表达量。
1.9 统计学方法 所有数据采用SPSS 21.0统计软件进行分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 抑制DLX6-AS1 表达对MG63 细胞增殖、凋亡的影响 与control 组比较,si-DLX6-AS1 组DLX6-AS1 表达和细胞增殖能力降低,凋亡率升高(P<0.05);control组和si-NC组比较,差异无统计学意义(P>0.05),见图1、表1。
表1 转染DLX6-AS1 siRNA后的细胞活性 ,n=3
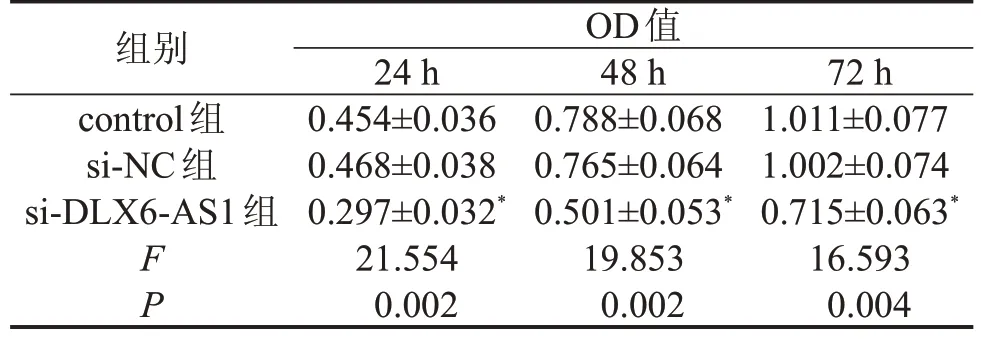
表1 转染DLX6-AS1 siRNA后的细胞活性 ,n=3
与control组比较,*P<0.05。
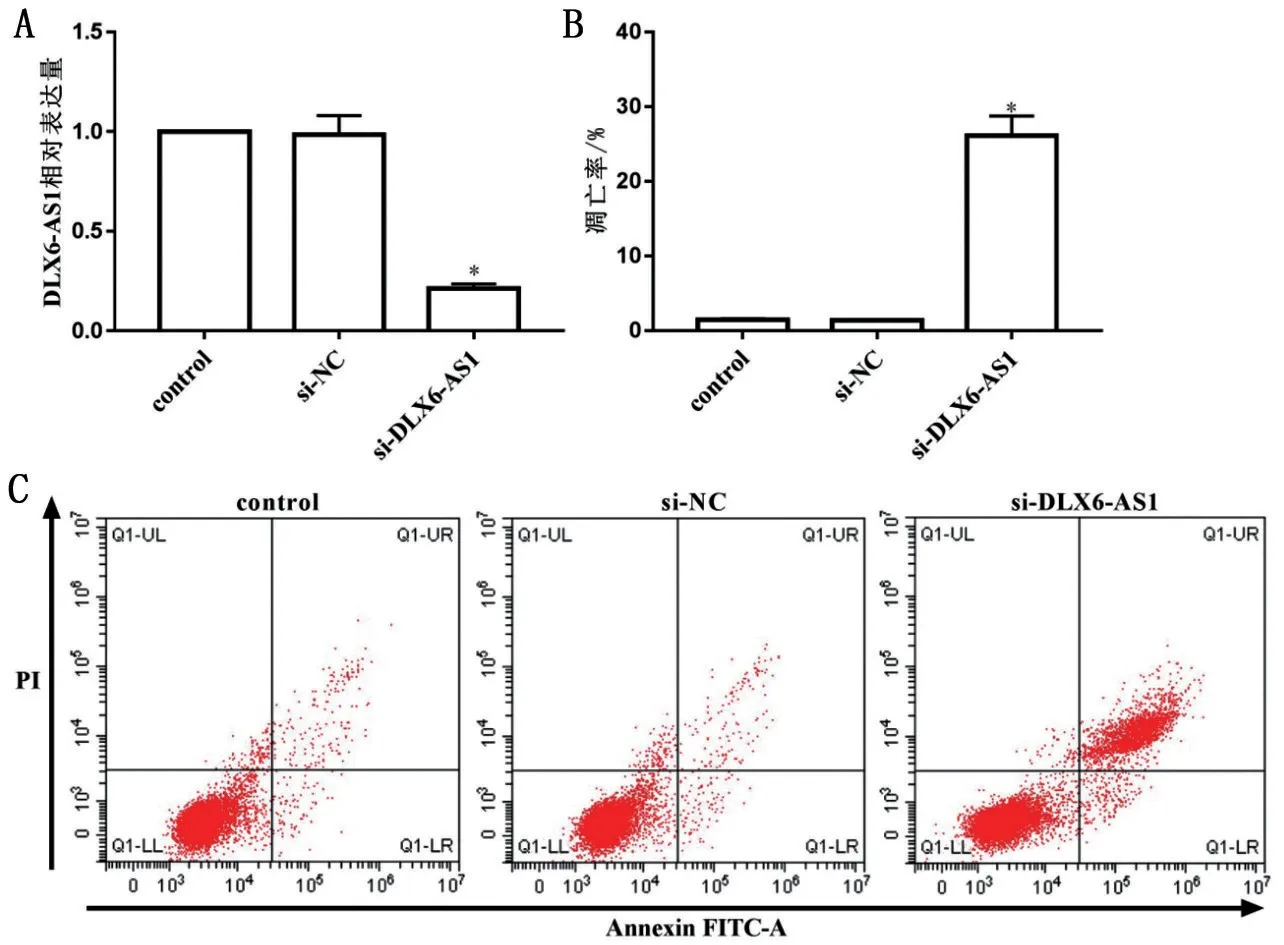
图1 MG63细胞转染DLX6-AS1 siRNA后DLX6-AS1表达及凋亡情况
2.2 DLX6-AS1 和miR-497 靶向关系验证 靶基因预测软件显示DLX6-AS1和miR-497有可结合的位点。通过双荧光素酶报告基因验证其靶向关系,结果显示:与miR-NC组比较,miR-497 mimics组共转染miR-497 mimics和DLX6-AS1-WT 的MG63 细胞荧光素酶活性明显降低(P<0.05),而miR-497 mimics 与DLX6-AS1-MUT 共转染后,荧光素酶活性无明显变化(P>0.05)。进一步采用qPCR 检测抑制或过表达DLX6-AS1后的细胞中miR-497表达情况,结果显示:抑制DLX6-AS1(si-DLX6-AS1组)可明显促进miR-497 表达,而过表达DLX6-AS1(pcDNA3.1-DLX6-AS1 组)可明显降低miR-497 表达(P<0.05),见图2。说明miR-497 是DLX6-AS1的靶基因,DLX6-AS1可负调控miR-497。

图2 DLX6-AS1靶向调控miR-497
2.3 miR-197和HMGA2靶向关系的验证 生物信息学数据库发现HMGA2可能是miR-197的候选靶基因。进一步通过双荧光素酶报告基因验证两者关系,结果显示:与miR-NC组比较,miR-497 mimics组荧光素酶活性降低(P<0.05),而将其与靶向位点发生突变的HMGA2-MUT 共转染MG63 细胞后,miR-497 对荧光素酶活性抑制作用消失。qPCR 结果显示:miR-497 mimics组HMGA2表达明显降低,anti-miR-497 组HMGA2 表达明显升高(P<0.05),见图3。说明HMGA2 是miR-497 的靶基因,miR-497可负调控HMGA2表达。
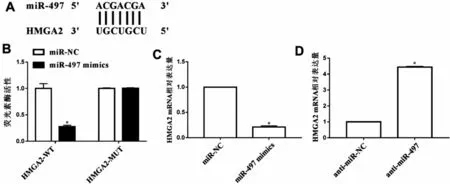
图3 miR-197靶向调控HMGA2
2.4 抑制DLX6-AS1表达调节miR-497/HMGA2分子轴影响MG63细胞增殖和凋亡 为了证实DLX6-AS1 是否可通过下调miR-497 并上调HMGA2 影响MG63 细胞增殖和凋亡,将si-DLX6-AS1 和antimiR-497 及HMGA2 过表达载体分别转染MG63 细胞,qPCR 结果显示:与si-NC 组比较,si-DLX6-AS1组HMGA2 表达和细胞增殖能力降低,凋亡率升高(P<0.05);与si-DLX6-AS1 组比较,si-DLX6-AS1+anti-miR-497 组 和si-DLX6-AS1+HMGA2 组HMGA2 表达和细胞增殖能力升高,凋亡率降低(P<0.05),见图4、表2。

表2 DLX6-AS1通过miR-497/HMGA2分子轴对MG63细胞增殖的影响
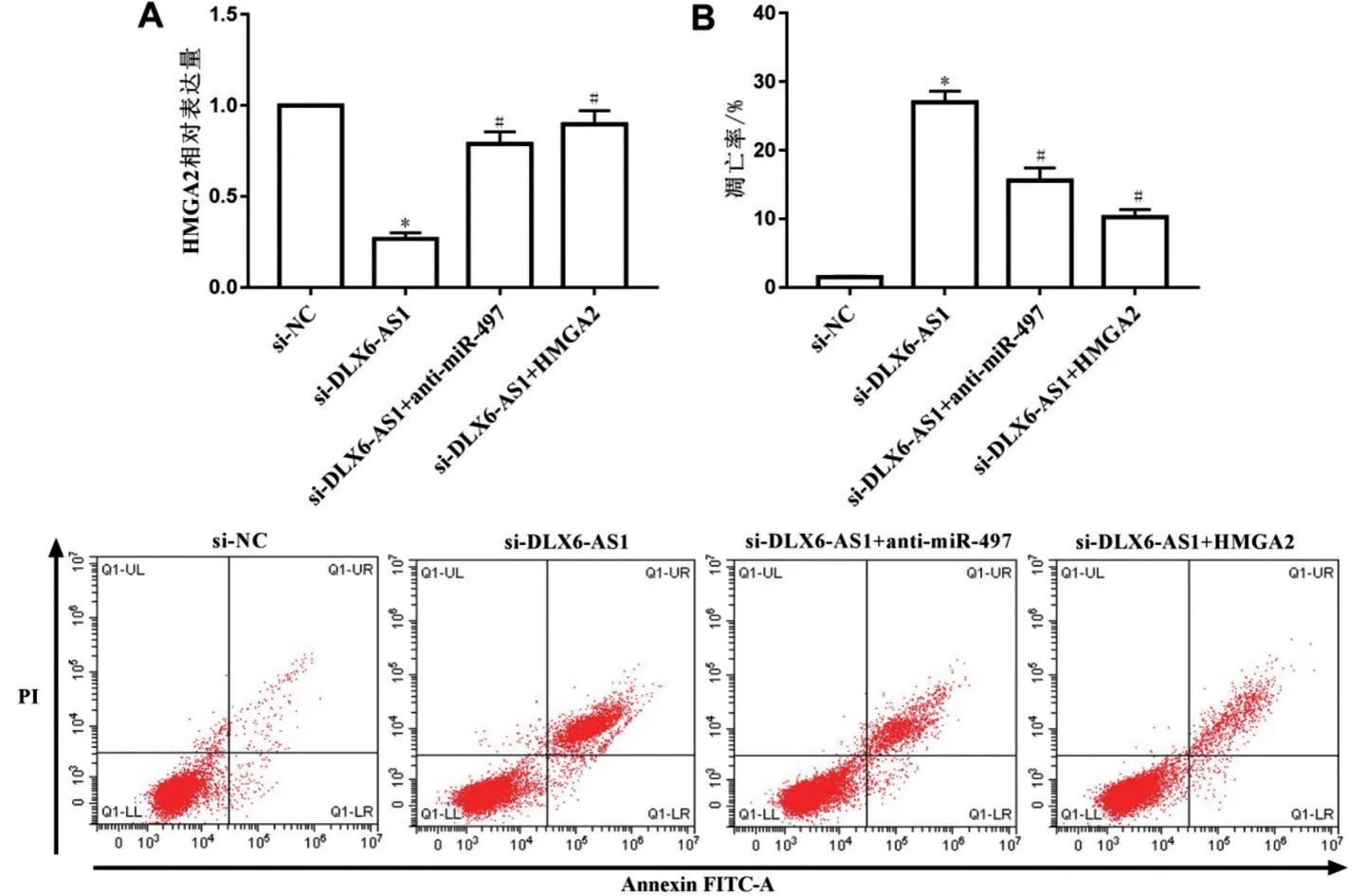
图4 DLX6-AS1通过miR-497/HMGA2分子轴对MG63细胞凋亡的影响
2.5 抑制DLX6-AS1通过调节miR-497/HMGA2分子轴影响MG63细胞PCNA、cleaved caspase3表达 通过Western blotting 检测各组细胞PCNA 和cleaved caspase3 表达,结果显示:与si-NC 组比较,si-DLX6-AS1 组PCNA 表达降低,cleaved caspase3表达升高(P<0.05);与si-DLX6-AS1 组比较,si-DLX6-AS1+anti-miR-497 组和si-DLX6-AS1+HMGA2 组PCNA 表达升高,cleaved caspase3 表达降低(P<0.05),见图5。

图5 DLX6-AS1通过miR-497/HMGA2分子轴对MG63细胞PCNA、cleaved caspase3表达的影响
3 讨论
越来越多的研究表明,lncRNAs 是表现出最大多样性的功能性ncRNAs,在等位基因表达、胚胎形成、蛋白编码基因调节、细胞分化、凋亡、生长、干细胞多功能性等中发挥重要作用[10]。多项研究表明,在肿瘤形成阶段,lncRNAs存在异常表达,其异常表达可促进肿瘤进展[11]。已有研究发现lncRNA HOX转录反义RNA(HOTAIR)、lncRNA FOXD2-AS1、lncRNA叉头蛋白F1-反义RNA1(FOXF1-AS1)等与骨肉瘤发生发展有关,但其对骨肉瘤发生机制研究尚未明确[12-14]。DLX6-AS1在肿瘤中研究较少,有研究发现DLX6-AS1 可影响骨肉瘤细胞增殖转移,但其对骨肉瘤细胞凋亡及机制影响尚未明确[7]。因此,本研究将DLX6-AS1 特异性siRNA 转染骨肉瘤MG63细胞,发现细胞增殖能力明显降低,凋亡率升高。提示抑制DLX6-AS1可诱导骨肉瘤细胞凋亡。
miR-497 属于miR-15 家族成员之一,在胃癌、喉鳞癌等多种肿瘤中均有表达[15-16]。在上述肿瘤中常发生miR-497的缺失、甲基化或组蛋白修饰,引起miR-497 表达降低,进而部分或全部丧失其调节靶基因作用,从而导致肿瘤发生发展。因此,对抗miR-497失活,靶向其下游靶基因,或有活性的miR-497 mimics,有望成为肿瘤治疗的一个新的领域。有研究显示,miR-497 可在体内体外抑制骨肉瘤细胞生长[17];lncRNA PVT1 可通过调控miR-497/HK2分子轴促进糖酵解及骨肉瘤进展[18]。高迁移率族蛋白(HMG)分子量小于30 ku,是细胞核内一组非组蛋白染色体蛋白,HMGA 作为其中一种亚型,在高等生物细胞增殖分化、生长发育及包括肿瘤在内的多种疾病中发挥重要作用[19]。人类HMGA 家族有HMGA1 和HMGA2 两个成员。多种肿瘤中可发现HMGA2 的重排现象,其过表达与肿瘤生长密切相关。如Yang 等[20]研究显示,膀胱癌中HMGA2 高表达,其表达与患者临床病理特征与预后有关;曲珊珊等[21]研究显示,在骨肉瘤细胞中抑制HMGA2 表达可降低细胞增殖和转移能力,诱导细胞凋亡,上调caspase3和caspase9表达;He等[22]研究显示,miR-106a-5p可靶向HMGA2抑制骨肉瘤细胞增殖、侵袭和迁移。本研究通过双荧光素酶活性检测发现miR-497和DLX6-AS1与HMGA2均存在靶向关系,且抑制DLX6-AS1 表达可促进miR-497 表达,降低HMGA2表达,过表达DLX6-AS1可抑制miR-497表达;细胞转染miR-497 mimics后HMGA2表达降低,转染miR-497 inhibitor 后HMGA2 表达升高,提示DLX6-AS1 可负调控miR-497/HMGA2 分子轴。进一步将DLX6-AS1 siRNA 和miR-497 inhibitor 及HMGA2 过表达载体转染MG63 细胞,发现抑制miR-497 及过表达HMGA2 均可减弱DLX6-AS1 siRNA 对MG63 细胞的增殖抑制及凋亡促进作用(P<0.05)。
PCNA 是在DNA 合成期阶段一个必不可少的因子,其表达水平可反映细胞的增殖能力,目前在肿瘤研究中已将其作为细胞增殖活性检测指标[23]。Caspase3是caspase家族关键酶,其活化对肿瘤细胞凋亡有明显的诱导作用[24]。本研究结果显示,抑制DLX6-AS1 可明显下调PCNA 表达,上调cleaved caspase3表达,而抑制miR-497及过表达HMGA2均可减弱si-DLX6-AS1 对MG63细胞PCNA 和cleaved caspase3 表达的影响(P<0.05)。说明抑制DLX6-AS1 表达可通过负调控miR-497/HMGA2 分子轴下调MG63细胞中PCNA和caspase3的表达。
综上所述,抑制骨肉瘤MG63 细胞DLX6-AS1表达可降低细胞增殖能力,促进细胞凋亡,其机制可能与上调miR-497 并下调HMGA2 有关。LncRNA DLX6-AS1 发挥促癌作用,有望成为骨肉瘤治疗新靶点。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- CTRP3 alleviates OGD/R-induced myocardial cell injury by activating the SIRT1/FoxO3a pathway
- 舒尼替尼通过调控lncRNA ROR/miR-670-3p/MARCH5轴对胃癌细胞增殖和凋亡的影响*
- LncRNA SNHG7靶向调节miR-146a-5p对胃癌细胞增殖、迁移、侵袭和细胞凋亡的影响*
- 高糖通过上调E2F1的表达促进肝癌细胞的侵袭和转移*
- lncRNA GABPB1-IT1靶向下调miR-501抑制宫颈癌细胞增殖、侵袭和迁移的机制*
- 姜黄素通过调控miR-152对甲状腺癌细胞TPC-1增殖、凋亡、迁移和侵袭的影响*
