盐水灌注导管在肾去交感神经消融术中的应用
2021-08-19欧振宏陈芸霖殷跃辉
欧振宏 陈芸霖 殷跃辉,
(1.重庆医科大学研究生院,重庆 400010; 2.重庆医科大学附属第二医院心血管内科,重庆 400010)
射频能量介导的经皮肾去交感神经消融术(renal sympathetic denervation,RDN)通过射频电流破坏肾动脉周围交感神经,降低全身交感神经活性来治疗高血压等疾病。目前,虽然应用非灌注导管(non-irrigated catheter,NIC)的RDN临床试验初步实现了降低血压的目标,但其微弱的降压幅度提示需进一步优化手术方式及消融器械。盐水灌注导管(saline-irrigated catheter,SIC)既往主要用于治疗心律失常,具有更低的电极组织界面温度,更大的消融损伤深度和防止心血管内膜面血栓形成等优势。已有研究证实,SIC也可安全有效地应用于RDN中。因此,现就SIC在RDN中的应用研究进行简要综述。
1 RDN概述
交感神经尤其是肾交感神经过度激活与高血压等疾病的发生和发展密切相关。既往研究已证实,心、肾、肌肉及全身交感神经的过度激活普遍存在于心血管疾病中[1]。其中,肾交感神经在激活其他交感神经系统及升高血压的过程中起着重要作用[2],肾交感传出神经降低肾血流量和肾小球滤过率,增加水钠潴留并刺激球旁细胞,激活肾素-血管紧张素-醛固酮系统,肾交感传入神经调节脑干及下丘脑等区域的心血管中枢,可直接上调心、肾及血管等靶器官交感神经的活性[3]。因此,破坏肾交感神经有望降低全身交感神经活性,从而治疗高血压等疾病。
但利用射频能量破坏肾动脉周围交感神经的RDN在用于治疗顽固性高血压的研究中经历了曲折的发展。在早期的临床试验中,RDN明显地降低了交感神经活性及动脉血压[4-5]。然而,首次引入假手术对照组的Symplicity-HTN 3随机临床试验[6]得出的阴性结果,引发了学界对RDN的质疑和再认识。在经过改良消融器械,增加肾动脉主干消融点数及引入肾动脉分支消融后,更为严谨的HTN-OFF MED试验再次证实RDN能长期和安全有效地降低血压[7]。然而,其降压幅度[动态收缩压下降3.9 mm Hg(1 mm Hg=0.133 3 kPa),诊室收缩压下降6.5 mm Hg]较早期临床试验结果却过于微弱。
Sakakura等[8]研究了人肾动脉周围交感神经的解剖分布特点:(1)神经分布于动脉外膜及周围软组织内,75%的神经位于距离内膜4.28 mm内,90%的神经位于距内膜6.39 mm内;(2)近中段神经密度及距内膜平均距离大于远端;(3)传出神经远多于传入神经。因此,透壁6 mm的损伤可破坏绝大多数的交感神经,有望取得良好的去神经效应。但应用Symplicity导管进行消融的患者,术后尸体解剖显示其动脉损伤深度≤2 mm[9];在动物实验中,NIC产生的损伤深度通常<3 mm[10]。此外,一项应用不同能量行RDN治疗高血压的临床试验发现,在肾动脉主干上超声消融较射频导管消融产生的降压效应更明显,笔者推测其主要的原因是射频能量形成的损伤深度不够[11]。因此,有限的肾动脉周围组织的损伤深度导致较少的交感神经损伤,可能是目前RDN降压幅度微弱和不稳定的原因之一。
2 SIC消融概述
2.1 普通消融的局限性
应用普通导管进行射频导管消融时,电流在电极头端下方组织产生的电阻加热薄层向周围组织传导热量,导致细胞凝固性坏死以形成消融损伤(图1)。在此过程中,增加功率在增大损伤范围的同时,会引起电极组织界面温度升高。当其过高(约80 ℃)时,周围血浆蛋白变性并覆盖于电极表面,缩小电极的有效加热面积,致使相同的射频电流传入更窄的接触界面,产生更大的电流密度,造成内膜破裂,焦痂与血栓形成,阻抗增加,阻止消融能量进一步渗透组织[12]。因此,过大的消融能量并未进一步提升普通射频导管消融的有效性,反而造成更小的损伤,并可导致血栓的形成。
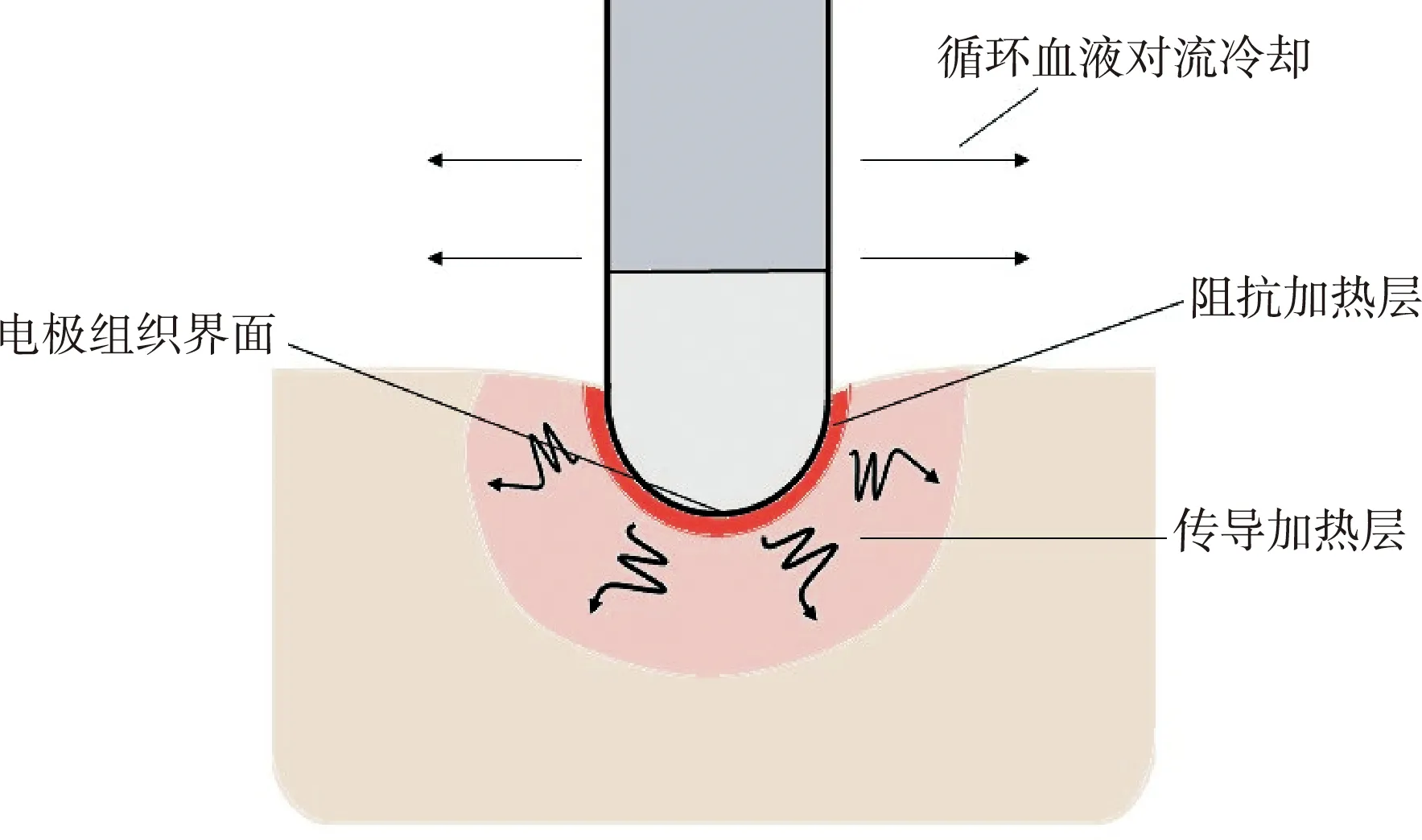
图1 射频导管消融基本原理示意图
2.2 增大消融有效性的方法
避免产生过高的界面温度是增加消融有效性的关键。目前有三种方式可进一步增加消融的有效性。(1)温控模式:通过感受电极温度负反馈调节输出功率以避免界面温度过高中断消融,NIC多采用此种方法,但限制功率的同时会限制组织损伤的扩大,导致消融效果提升有限。(2)采用更大的消融电极:虽然放大了血流的对流冷却效应,降低了界面温度,使继续增加功率的同时增大损伤,但这降低了导管操作的灵活性及消融的准确性,因而其应用受到限制。(3)使用SIC:灌注电极通过导管内灌注液主动冷却电极及周围组织以降低界面温度,在不增大电极的同时能继续上调功率,实现精确消融下的损伤扩大,已被广泛应用于快速性心律失常的消融治疗[13]。
2.3 开放式SIC的消融特点
由于主动冷却效应,SIC相较于NIC可产生更低的界面温度和更深的消融损伤,其主要有两种类型:开放式和封闭式(图2)。在犬小腿肌肉模型上,Yokoyama等[14]证实降低界面温度能使血栓发生率下降,因此SIC较NIC消融时更安全,且开放式较封闭式SIC界面温度进一步下降,故前者具有更好的安全性。因此,开放式SIC得到更广泛的应用。Nakagawa等[13]和Petersen等[15]证实开放式SIC相较于NIC可产生更大的损伤范围,这是由于应用SIC时界面温度的降低允许更大功率的消融,故能使组织温度超过界面温度,且最大组织温度通常位于组织表面下1~2.5 mm处,而NIC消融时最大组织温度位于组织表面。与之相对应,SIC产生的损伤表现为界面损伤范围更小,损伤最宽处下移,损伤深度及体积更大。

图2 封闭式SIC与开放式SIC示意图
2.4 影响SIC消融有效性的因素
盐水流速、电极大小、导管贴壁压力和电极方向等可影响SIC消融损伤的深度。Wong等[16]在离体绵羊左室模型中证实,固定设置功率,过度增大的盐水流速(至30 mL/min)会造成损伤体积减少。而当盐水流速较小时,Petersen等[17]发现增大流速可实现更大功率(实际功率)的消融,病灶体积与盐水流速和实际功率成正相关。由此可见,盐水流速影响损伤范围,在其较小时,其变化与实际功率成正比,因而可增大损伤范围;当其过大时,其自身消耗能量过多会降低实际功率,反而减少损伤范围。增大贴靠压力和采用垂直方位消融均可产生更大的损伤体积[18],这是因为循环血流带走的热量减少,但缩小SIC电极却因此增加了病灶深度[19]。
3 SIC与NIC在RDN中的比较
动物实验证实SIC相较于NIC可更加安全地实现RDN。此前有质疑认为肾动脉内快速的血流速度能产生足够的循环冷却效应,因此使用NIC消融具有充足的“自身”冷却效应[20]。但通过猪体内消融和计算机模拟实验,Tzafriri等[21]发现肾动脉血流造成的冷却效应在应用NIC消融时不足以保护动脉内膜,电极遮盖下组织术后仍能发现动脉内膜及中膜弥漫性损伤,而在应用SIC消融时相应部位损伤明显减少。与此研究一致,Sakakura等[22]使用SIC也实现了更低的界面温度和更轻微的动脉中膜损伤。且在应用NIC消融后,人肾动脉通过光学相干断层显像仍能发现内膜血栓形成[23]。因此,肾动脉血流不能产生足够的冷却以避免内膜热损伤,额外灌注的SIC能更有效地保护动脉内膜组织,增加肾动脉消融的安全性。
由于肾交感神经多走行于动脉外膜侧[8],SIC消融产生的温度分布可能更符合肾交感神经的解剖分布,且体外试验及临床研究均证实SIC可形成更大的病灶而更为有效地治疗心律失常,因此从理论上可合理地推测SIC较NIC能实现更明显的去神经效应[13]。
但比较SIC与NIC在RDN中有效性的研究结果却存在差异。在动物实验中,Wang等[24]在犬的双侧肾动脉消融后发现,使用SIC的内膜增生更少且管壁深处神经损伤更明显,形成了更为穿透的消融。且Chen等[25]认为术后肾动脉扩张是成功实现RDN的标志,使用SIC消融破坏了更多的肾神经,因而产生了更明显的动脉扩张。然而Tzafriri等[21]及Sakakura等[22]分别在猪肾动脉内进行的研究发现,与应用NIC相比,SIC消融造成的动脉神经损伤和血浆代谢物下降并无统计学差异,据此认为虽然SIC有着更好的安全性,但其并未产生更多的组织损伤。这些结果的差异可能是由于实验设置的消融参数不同所致。Tzafriri等[21]和Sakakura等[22]研究的盐水流速、设置功率以及界面维持温度均较Wang等[24]和Chen等[25]的研究更大,这些参数的差异影响了消融组织的实际功率,因此产生了不同的组织温度及损伤范围。目前消融参数尤其是盐水流速与肾神经损伤的关系尚缺乏研究,主动灌注在保护血管内膜方面是否存在流速阈值及盐水流速、内膜温度与消融功率的匹配关系亦不明确,这些对确定适宜的参数指导SIC的应用是重要的。此外,选用不同大小及质地的肾动脉也可能会对实验结果产生影响。而在一项应用RDN治疗高血压伴肾功能不全患者的临床试验[26]中,相较于NIC消融,应用SIC的受试者术后动态收缩压的下降、估算肾小球滤过率的增加及尿白蛋白的减少更为明显,虽然此结果支持SIC可形成更为明显的降压和去神经效应,但该试验设计存在未采用盲法、无假手术对照组及缺乏血浆代谢物变化等不足,因而有待严格的随机对照试验进一步证实。
4 SIC用于RDN中的临床研究
临床试验已初步证实SIC能安全有效地实现肾去交感神经效应,从而治疗高血压等疾病。
4.1 治疗高血压
众多应用RDN治疗高血压的临床试验明确了SIC的安全性。在10例顽固性高血压患者中,Ahmed等[27]最先尝试使用SIC进行双侧肾动脉消融,术后肾动脉形态和肾功能未见明显异常,提示SIC可安全地用于RDN。在术后3个月时,其收缩压和舒张压分别降低了(22±11)mm Hg和(13±6)mm Hg,同时血浆去甲肾上腺素和醛固酮浓度均显著下降,提示肾去交感神经效应的初步实现。随后,在24例伴有顽固性高血压的慢性肾脏病患者中,Kiuchi等[28]使用相似的SIC获得了与Ahmed等[27]研究相似的结果,术中及术后均未见消融相关并发症,术后7 d和180 d血压出现明显下降[诊室血压从(186±19)/(108±13)mm Hg降至(133±11)/(85±7)mm Hg和(135±13)/(88±7)mm Hg,动态血压从(151±18)/(92±11)mm Hg降至(133±13)/(83±8)mm Hg和(132±15)/(85±11)mm Hg]。此后,陆续有使用SIC治疗高血压的单臂小型临床试验,均显示出相似的降压效果及良好的手术安全性[29-31]。这些研究均说明SIC用于RDN安全可行,并能初步降低血压,但其存在样本量较小,缺乏假手术等对照组,部分未测定血浆代谢物等缺点,尚不能避免其他因素(如研究者心理和霍桑效应等)对有效性的影响[6]。
4.2 治疗阵发性心房颤动合并高血压
RDN治疗阵发性心房颤动合并高血压患者的临床试验中,进一步证实了应用SIC的有效性及安全性。在早期试验性研究[32]及随后进行的大型、多中心、单盲和随机对照临床试验[33](ERADICATE-AF试验)中,受试者随机分配至肺静脉隔离组或肺静脉隔离+RDN组,由于采用严格的盲法,故未行RDN的受试者可视为假手术组。术后12个月时,RDN组的心房颤动复发率及平均血压均较对照组更低,且在行肾动脉消融时未见手术相关并发症。且此类患者使用SIC的同时完成肺静脉隔离及肾动脉消融,可避免术中更换消融导管,减轻医疗负担。
4.3 治疗其他心血管疾病
与治疗高血压的研究相似,用于治疗心力衰竭[34]及室性心律失常[35-36]的试验性临床研究也证实SIC可安全地用于RDN。虽然这些试验受试者术后心功能初步改善,室性期前收缩和室性心动过速发作频率明显减少,但仍存在样本量较小及缺乏假手术对照组等不足,需严格设计的随机对照试验验证其有效性。
5 总结与展望
目前应用NIC仅产生较小的降压幅度,提示RDN可能需进一步调整消融器械及参数。SIC产生的消融损伤,可能更为穿透且更符合肾动脉神经的解剖分布。临床试验已证实SIC可安全地应用于肾动脉消融手术中,尤其是在心房颤动合并高血压的患者中,使用同一SIC行RDN及肺静脉隔离具有更多的获益。已有用于RDN的灌注导管(Rithm Cool及Thermocool等)的出现,但这些导管需进一步明确适宜的盐水流速等消融参数,且缺少对比NIC的严格随机临床试验进一步证实其优越性,其广泛应用于RDN尚需进一步探索。总之,SIC具有更好的安全性以及不劣于NIC的有效性,其未来在RDN领域的研究和应用值得期待。
