体外膜肺氧合在婴幼儿先天性心脏病术后应用的研究进展
2021-08-19于文波廖晨曦张健翟波
于文波 廖晨曦 张健 翟波
(1.郑州大学附属儿童医院 河南省儿童医院 郑州儿童医院胸心外科,河南 郑州 450000; 2.兰州大学第二临床医学院,甘肃 兰州 730000; 3.四川省妇幼保健院麻醉科,四川 成都 610000)
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)技术是在体外循环基础上发展起来的体外生命支持技术,其原理是将体内的静脉血引出体外,经过特殊材质人工心肺旁路氧合后,泵入动脉或静脉系统,起到部分心肺替代的作用,以维持人体脏器组织的血供氧合[1]。Hill等[2]于1972年首次将ECMO应用于危重患者,经过近半个世纪的发展,ECMO在装置材料、运转监护和并发症防治等众多方面取得了巨大进步。目前在临床上,ECMO已比较广泛地应用于为各种原因导致的重症心肺功能衰竭患者提供暂时性心肺支持,争取原发疾病治疗和恢复的时间窗口,在危重患者的救治中发挥着十分重要的作用[3]。
随着婴幼儿心脏手术水平的提高,先天性心脏病(congenital heart disease,CHD)患儿手术年龄不断降低,手术难度系数也逐渐增加。在一些复杂畸形和心功能差的高危病例中,尽管畸形矫治满意,但术后仍会出现药物难以控制的心功能不全和心力衰竭,此类患儿可能就需要ECMO的支持治疗[4-5]。及时有效的ECMO辅助,能维持CHD术后严重心力衰竭患儿的循环稳定,改善组织缺氧状态,使心脏得以充分休息,为心功能的恢复提供机会,从而提高CHD术后高危患儿的生存率[6]。但就目前而言,较少有文章能全面而详细地阐述CHD术后ECMO应用的相关问题,现以此为契机,从应用现状、辅助策略、并发症及未来进展等多角度对婴幼儿CHD术后ECMO的支持治疗进行综述。
1 ECMO支持治疗在婴幼儿CHD术后的应用现状
Bartlett等[7]于1975年将长时床旁ECMO支持治疗首次应用于13例婴儿,其中救治成功的病例中就包括了CHD术后心力衰竭,开启了ECMO在婴幼儿应用的新时代。伴随着心脏手术和体外循环技术的不断成熟和进步,ECMO技术日益发展,成功率逐渐上升,并发症发生率也有所减少,其在危重症患者中的支持治疗作用越来越凸显。但由于ECMO的实施离不开心血管外科和体外循环理论和技术的支持,其在心脏外科领域的应用仍占据很大比重[8]。2017年体外生命支持组织(Extracorporeal Life Support Organization,ELSO)发布了《2016儿科体外生命支持组织国际报告》[9],报告显示2009—2015年,因心脏原因累计使用ECMO支持治疗的新生儿6 475例,儿童8 374例,并且其主要是在CHD手术后的病例中实施。目前ECMO在婴幼儿CHD术后主要应用于体外循环脱离困难,药物难治性低心排血量综合征以及心肺复苏困难的心搏骤停等。
1.1 ECMO在CHD术后体外循环脱机困难时的应用
在一些心脏复杂畸形和手术操作时间长的CHD患儿中,由于术中长时间的心内外操作和体外循环加重了本已存在的心肌损伤,造成体外循环脱离困难[10],此时可在手术室由体外循环模式直接转换至ECMO模式,从而及时终止体外循环的不良影响,等待心肌损伤的恢复。此类患儿虽然是CHD术后应用ECMO支持治疗最为及时和从容不迫的,但由于其畸形的复杂性和手术打击的巨大性,往往成功率相对较低。
1.2 ECMO在CHD术后药物难治性低心排血量综合征时的应用
CHD术后最主要的致死性并发症是心功能不全,发生率3%~5%[11],而大部分的心功能不全经过药物保守治疗不会进一步发展成严重的低心排血量综合征。但在一些早产儿和新生儿病例,未成熟心肌的顺应性差,功能储备低,术后心肌水肿,心功能进一步降低,同时又因为新生儿心脏对强心药物敏感度低等因素,导致药物难治性低心排血量综合征的发生率较高[6]。这种情况常出现在CHD术后第1天内,若及时给予ECMO支持辅助,能显著地改善此类患儿的预后[5]。由于监测手段的差异和心功能恢复的不确定性,ECMO在CHD术后发生药物难治性低心排血量综合征应用的时机,在所有CHD术后有ECMO适应证的病例中最难掌握,往往有病例因实施支持治疗过晚而预后欠佳[4,6]。
1.3 ECMO在CHD术后体外心肺复苏中的应用
根据ELSO发布的《2016儿科体外生命支持组织国际报告》,多中心的儿童心搏骤停流行病学资料显示,院内心搏骤停在儿童重症监护中发生率约为2.2%[9]。CHD术后发生心搏骤停与手术后心肌损伤和内环境紊乱等密切相关,同时严重的低心排血量综合征易并发恶性心律失常甚至心搏骤停。对于CHD术后突发的心搏骤停,给予标准的心肺复苏程序后,仍未出现复苏迹象,应快速地启动体外心肺复苏(extracorporeal cardiopulmonary resuscitation,ECPR),为机体提供更有效的血流灌注,在降低神经系统并发症的同时提高生存率[12]。然而CHD术后的ECPR不如其他原因条件下心搏骤停实施ECPR的效果,这与患儿在心搏骤停之前经历较长时间低心排血量综合征阶段,大剂量应用血管活性药物导致其他脏器缺血,同时机械的心脏按压加重了本已存在的心肌细胞损伤。
2 ECMO在婴幼儿CHD术后支持治疗实施要点
2.1 适应证的掌握
中国医师协会新生儿科医师分会于2018年5月发布了《新生儿呼吸衰竭体外膜肺氧合支持专家共识》[13],但到目前为止,对于儿童ECMO在心脏支持方面仍无统一和明确的共识或指南。心脏畸形手术矫正充分应是CHD术后ECMO支持治疗选择并成功的先决条件,这是由于ECMO不能治疗疾病的本质所决定的,只有满意的畸形矫正才能真正为心脏功能的恢复提供可能[14],因此心功能可恢复性评估应贯穿ECMO支持治疗的全过程,从根源上避免无效辅助的发生。在成人ECMO循环支持的基础上,结合ELSO儿童心脏支持的指南,目前临床上比较认可的指征主要有三点[15-16]:(1)CHD矫治满意,经长时间的体外循环辅助仍不能脱离。(2)长时间心排血指数<2 L/(m2·min),或心排血指数进行性下降,大剂量的血管活性药物下循环仍难以维持稳定(正性肌力药物评分>20),血乳酸水平进行性升高。(3)对常规心肺复苏反应不良或无反应的心搏骤停,因婴幼儿CHD自身疾病,临床上复杂的血流动力学监测实际难以准确达到,加上医患主观因素的存在,对于CHD术后严重低心排血量综合征患儿,如何更好地掌握ECMO支持时机,减少机体缺血缺氧时间,避免心搏骤停事件发生,需大样本和多中心的进一步研究和发现。
2.2 ECMO的实施管理
2.2.1 插管方式的选择
同其他儿童ECMO循环支持模式一样,CHD术后ECMO的转流方式均选择静脉-动脉(veno-arterial,V-A)模式,但不一样的是,CHD术后的ECMO插管多选择经胸[16]。对于体外循环撤离困难的病例,可简便快捷地直接经胸将原主动脉根部和右心房插管应用转换至ECMO机器。对于监护室内发生的因低心排血量综合征和心搏骤停而实施的ECMO,亦多选择床旁开胸置管,一方面是由于开胸置管简单确切,另一方面延迟关胸可减轻心脏窘迫,利于心功能的恢复;对于年龄较大的患儿,也有选择颈部或股动、静脉插管,但因不易操作、血管损伤、转流阻力和动静脉结扎等问题,目前在实际工作中的应用较少[16]。值得注意的是,对于心功能恢复较慢,需长时间转流的患儿,应将经胸插管转移至颈部或股动、静脉,以避免严重的感染并发症。详见图1。

图1 CHD术后ECMO插管选择示意图
2.2.2 个体化的转流管理
常规ECMO转流管理包括循环管理、呼吸管理、出凝血管理、感染控制、镇静镇痛、营养支持和撤机等众多方面,CHD术后ECMO转流管理实施流程总体上与之相吻合。然而由于各种CHD心脏畸形病理生理特点的不同,以及手术所实施的根治或姑息状态的不同,ECMO的转流管理在一些方面存在差异[17-19],见表1。这些差异是CHD术后ECMO支持治疗成功的关键,从一定程度上来说,也正是这些差异导致了目前临床上尚未能形成一致的小儿ECMO循环支持共识和指南。因此,针对不同类型的CHD病理生理特点和术后畸形矫治状态来实施个体化的ECMO管理,提高成功率,降低并发症,这才是CHD术后ECMO支持治疗的重中之重。

表1 部分常见病理生理特点的CHD术后ECMO个体化管理措施
2.2.3 团队协作
ECMO支持治疗作为一项高精尖的生命支持技术非一己之力,迅速有效地实施需众多专业人员的参与和通力协作,它的成功是建立在训练有素和配合默契的团队基础之上,ECMO团队组成及作用见图2。通过一个沟通良好且专业稳定的多学科团队的最优质管理,可使生存预后和并发症发生显著改善,在危重患者ECMO救治中发挥核心作用[20]。目前团队观念已广泛地应用于ECMO的管理中,并且深入重症医学领域,有无ECMO团队以及ECMO团队质量是一个医院、一个地区甚至一个国家医疗水平评判的重要指标。ECMO团队建设对于心脏中心有着得天独厚的优势;然而,团队的成立和发展并不是一蹴而就的,需专门的基础知识培训、定期模拟训练和长期的实战经验积累,这将是未来努力和发展的方向。

图2 ECMO团队涉及主要科室及功能
3 ECMO在CHD术后应用的效果
根据ELSO发布的《2016儿科体外生命支持组织国际报告》[9],CHD使用ECMO支持治疗新生儿出院率为39%,儿童出院率为47%。国内ECMO起步较晚,近10年发展迅速,据统计,截止2017年7月,儿童心脏围手术期ECMO共实施457例,新生儿出院率为32%,儿童出院率为44%[21]。近年ECMO发展更加迅猛,根据最新的数据显示[22],2019年中国心脏手术相关的ECMO使用为4 085例,较前年增加1 430例。伴随着ECMO技术的不断成熟,其适应证日益扩展,心血管领域特别是婴幼儿CHD,对ECMO的依赖将更加明显。目前,不少的经验结果已发表在较高学术水平的杂志上,见表2。
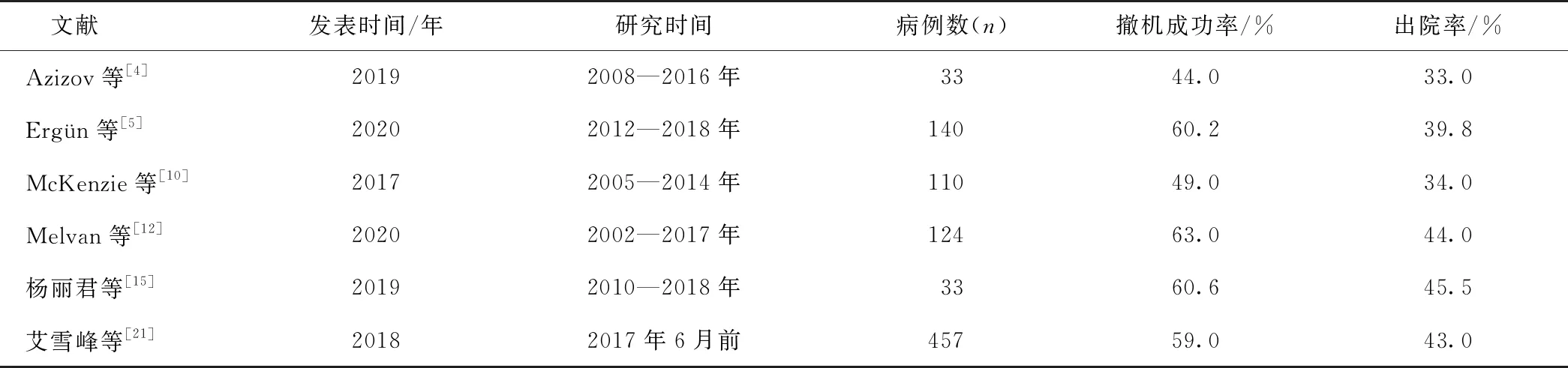
表2 CHD术后ECMO应用的国内外文献报道
虽然衰竭的心脏功能能否恢复是CHD术后ECMO支持治疗成功的决定性因素,但ECMO并发症的及时和正确处理也是改善患儿生存及预后的关键因素[23]。ECMO在CHD术后应用的并发症主要为机体和机械并发症两大类。相对而言,如出凝血障碍[24]、神经系统损伤[25]、肝肾功能损害[26]和感染[27]等这些机体并发症发生和发展比较复杂,预防处理更加棘手[28-29]。出血是CHD术后ECMO辅助的最常见并发症,这是由于婴幼儿自身处于不成熟的凝血功能阶段,在经历了较大的手术创面和较长手术时间的凝血因子的消耗后,凝血功能更加糟糕[24],从而易导致出血的发生,且颅脑出血最为严重,轻者可导致颅脑损伤,重者可至脑死亡[25]。减少出血的最主要方法是预防,如缩短手术过程,充分止血,在辅助过程中减少有创操作等,同时要积极监测凝血指标并对症处理,防止血栓的形成。急性肾功能不全是ECMO辅助中的常见并发症,CHD术后患儿心功能不全、大剂量血管活性药物的应用和ECMO早期低灌注等多种因素导致急性肾损伤,适时启用连续肾脏替代治疗,能降低和逆转肾损伤,改善预后[26]。CHD术后延迟关胸状态、再次开胸、输血和置管等因素,往往会出现严重的感染,因此在ECMO的应用过程中,预防和抗感染治疗应贯穿始终,除了严格的无菌操作,应积极地根据药敏监测,联合使用抗生素治疗。
4 CHD术后ECMO应用的展望
由于国内儿童ECMO起步较晚,儿童体外生命技术体系建设相对滞后,临床经验相对不足,加上儿童ECMO的特殊性和复杂性,特别是ECMO在CHD术后的应用主要集中在能开展CHD手术的较大心脏中心,因此ECMO在CHD术后的应用存在一定程度的困难和局限性。但随着低龄和复杂CHD手术的增多,CHD术后ECMO的应用也日益增多。CHD术后的ECMO支持治疗,因其独特的先天性优势,在婴幼儿ECMO的应用中占据着举足轻重的地位[30]。经过近年的探索和实践,该应用的理论和技术经历了从探索实践到推广应用,再到成熟扩展。这些深刻变化,必将推动婴幼儿ECMO的发展进程。首先,基于医疗技术水平地域发展的差异,未来必将在不断临床实践的基础上实时完善,制定符合国情的应用指南。未来也必将出台一整套的质量监督控制体系,规范适应证和禁忌证,规范技术管理。其次,对于CHD术后ECMO应用的临床研究,要以获得多中心、大样本和长远期随访结果为目标,为实施个体化治疗方案提供理论依据和经验支持。另外,在实际工作中不断完善自身团队建设,建立完备的团队理论培训、模拟考核、应急反应和运行管理等体系机制,并以此为基础来推动整个儿童ECMO团队的完善和发展。
综上所述,随着低龄和复杂CHD手术的增多,CHD术后ECMO的应用也日益增多。在当下的临床工作中,应在默契的团队配合下,正确把握适应证,及时快速地支持辅助和个体化地运行管理,提高生存率,降低并发症,进而推动ECMO在儿科重症领域的应用。
