CD40免疫检查点人源化小鼠的制备及在抗体药物研究中的应用*
2021-08-19郭雅南许立达
张 静 张 赞 赵 磊 郭雅南 黄 蕤 许立达
(1.北京化工大学,北京 100029)(2.百奥赛图(北京)医药科技有限公司,北京 101111)
近年来使用靶向程序性死亡受体1(PD-1)、程序性死亡受体1配体(PD-L1)、细胞毒性T淋巴细胞相关蛋白4(CTLA-4)等免疫检查点药物进行肿瘤免疫治疗越来越受到关注。其中,临床前动物模型选择是肿瘤免疫治疗中面临的十大重要挑战之一[1]。通过基因工程将人类基因插入动物体内,以提高动物在人类疾病研究中利用性,在疾病的基础研究和药物研究中都得到了广泛应用。基因人源化小鼠通过插入人类基因来替代相应的内源性小鼠基因使小鼠人源化,被广泛应用于人类疾病模型建立、肿瘤研究以及生物制药研究中[2-4]。单克隆抗体(monoclonal antibodies,mAbs)是临床治疗中成功率较高的一类药物[5-7],但是人类和啮齿动物之间的某些单克隆抗体交叉反应性差会严重限制其临床前研究进程。目标蛋白的转基因人源化可以为在小鼠中验证人类单克隆抗体提供一种有效的方法。
CD40是肿瘤坏死因子(TNF)受体家族的成员,是一类共激活信号分子,主要由抗原提呈细胞(APC)如树突状细胞、巨噬细胞等免疫细胞和非免疫细胞,特别是肿瘤内皮细胞、上皮细胞和造血祖细胞,以及某些肿瘤细胞特别是B细胞恶性肿瘤和淋巴瘤表达[8-10],其配体为CD40 L,主要在血小板、肥大细胞、嗜碱性粒细胞和活化的T细胞上表达[11]。CD40与它的配体CD40 L相互作用可以激活APC,为T细胞活化提供共激活信号,启动效应性细胞毒T细胞反应。构建CD40人源化小鼠模型能够为CD40单克隆抗体药物开发以及在肿瘤治疗中的安全应用研究提供更多可选择的动物模型。本研究通过构建CD40人源化小鼠模型并对其CD40表达情况进行鉴定,来进一步验证这种模型对于评价人CD40激活型抗体药物临床前药效作用和安全性的可能。
1 材料和方法
1.1 材料和试剂
健康的SPF级C57BL/6小鼠、昆明(KM)小鼠购自北京维通利华实验动物技术有限公司,实验动物生产许可证号:SCXK(京)2016-0006。CD40人源化小鼠(B-hCD40)由百奥赛图(北京)医药科技股份有限公司提供,实验动物生产许可证号:SCXK(苏)2016-0004;本研究方案经百奥赛图(北京)医药科技股份有限公司的动物护理和使用委员会批准,实验动物伦理审查编号:BAP-BJ-PS-101、BAP-BJ-PS-102。小鼠MC38结肠癌细胞购自舜冉上海生物科技有限公司;Cas9 mRNA和sgRNA的体外转录试剂盒MEGA shortscript T7 Kit和纯化试剂盒MEGA clear Kit 购自Life Technologies;southern消化酶StuI和SpeI购自NEB;southern杂交液和地高辛发光检测试剂盒购自Roche;探针引物合成于金唯智生物科技有限公司;RT-PCR引物合成于Thermo fisher scientific;流式检测抗体均购自Biolegend,包括鼠抗CD45(30-F11)、TCRβ(30-F11)、CD19(6D5)、CD4(GK1.5)、 CD8(53-6.7)、CD11c(N418)、CD11b(M1/70)、NK1.1(PK136)、F4/80(8M8), Gr1(RB6-8C5)、Ly6G(1A8)、Foxp3(FJK-16S)、CD40(3/23)、PD-1(RMP1-30)、TIM3(RMT3-23)、Eomes(Dan11mag)、T-bet(4B10)和抗人CD40(HB14);激活型抗人CD40单克隆抗体(CD40 Ab)由百奥赛图(北京)医药科技股份有限公司提供。
1.2 方法
1.2.1sgRNAs的筛选:通过 CRISPR 设计网站(http:∥crispr.mit.edu)设计了多个sgRNA,分别靶向小鼠CD40 exon2和exon7的两个位点。使用sgRNA活性检测系统UCATM(Biocytogen)筛选出两个靶向活性高的sgRNA来进行后续实验。
1.2.2Cas9 mRNA和sgRNA的制备:通过 PCR 扩增将Cas9 mRNA和sgRNA序列添加到含T7启动子的Cas9或sgRNA模板上。将该模板使用MEGA shortscript T7试剂盒进行体外转录。使用MEGAclear试剂盒将Cas9 mRNA和sgRNA纯化,然后用RNase-free水洗脱。
1.2.3打靶载体构建:我们设计的打靶载体含有人CD40基因序列(取代小鼠CD40序列)和左(~1 500 bp)、右(~1 500 bp)两个同源臂的序列作为打靶模板,修复由Cas9/sgRNA 产生的双链断裂。小鼠CD40的部分编码区域(小鼠第20~192个氨基酸)被人CD40(人第 20~192个氨基酸)取代。
1.2.4显微注射:C57BL/6雌性小鼠和KM小鼠品系分别作为胚胎供体和假孕代孕母体。将超排的雌性 C57BL/6小鼠(3~4周龄)与雄性C57BL/6小鼠交配,收集受精胚胎。将不同浓度的 Cas9 mRNA、sgRNA 和供体载体混合,共同注射到单细胞期受精卵的细胞质中。注射后,将存活的受精卵转移到 KM假孕雌性小鼠的输卵管中。
1.2.5Southern印迹杂交:从小鼠尾部提取的基因组DNA用SpeI或StuI酶消化,在0.8%琼脂糖凝胶上分离,并转移到带正电荷的尼龙膜上。使用含有地高辛(DIG)标记的探针的杂交液在42 ℃下与膜过夜杂交。随后使用DIG发光检测试剂盒检测杂交信号。
对于探针的制备,使用 Taq DNA聚合酶通过 PCR 程序制备 3′-外部和内部探针,根据生产商说明掺入DIG-11-dUTP标记探针使用以下引物扩增3′-外部探针(358 bp):5′-TCTGCAGAGCCA AGCATAGCAAAGT-3′和3′-GAGCCAGCTCAAAGC AGAGCTATCA-5′。对于内部探针(368 bp)使用以下引物:5′-GGTCAAGCAGATTGGTAAGT GGCTC-3′和3′-GAGGGGGACATTAACCATCAT GG-5′。
1.2.6RT-PCR:使用总RNA提取试剂盒提取6周龄的小鼠脾脏总RNA,使用反转录试剂盒反转录成cDNA,以GAPDH为内参,检测小鼠CD40和人CD40的mRNA的表达。
使用以下引物扩增GAPDH(269 bp):5′-ACCACAGTCCATGCCATCAC-3′和3′-GCCTGCTTC ACCACCTTCTT-5′。小鼠CD40(413 bp)使用以下引物:5′-TGAGAAGACCCAATGCCACC-3′和3′-TCCGGGACTTTAAACCACAGAT-5′。人源化CD40(408 bp),使用以下引物:5′-GTGCTGTTCTTTG TGCCAGC-3′和3′-AGGTCTTTGGTCTCACAGCTT-5′。
1.2.7流式细胞术检测小鼠CD40蛋白表达及免疫细胞分群:分别对C57BL/6小鼠和B-hCD40小鼠腹腔注射7.5 μg mCD3抗体,24 h后收集小鼠脾脏细胞检测B-hCD40小鼠人源CD40蛋白的表达水平。分别收集C57BL/6和B-hCD40小鼠脾脏细胞,对小鼠的各个淋巴细胞群包括B细胞、T细胞、NK细胞、DC细胞、粒细胞、巨噬细胞、单核细胞、CD4+阳性细胞、CD8+细胞和Treg细胞进行流式分析。对收集到的小鼠脾脏组织进行研磨,然后使用ACK红细胞裂解液进行裂解,去除红细胞。500 g离心5 min后,将得到的脾脏细胞与荧光直接标记抗体在4 ℃条件下避光孵育细胞30 min,PBS洗涤后进行重悬,上机进行检测。
1.2.8HB14抗体的体内药效评价:将结肠癌MC38细胞以5×105个/0.1 mL接种于雌性B-hCD40小鼠的右侧皮下,待肿瘤生长到约100 mm3时,按肿瘤体积挑选10只小鼠随机分组,每组5只,共2组,分别为溶剂对照PBS组和CD40 Ab(3 mg/kg)组。所有组给药途径均为腹腔注射,每周给药2次,连续给药6次。给药期间和观察期间每周测量2次小鼠体质量和肿瘤体积,并记录测量值。实验结束时,动物安乐死,计算相对肿瘤生长抑制率(TGI)。
1.2.9HB14抗体的体内毒性评价:挑选9只B-hCD40小鼠,按体质量随机分组,每组3只,共3组,分别为PBS溶剂对照组、CD40 Ab(20 mg/kg)组和CD40 Ab(1 mg/kg)组。挑选6只C57BL/6 N小鼠按体质量随机分组,每组3只,共2组,分别为CD40 Ab(20 mg/kg)和CD40 Ab(1 mg/kg)组。所有组给药途径均为尾静脉注射,在第0、3、7、10天给药,共给药4次。给药期间和观察期间每周测量2次小鼠体质量,并记录测量值。第11天取血检测血生化指标谷丙转氨酶ALT和谷草转氨酶AST。第14天结束实验,将小鼠放入10%甲醛固定,用于病理HE染色观察。
1.3 统计学分析
2 结果
2.1 B-hCD40小鼠打靶策略
CD40是一种I型跨膜糖蛋白。小鼠CD40(mCD40)基因位于2号染色体上,小鼠CD40前体蛋白编码289氨基酸(aa),主要由N端信号肽(19aa)、胞膜外区(193aa)、跨膜区(22aa)和细胞质区(74aa)组成。人CD40基因位于20号染色体上,人CD40其前体含有277aa,由N端信号肽(20aa)、胞膜外区(193aa)、跨膜区(22aa)和胞内区(62aa)组成。其中,人CD40蛋白与小鼠CD40蛋白的同源性为61%。本研究中使用人CD40(20aa-192aa)替换小鼠CD4(20aa-192aa),生成嵌合的CD40蛋白,胞内区为鼠源的蛋白,能正常传递细胞内的信号,不影响正常的小鼠生物活性。利用CRISPER/Cas9基因打靶技术,构建针对小鼠CD40基因的sgRNA。5′端sgRNA序列(5′-3′):GACAAACAGTACCT CCACGA;3′端sgRNA序列(5′-3′):CGCATCCGG GACTTTAAACC;5′端和3′端的PAM序列分别为5′TGG和3′TGG。在Cas9系统切开DNA链后通过同源重组将人CD40片段重组到靶位点上,打靶载体图谱如图1所示。同时制作携带人CD40基因片段的打靶载体,与Cas9 mRNA、sgRNA共同显微注射受精卵,移植到假孕雌性的输卵管中,获得F0代小鼠,通过PCR以及测序验证阳性小鼠。
2.2 B-hCD40小鼠杂合子及纯合子的构建
将阳性F0代小鼠和背景鼠(C57BL/6)回交,获得F1代小鼠,通过PCR和测序进行验证。将测序阳性的F1代阳性小鼠(1EJ24-29、1EJ24-31、1EJ24-32、1EJ24-36)再进行southern杂交验证(图2)。A探针(也称5′探针)能够特异性结合人CD40基因片段,小鼠鼠尾基因组DNA通过Spel酶消化后,能被A探针检测到,条带大小为8.8Kb,但是WT的小鼠染色体不能被检测到;3’探针设计在小鼠CD40基因9号外显子下游,小鼠鼠尾基因组DNA通过Stul酶消化后,WT的小鼠染色体和人源化的染色体都能被检测到。获得F1代southern阳性小鼠,将F1代阳性小鼠交配,获得纯合的F2小鼠。
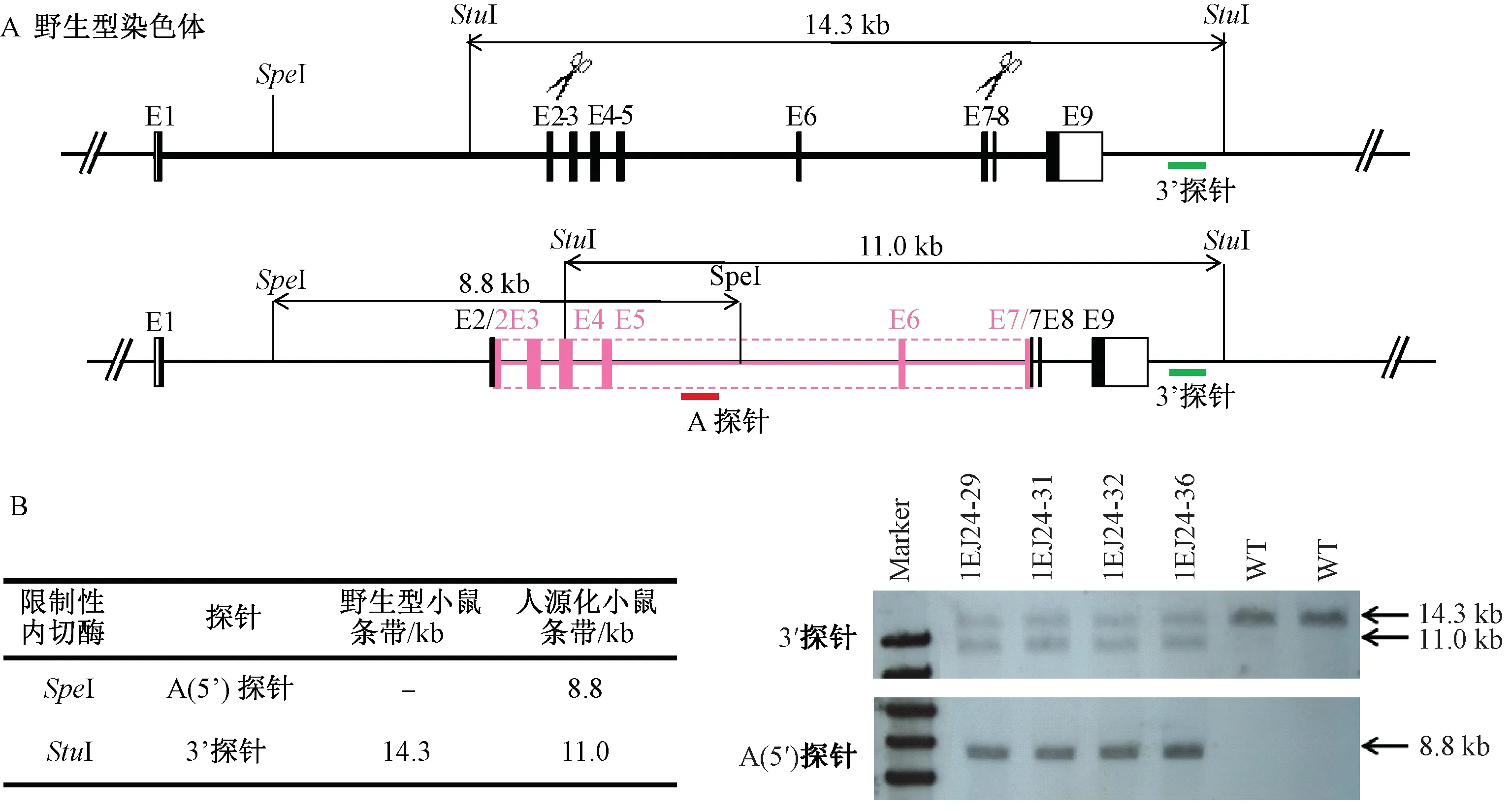
图2 CD40人源化阳性小鼠的构建
2.3 B-hCD40小鼠人CD40的mRNA及蛋白水平鉴定
反转录PCR分析显示人CD40的mRNA在纯合人源化小鼠的脾脏中表达,而在野生型中不表达。小鼠CD40的mRNA仅在野生型小鼠的脾脏组织中表达,在纯合子小鼠中无法检测到,如图3A所示。
在野生型小鼠中,小鼠CD40蛋白经过抗鼠CD40抗体检测后,41.6%的细胞表达小鼠CD40蛋白,而在B-hCD40小鼠中,小鼠CD40蛋白无表达。在纯合B-hCD40小鼠中,人CD40蛋白经过抗人CD40抗体检测后,58.1%的细胞表达人CD40蛋白,而在野生型小鼠中,人CD40蛋白无表达(图3B)。

图3 人CD40在mRNA水平和蛋白水平表达情况
2.4 B-hCD40小鼠各淋巴细胞亚群分布
经过改造后的B-hCD40小鼠的B细胞、T细胞、NK细胞、DC细胞、粒性白细胞、巨噬细胞和单核细胞分布情况与野生型小鼠保持一致,无明显改变(图4A、图4B)。两种小鼠CD4阳性细胞、CD8阳性细胞和Treg细胞在T细胞中分布也无明显改变(图4C)。以上结果共同提示,CD40人源化改造不影响小鼠各淋巴细胞亚群的分布。

图4 B-hCD40小鼠脾脏细胞各淋巴细胞亚群分析
2.5 CD40 Ab抑制肿瘤生长情况
在首次给药后第18天,生理盐水对照组肿瘤平均体积为(2 661±350)mm3,CD40 Ab(3 mg/kg)给药组平均肿瘤体积为(485±195)mm3,TGI为85.8%。相比于溶剂对照组,CD40 Ab给药组肿瘤体积显著减小(P<0.001)(图5A)。以上结果提示,B-hCD40小鼠可以作为评价CD40抗体药效的一种有效动物模型。在CD40 Ab发挥抑制肿瘤生长作用同时,实验动物体质量相比于对照组增加不是很明显(图5B),我们推测CD40 Ab作用小鼠后可能对小鼠自身产生一定毒副作用。
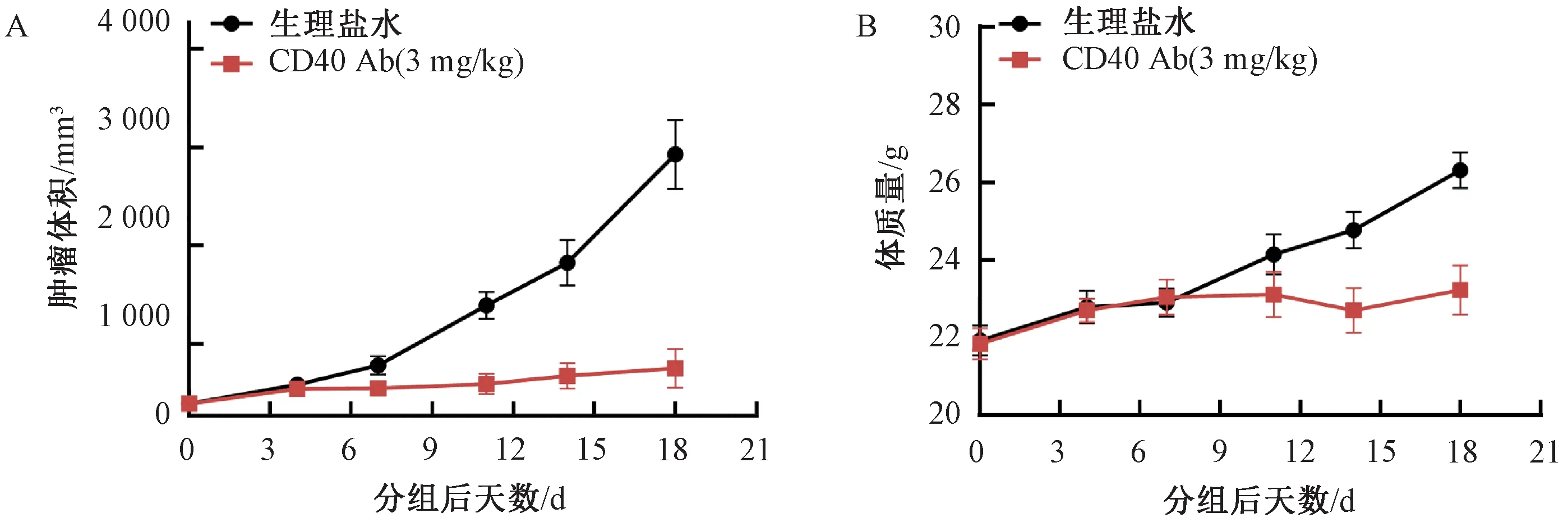
图5 基于B-hCD40小鼠的CD40 Ab药效评价
2.6 CD40 Ab抗体体内毒性评价结果
首次给药后第2、8和12天,CD40 Ab(20 mg/kg)组小鼠体质量与溶剂对照组相比有明显降低(图6A)。首次给药后第11天,CD40 Ab(20 mg/kg)组小鼠ALT和AST水平显著升高(图6B),提示对CD40小鼠肝脏产生一定毒性作用。实验终点小鼠各脏器HE染色结果显示(图6C),CD40 Ab(20 mg/kg)组小鼠肝脏和肾脏中可以明显观察到有炎性细胞聚集,C57BL/6小鼠各给药组均没有这种现象,表明CD40 Ab对B-hCD40小鼠肝脏和肾脏产生了毒性作用。以上结果提示,B-hCD40小鼠可以作为评价CD40抗体药物毒性的一种工具小鼠。
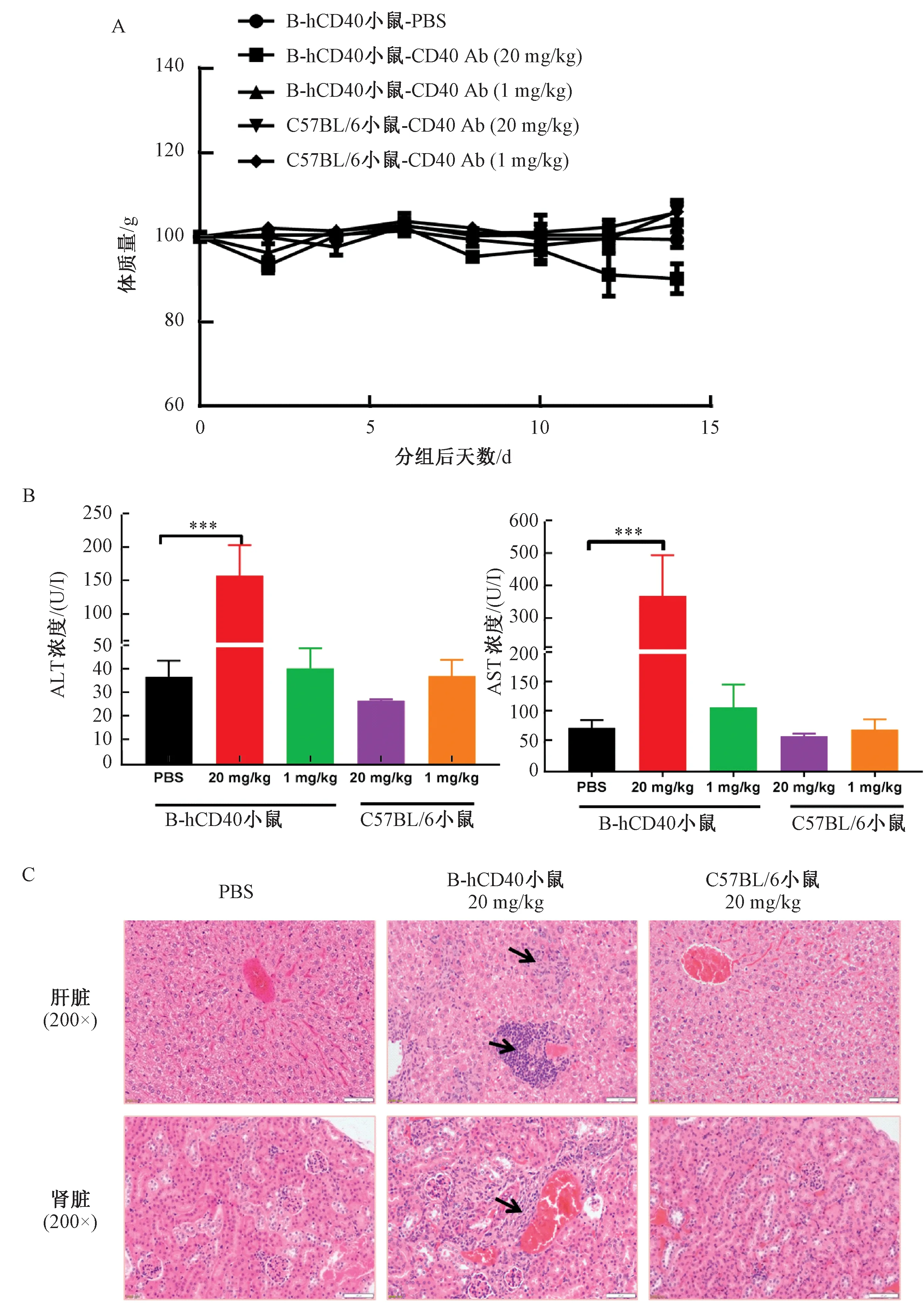
图6 CD40 Ab抗体的毒性作用
3 讨论
B-hCD40小鼠模型可以为在小鼠中验证人单克隆抗体提供一种有效的方法。我们的研究首先构建了靶向B-hCD40小鼠模型,将小鼠CD40基因的胞外区替换为人源组分。B-hCD40小鼠能表达人源胞外区和鼠源跨膜区及鼠源胞内区的嵌合蛋白,保留了小鼠胞内蛋白序列,可以最小化影响小鼠胞内信号的传递。单克隆抗体CD40 Ab靶向的嵌合蛋白的胞外区刚好为人源化的蛋白序列。由于嵌合mRNA来自内源性小鼠启动子的转录,并且改造后的嵌合人/鼠蛋白表达包含小鼠跨膜和胞内结构域,我们推测其对下游信号传递的生理过程的影响极小。RT-PCR和流式细胞术鉴定出人CD40在野生型小鼠中没有表达,但在纯合子小鼠中观察到表达,与野生型小鼠相比,纯合子动物高水平的表达人mRNA和蛋白。小鼠CD40在野生型小鼠中表现出高水平的表达,但在纯合子小鼠中没有表达,这也清楚地表明B-hCD40小鼠模型是成功的。
在单克隆抗体的肿瘤免疫治疗中,T细胞活化需要双重信号的刺激,首先是T细胞抗原受体(TCR)特异性识别MHCI/抗原复合物产生的第一信号,同时需要共刺激分子(如4-1BB-4-1BBL、CD40-CD40 L、CD27-CD27 L和OX40-OX40 L等)活化产生第二信号[12]。CD40作为一类共刺激分子,和受体CD40 L结合后激活APC细胞诱导一系列下游信号通路,介导广泛的免疫及炎症反应。CD40激动剂单克隆抗体在激活APC促进T细胞介导的抗肿瘤免疫同时,也可以激活非T细胞介导的髓系来源细胞的细胞毒作用[13]。我们成功构建B-hCD40小鼠模型后,对HB 14抗体在这种模型上的药效和毒性作用进行了评价。结果显示CD40 Ab能够显著抑制MC38结肠癌肿瘤的生长,并且在发挥药效的同时可能会对小鼠肝脏和肾脏产生一定毒副作用。
目前,用于肿瘤药物开发及应用研究的几种小鼠模型主要包括自发或诱导的小鼠肿瘤模型、基因工程小鼠模型、人源肿瘤细胞系异种移植和人源肿瘤异体移植模型等[14]。通过基因改造获得的免疫检查点人源化小鼠模型由于小鼠免疫系统健全,在评价药效作用同时也可以用于药物毒性评价,并且由于基因改造获得的小鼠模型相对稳定,小鼠批间差异较小,实验重复性较高,对于药物临床前作用评价也很有利。我们的研究表明,B-hCD40小鼠可以作为评价CD40激动剂单克隆抗体药物临床前药效和毒性作用的一种有效动物模型。同时,免疫检查点人源化小鼠模型也具有制备周期长、制备过程复杂等特点,这在一定程度上可能会限制其在疾病基础研究和药物开发中的应用。
