SGLT-2抑制剂联合二甲双胍对糖尿病患者心血管疾病危险因素影响的Meta分析
2021-08-19陈润都孟凡鹏史超凡张梅
陈润都,孟凡鹏,史超凡,张梅
2型糖尿病是一种累及肝脏、肌肉、胰腺β细胞、胰腺α细胞、肠道、脂肪组织、肾脏和大脑的慢性进行性疾病,统称为“不祥的八重奏”[1]。目前治疗中有多种药物可用来控制血糖。目前大多数指南推荐二甲双胍作为2型糖尿病患者的首选药物[2-4]。然而,随着胰岛素抵抗的加剧和β细胞功能的下降,单用二甲双胍往往不足以达到所需葡萄糖水平。钠葡萄糖转运蛋白-2抑制剂是在单用二甲双胍对患者血糖控制难以达到较好的临床疗效时较好的一种选择。SGLT-2抑制剂在肾脏近端小管中特异性地抑制SGLT-2受体,导致葡萄糖排泄增加从而阻止葡萄糖的重吸收,达到控制血糖的作用[5]。近年来,研究人员发现在二甲双胍治疗糖尿病的基础上加用SGLT-2抑制剂具有较好的控制血压、血脂、血糖及体重等心血管疾病危险因素[6]。为了进一步研究二甲双胍联用SGLT-2抑制剂对于心血管疾病危险因素的影响,本研究尽可能全面地收集数据并进行系统评价,以期为将来的临床治疗提供一定的循证医学依据。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型纳入RCT,不限制是否使用盲法。
1.1.2 研究对象年龄>18岁,以WHO或美国糖尿病协会(ADA)标准确诊为糖尿病。
1.1.3 干预措施试验组SGLT-2抑制剂联合使用二甲双胍,对照组则单独使用二甲双胍治疗。
1.1.4 结局指标糖化血红蛋白(HbA1c)、空腹血糖(FPG)、收缩压(SBP)和舒张压(DBP)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)较基线的变化、三酰甘油(TG)。
1.1.5 排除标准①重复发表文献;②未充分地提供原始数据且向其原作者索取原始数据无果;③疗程<12周;④样本量小于10例。
1.2 文献检索策略计算机检索The Cochrane Library、PubMed、中国期刊全文数据库、万方数据库,人工检索Google Scholar、CNKI、VIP等数据库检索并纳入符合要求的文献,检索时限为 2010年1月~至今。中文检索式:“SGLT-2抑制剂”、“二甲双胍”、“心血管”;英文检索式:“Sodium-glucose transporter 2 inhibitor”、“Metformin”、“Cardiovascular risk factors”、“Hypertension”。
1.3 文献筛选与数据提取资料的收集分别由两名系统评价员独立完成,如出现意见分歧,则通过协商解决或由第三名系统评价员解决。
1.4 文献质量评价两名研究员采用改良版 Jadad评分量表对纳入文献实施质量评估,评分量表共包含 4个条目:①随机序列的产生(0~2分:恰当2分,不清楚1分,不恰当0分);②随机化隐藏(0~2分:恰当2分,不清楚1分,不恰当0分);③盲法(0~2分:恰当2分,不清楚1分,不恰当0分);④撤出与退出(0~1分:有描述1分,未描述0分)。其中总分为7分,1~3分为低质量研究,4~7分为高质量研究。
1.5 偏倚风险评估采用《Cochrane干预措施系统评价手册》的偏倚风险评估标准进行偏倚风险评估,评估内容包括:随机分配方法、隐蔽分组、盲法、不完整资料偏倚结果、报告完整性、其他潜在影响真实性的因素。
1.6 统计学分析采用Revman 5.3软件行统计学分析,各纳入研究结果间的异质性分析采用χ2检验,结合I2定量判断异质性的大小。若异质性较小(P>0.1,I2<50%),选用固定效应模型。若异质性较大(P<0.1,I2>50%),选用随机效应模型,并通过改变效应模型从而对结局指标进行敏感性分析。
2 结果
2.1 纳入文献信息及文献质量评价初步检索得到文献260篇,通过阅读题目、摘要,根据纳入和排除标准、干预和对照措施阅读全文进行筛选,最终得到文献11篇[6-16],共纳入患者5115例。文献具体筛选过程(图1),基本信息及质量评价情况见表1。

表1 文献基本信息
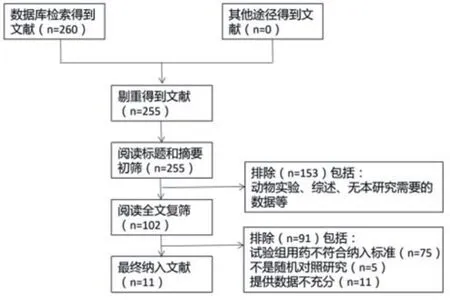
图1 文献筛选流程图
2.2 偏倚风险评价纳入的11项研究,均为在国外开展的多中心随机对照RCT。各纳入研究均对患者基线情况进行了报道,均在文中提及了“随机”。11项研究均为多中心RCT,随机分组方案明确;各个纳入研究均对资料收集过程和分析人员进行盲法的实施;各研究数据报告均完整,且均对数据的缺失原因进行了描述。纳入研究的偏倚风险见图2。
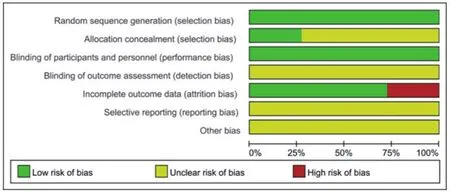
图2 纳入研究的偏倚风险图
2.3 Meta分析结果
2.3.1 ΔSBP纳入的文献中有11项研究[6-16]比较了两组治疗后的SBP水平。异质性检验结果显示各研究间有统计学异质性(P<0.05),采用随机效应模型进行Meta分析。结果显示,EMPA联合二甲双胍治疗组与对照组比较(WMD=-3.43,95%CI:-4.17~-2.68,P<0.05),CANA联合二甲双胍治疗组与对照组比较(WMD=-2.55,95%CI:-3.32~-1.78,P<0.05),DAPA联合二甲双胍治疗组与对照组比较(WMD=-3.44,95%CI:-4.76~-2.12,P<0.05),IPRA联合二甲双胍治疗组与对照组比较(WMD=-2.97,95%CI:-4.66~-1.29,P<0.05),SBP水平变化差异均有统计学意义(WMD=-2.99,95%CI:-3.68~-2.30,P<0.05),图3。

图3 两组ΔSBP比较的Meta分析森林图
2.3.2 ΔDBP纳入文献中有10项研究[6-15]比较了两组治疗后的DBP水平。异质性检验结果显示各研究间有统计学异质性(P<0.05),采用随机效应模型进行Meta分析。结果显示,EMPA联合二甲双胍治疗组与对照组比较(WMD=-2.61,95%CI:-3.36~-1.86,P<0.05),CANA联合二甲双胍治疗组与对照组比较(WMD=-0.85,95%CI:-1.18~-0.53,P<0.05),DAPA联合二甲双胍治疗组与对照组比较(WMD=-1.63,95%CI:-2.11~-1.15,P<0.05),IPRA联合二甲双胍治疗组与对照组比较(WMD=-1.99,95%CI:-3.22~-0.75,P<0.05),DBP水平变化差异均有统计学意义(WMD=-1.63,95%CI:-2.01~-1.26,P<0.05),图4。
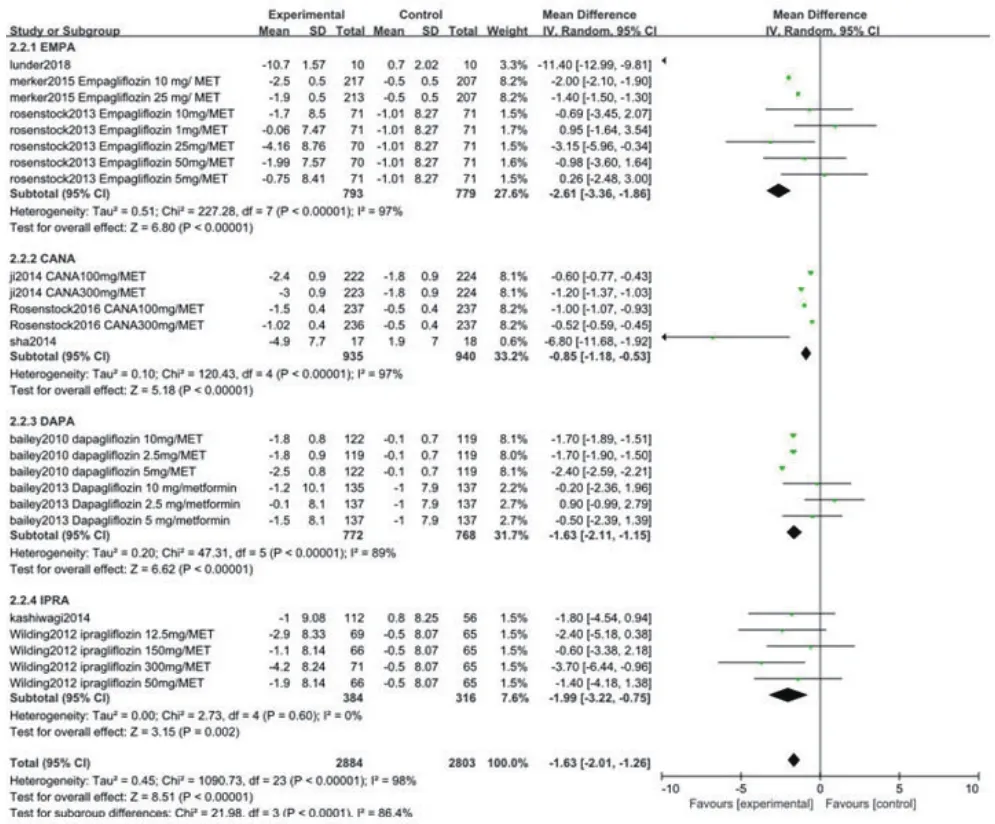
图4 两组ΔDBP比较的Meta分析森林图
2.3.3 HbA1c纳入的文献中有8项研究[6,8-11,13-15]比较了2组治疗后的HbA1c水平。异质性检验结果显示各研究间有统计学异质性(P<0.05),采用随机效应模型进行Meta分析。结果显示,EMPA联合二甲双胍治疗组与对照组比较(WMD=-0.58,95%CI:-0.66~-0.50,P<0.05),CANA联合二甲双胍治疗组与对照组比较(WMD=-0.48,95%CI:-0.48~-0.47,P<0.05),DAPA联合二甲双胍治疗组与对照组比较(WMD=-0.51,95%CI:-0.63~-0.39,P<0.05),IPRA联合二甲双胍治疗组与对照组比较(WMD=-0.54,95%CI:-0.93~-0.16,P<0.05),两组HbA1c水平变化差异均有统计学意义(WMD=-0.54,95%CI:-0.60~-0.48,P<0.00001),图5。
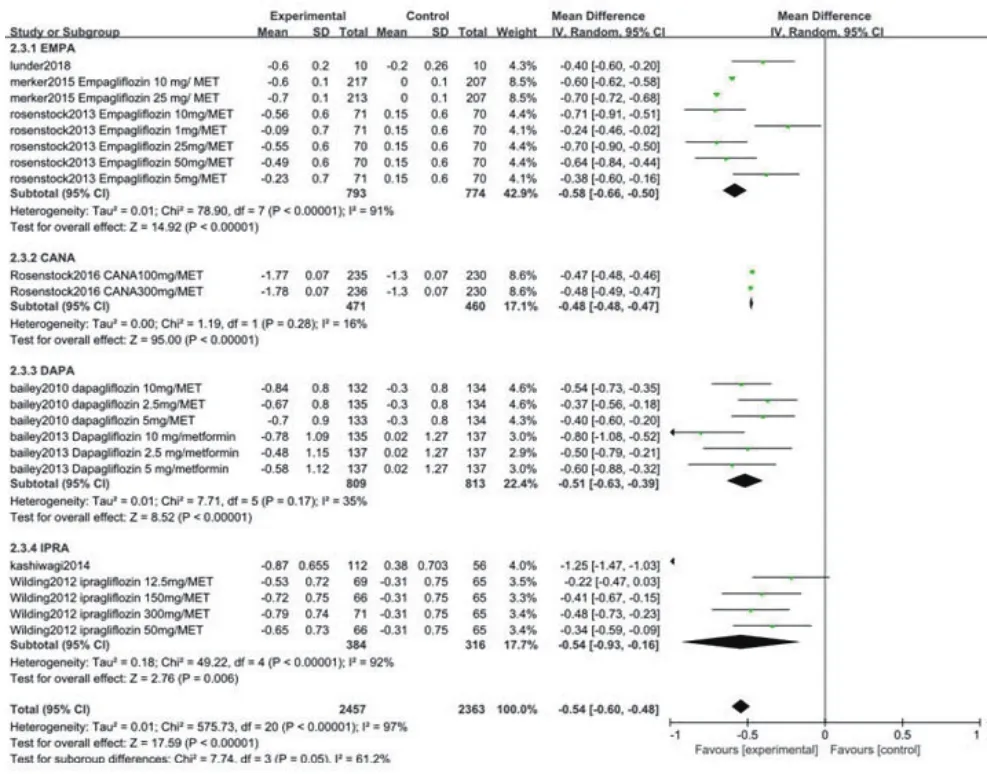
图5 两组ΔHbA1c比较的Meta分析森林图
2.3.4 FPG纳入文献中有7项研究[6,9-11,13-15]比较了两组治疗后的FPG水平。异质性检验结果显示各研究间有统计学异质性(P<0.05),采用随机效应模型进行Meta分析。结果显示,EMPA联合二甲双胍治疗组与对照组比较(WMD=-1.47,95%CI:-1.73~-1.20,P<0.05),CANA联合二甲双胍治疗组与对照组比较(WMD=-1.10,95%CI:-1.30~-0.90,P<0.05),DAPA联合二甲双胍治疗组与对照组比较(WMD=-1.13,95%CI:-1.48~-0.77,P<0.05),IPRA联合二甲双胍治疗组与对照组比较(WMD=-1.16,95%CI:-1.67~-0.64,P<0.05),两组FPG水平变化差异有统计学意义(WMD=-1.25,95%CI:-1.43~-1.07,P<0.05),图6。

图6 两组ΔFPG比较的Meta分析森林图
2.3.5 HDL纳入文献中有5项研究[6,7,9,11,14]比较了两组治疗后的HDL水平。异质性检验结果显示各研究间有统计学异质性(P<0.05),采用随机效应模型进行Meta分析。结果显示,EMPA联合二甲双胍治疗组与对照组相比较(WMD=0.07,95%CI:0.05~0.09,P<0.05),CANA联合二甲双胍治疗组与对照组相比较(WMD=0.06,95%CI:0.04~0.07,P<0.05),DAPA联合二甲双胍治疗组与对照组相比较(WMD=0.03,95%CI:0.02~0.05,P<0.05),IPRA联合二甲双胍治疗组与对照组相比较(WMD=0.10,95%CI:0.03~0.17,P<0.05),两组HDL水平变化差异均有统计学意义(WMD=0.05,95%CI:0.04~0.07,P<0.05),图7。
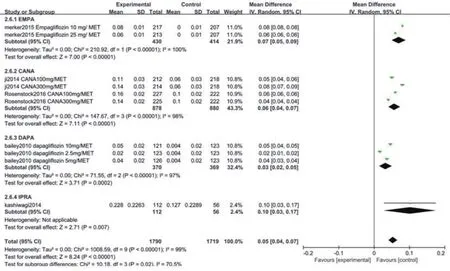
图7 两组ΔHDL比较的Meta分析森林图
2.3.6 LDL纳入文献中有5项研究[6,7,9,11,14]比较了两组治疗后的LDL水平。异质性检验结果显示各研究间有统计学异质性(P<0.05),采用随机效应模型进行Meta分析。结果显示,EMPA联合二甲双胍治疗组与对照组相比较(WMD=0.12,95%CI:0.11~0.13,P>0.05),CANA联合二甲双胍治疗组与对照组相比较(WMD=0.12,95%CI:-0.01~0.25,P>0.05),DAPA联合二甲双胍治疗组与对照组相比较(WMD=0.07,95%CI:-0.04~0.17,P>0.05),IPRA联合二甲双胍治疗组与对照组相比较(WMD=0.01,95%CI:-0.15~0.17,P<0.05),两组LDL水平变化差异有统计学意义(WMD=0.10,95%CI:0.04~0.15,P<0.05),图8。

图8 两组ΔLDL比较的Meta分析森林图
2.3.7 ΔTG纳入文献中有5项研究[6,7,9,11,14]比较了两组治疗后的TG水平。异质性检验结果显示各研究间有统计学异质性(P<0.05),采用随机效应模型进行Meta分析。结果显示,EMPA联合二甲双胍治疗组与对照组相比较(WMD=0.01,95%CI:-0.03~0.05,P>0.05),CANA联合二甲双胍治疗组与对照组相比较(WMD=-0.26,95%CI:-0.45~-0.07,P<0.05),DAPA联合二甲双胍治疗组与对照组相比较(WMD=-0.15,95%CI:-0.20~-0.10,P<0.05),IPRA联合二甲双胍治疗组与对照组相比较(WMD=-0.20,95%CI:-0.46~0.05,P>0.05),两组TG水平变化差异有统计学意义(WMD=-0.17,95%CI:-0.25~-0.08,P<0.05),图9。
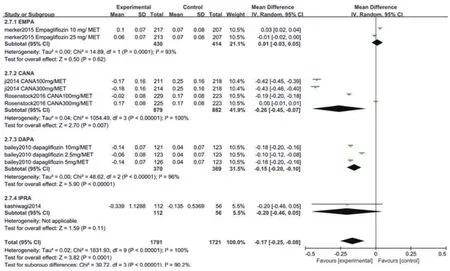
图9 两组ΔTG比较的Meta分析森林图
2.4 发表偏倚分析针对SGLT-2抑制剂联合MET治疗对心血管疾病风险因素的影响进行发表偏倚风险分析,结果见图10。从漏斗图可看出,左右基本对称,发表偏倚风险较低。此外,应用Stata 14.0软件对制作的漏斗图进行发表偏倚检验,结果得出P值>0.05,没有明显的发表偏倚。显示评估发表偏倚风险的Egger's分析图见图11。
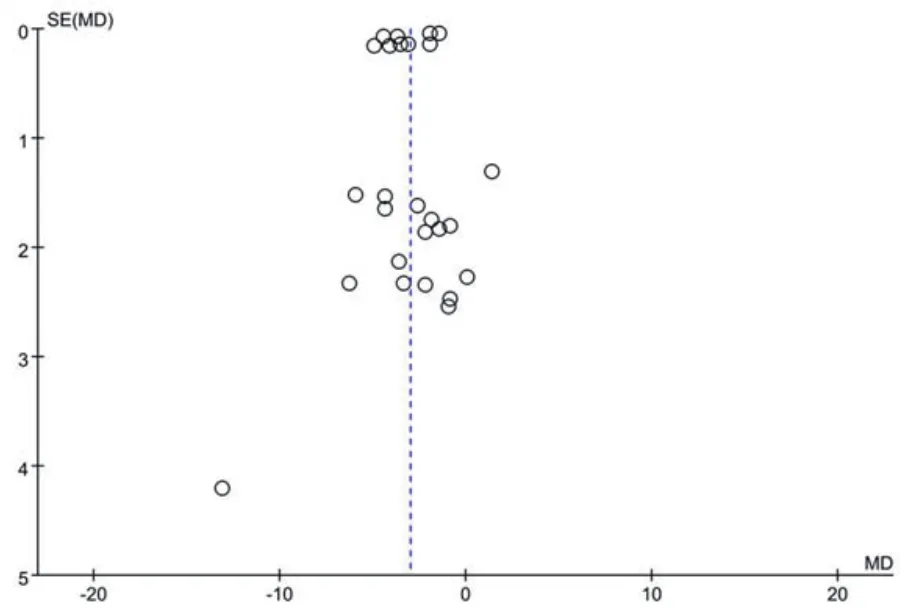
图10 发表偏倚风险分析图
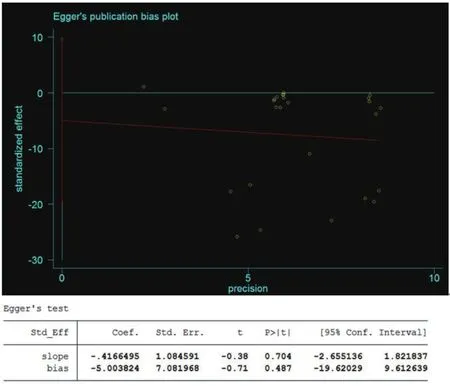
图11 发表偏倚风险egger分析图
2.5 异质性分析及敏感性分析为进一步探索异质性的来源,针对SGLT-2抑制剂联合MET治疗对心血管疾病风险因素的影响进行Meta回归分析(表2)。主要纳入的变量包括年龄、二甲双胍的剂量、药物剂量、药物种类、高血压情况、糖尿病类型、研究年份、纳入的病例数量等。从结果来看,“研究年份”和“疗程”可能是异质性的来源(P值分别为0.011和0.001,具有统计学意义)。随后进行敏感性分析发现,各个单项研究在剔除后对于总体结果的影响均不大,证明结果具有一定稳定性(图12)。
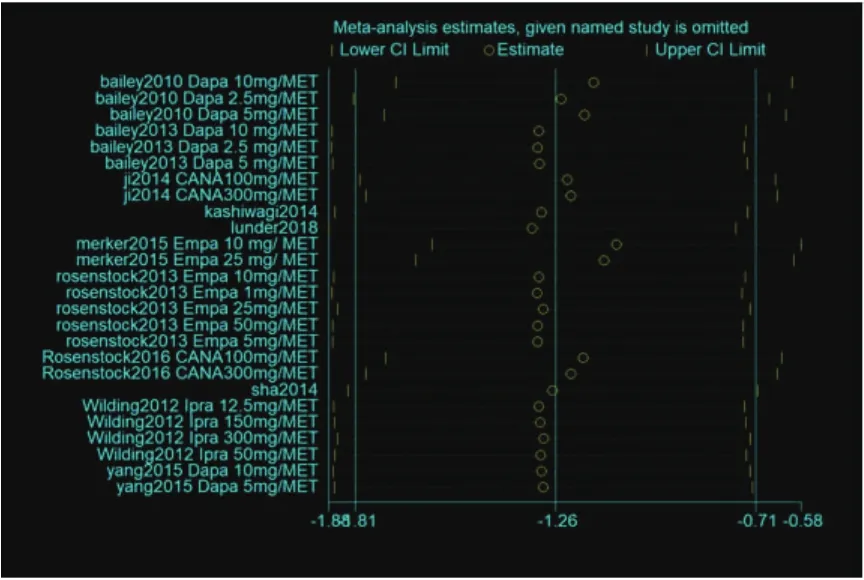
图12 敏感性分析
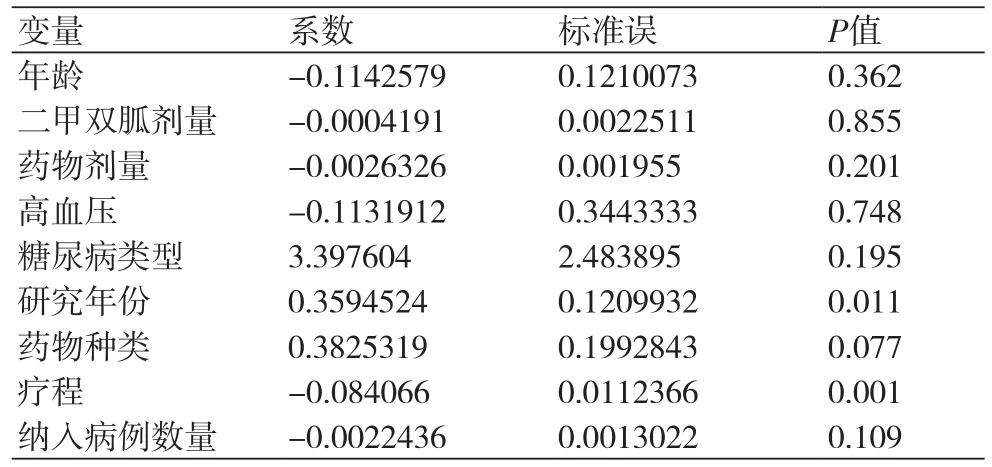
表2 Meta回归分析
3 讨论
此Meta分析发现,SGLT2抑制剂联合二甲双胍进行临床治疗,在控制多数心血管疾病危险因素(包括HbA1c、FPG、SBP/DBP、HDL、TG)方面明显优于单独使用MET的对照组。然而分析结果也显示,SGLT2抑制剂联合二甲双胍的治疗方法对于LDL的控制效果比起单独使用二甲双胍较差。对于T2DM的治疗,当生活方式和饮食干预仍不足以控制疾病时,二甲双胍是首选药物[17]。随着疾病进展,单独使用二甲双胍治疗并不能达到理想的效果。
SGLT2抑制剂在改善血糖控制、血压和体重方面的效果也在其他Meta分析综述中有报道,现已有了明确定义[18]。安全性问题,尤其是生殖道感染的高发病率,也在文献中得到了广泛关注,一般认为尿糖高是主要的致病因素;而免疫功能减弱也可能是潜在病因[19]。在SGLT2抑制剂治疗过程中,严重的安全问题,如骨折、肾盂炎、泌尿系败血症和酮症酸中毒等很少出现。相反对于联合使用SGLT2抑制剂的糖尿病患者而言,此种治疗方案可强有力地改善其心血管功能。总体来说,这类口服抗糖尿病药物是对糖尿病患者治疗方案的一个有价值的补充,可成为未来的一个重要治疗方法[20]。加拿大一项研究显示,在二甲双胍和磺脲类药物基础上加用DANA比加用西格列汀在结局和费用上更有优势[21]。
本研究发现,SGLT2抑制剂具有一定升高LDL的作用,很多大范围、长时间的随机对照研究均发现SGLT2抑制剂会轻微升高LDL,在基线LDL在90~110 mg/dl间的2型糖尿病患者中,达格列净10 mg组增加约5%,恩格列净10 mg组和25mg组分别增加2.4%和3.1%[22]。而坎格列净的增加幅度略高,每天服用100 mg的患者,平均LDL增加4%~5%。但由于SGLT2抑制剂对于HDL亦有一定升高作用,LDL/HDL比值并无明显变化[23]。
既往有研究者对SGLT2抑制剂影响血脂的内在机制进行了探究:在接受SGLT2抑制剂治疗后LDL有轻微上升,不仅是由于尿钠排泄增加引起的血液浓缩,也是由于LDL受体在肝细胞表面表达减少所致。在一项对仓鼠的研究[20]中,恩格列净处理导致了肝细胞胆固醇代谢的变化,特别是在禁食状态下。与安慰剂组相比,恩格列净处理组显著提高了LDL-C水平。肝羟甲基戊二酰辅酶A(HMG-CoA)还原酶活性比对照组高31%。已知肝LDL受体的表达受细胞内胆固醇浓度的控制,HMG-CoA还原酶活性是细胞内胆固醇形成的主要调节因子。事实上与安慰剂治疗的仓鼠相比,实验组仓鼠肝LDL受体表达降低20%,可能是由于HMG-CoA还原酶活性增加和细胞内胆固醇形成增加所致。结果表明,恩格列净通过降低肝LDL分解代谢并增加合成代谢而提高血清LDL-C水平。此外,SGLT-2抑制剂治疗后的脂质氧化水平升高和胰高血糖素/胰岛素比值的增加也可能导致细胞内乙酰辅酶A水平的升高[21]。乙酰辅酶A水平升高可能导致细胞内胆固醇形成(由于HMG-COA还原酶活性的提高),从而导致肝细胞表面LDL受体表达减少和血清LDL-C水平升高。另一方面,SGLT-2抑制剂给药后HDL-C和TG水平也得到了改善,可能与胰岛素敏感性和胰岛素分泌的增加有关[22]。
不可忽略的是,本研究存在一定局限性。各研究间多存在显著的异质性。在Meta回归分析中,我们找到引起异质性来源的可能原因,可能是“研究年份”和“疗程”两项。而另外的一些变量,如年龄、二甲双胍的剂量、药物剂量、药物种类、高血压情况、糖尿病类型、纳入的病例数量等因素则不是引起异质性的原因。其次,纳入的各研究药物用法用量及疗程并不完全一致,不同剂量及疗程可产生不同程度的疗效,而过短疗程也可导致对临床结局的判断不充分。故本研究结果尚需更多大样本、高质量RCT来进一步验证。
总之,根据此次研究的结果分析来看,在单独使用二甲双胍时临床效果不佳时,加用SGLT2抑制剂类的药物除了可以更加有效地控制血糖外,同时可以更加有效地控制SBP、DBP、HDL、TG、BW、TG等心血管疾病危险因素。这一研究结果或许可以对于将来的临床用药方案具有一定的参考价值。
