血清外泌体miR-23b对STEMI患者行PCI后发生院内主要不良心血管事件的预测价值
2021-08-19杨洋李天发黄珊王军凌学斌
杨洋,李天发,黄珊,王军,凌学斌
急性心肌梗死是发生于不稳定冠状动脉(冠脉)粥样硬化斑块形成后的冠脉疾病,是临床最严重的医疗急症之一[1],主要治疗方法是尽快恢复冠脉灌注,减少心肌梗死面积[2,3]。然而由于患者的易感因素,如心肌损伤、炎症和血栓形成倾向等,有些患者在经皮冠状动脉介入治疗(PCI)后易发生反复性心绞痛或冠脉再狭窄[4]。目前尚缺乏高度敏感和特异的方法来监测临床状况和评估心肌梗死患者的预后。循环微小RNA(miRNAs)可主动或被动地作为细胞间通讯介质释放,有望成为评估疾病进展的非侵入性生物标志物[5]。研究证实,miR-23b是炎症反应中一种重要调节因子[6]。本研究中,我们旨在探索ST段抬高型心肌梗死(STEMI)完成PCI后血清外泌体miR-23b表达变化及与短期预后的关系。
1 资料与方法
1.1 研究对象选取2019年5月至2020年5月于海南医学院第一附属医院心血管内科治疗的STEMI患者103例,男:女为1.86:1;年龄37~87岁,平均年龄(62.48±13.55)岁,均在症状出现后12 h内入院。患者均为初次诊断并接受直接PCI。缺血性胸痛持续>30 min,心脏生物标志物升高[心肌肌钙蛋白(cTnI)>0.06 ng/ml和/或肌酸激酶同工酶MB(CK-MB)>16 IU/L],ECG显示ST段抬高>1 mm,至少有2条连续心电图导联,或新发左束支阻滞。根据是否发生院内主要不良心血管事件(MACE)[7]将患者分为MACE组和非MACE组。排除标准:过去24 h内应用溶栓药物;入院时已发生心源性休克、合并活动性感染或既往证实的全身炎症病史,已知恶性肿瘤、肝脏疾病、肾衰竭者。另从我院健康体检中心招募同时期48例健康志愿者,男:女为1.67:1;年龄为35~84岁,平均年龄(63.31±13.75)岁,排除其他确定性疾病(如高血压、高脂血症或心脑血管疾病)。所有参与者均签署知情同意书,本研究经我院医学伦理委员会批准。
1.2 血清外泌体提取和鉴定在STEMI患者入院时(PCI术前)及术后1 d内(≤24 h)、2~3 d(48~72 h)、4~7 d时采集血液样本。还收集了对照组的空腹血液样本3.5 ml。室温下3500 r/min立即离心5 min,将血清储存在 -80℃直至RNA 提取。抽取患者静脉血在4℃条件下通过离心清除细胞碎片。加入Exo快速外显体沉淀试剂(System Biosciences公司,美国)再次离心后,用0.22 μm滤膜过滤上清液,冻存1 h,在10 000 r/min超速离心得到外泌体颗粒。将外泌体颗粒重悬于PBS中,用透射电镜观察外泌体颗粒形态,纳米粒径跟踪分析颗粒大小分布并通过蛋白免疫印迹法检测标志蛋白分子CD63、CD9、Calnexin表达。
1.3 采用实时荧光定量PCR法检测miR-23b表达用miRNeasy Mini试剂盒(Qiagen公司,德国)从外泌体中提取miRNAs后,然后在每个样品中加入5 μl 0.26 nmol/L cel-miR-39用作内参。由AMV反转录试剂(Takara公司,日本)和TaqMan引物(Takara公司,日本)转录成cDNA,最后用SYBR Green PCR Master Mix试剂盒(Takara公司,日本)进行PCR。循环条件为:95℃ 30 s,95℃ 15 s,62℃ 30 s,共35个循环。用2-ΔΔCt法以U6为内参计算miR-23b的相对表达量。miR-23b的正向引物为 5'-GAT GGT CGC ACA GCG TCT TC-3',反向引物为 5'-CAA GTC AGG AGA CCG TCA GG-3'。
1.4 统计学处理统计分析使用SPSS 19.0软件。计量资料采用均数±标准差()表示,进行独立样本t检验和重复测量的方差分析。计数资料以例数(构成比)表示,组间比较采用χ2检验。采用单变量和多变量Logistic回归分析评估独立的预后因素。应用受试者-操作特征(ROC)曲线分析外泌体miR-23b预测MACE曲线下面积(AUC)。P<0.05为差异有统计学意义。
2 结果
2.1 血清外泌体形态学和生化特征透射电镜显示回收的囊状小泡为球形结构,多数粒子直径在50~150 nm间。通过western blot法检测标记分子,出现了CD63、CD9特异性条带,另外calnexin呈阴性表达,说明这些囊泡是是外泌体(图1)。
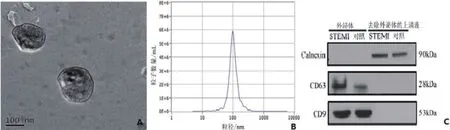
图1 血清外泌体形态学和生化特征
2.2 STEMI患者血清外泌体miR-23b表达量变化与健康志愿者相比,STEMI患者PCI前血清外泌体miR-23b相对表达量升高(1.31±0.42)vs. (1.00±0.11),P<0.05。对于STEMI患者,PCI后1 d内(≤24 h)外泌体miR-23b相对表达量达到峰值,随后在PCI术后2~3 d(48~72 h)、4~7 d时外泌体miR-23b相对表达量逐渐降低,直至逐渐接近健康志愿者的水平。
2.3 MACE组和非MACE组患者一般资料比较103例STEMI患者中,21例发生院内MACE(死亡1例、严重心律失常3例、复发心绞痛11例、再发心肌梗死3例、急性心力衰竭2例、卒中1例)其余82例入非MACE组。所有患者PCI后都达到TIMI3级血流;MACE组吸烟史、高血压、糖尿病史比例高于非MACE组,差异有统计学意义(P<0.05),比较两组其他临床因素和PCI特征,差异无统计学意义(P>0.05),表1。

表1 比较MACE组和非MACE组患者一般资料
2.4 比较MACE组和非MACE组患者血清外泌体miR-23b表达量变化采用重复测量设计的方差分析比较两组患者各时间点外泌体miR-23b相对表达量,①不同时间点外泌体miR-23b相对表达量存在统计学差异(F时间=114.108,P<0.05)。②两组患者外泌体miR-23b相对表达量比较存在统计学差异(F组别=51.905,P<0.05),各时间点MACE组患者外泌体miR-23b相对表达量均高于非MACE组(P<0.05)。③两组外泌体miR-23b相对表达量变化趋势存在统计学差异(F组别×时间=21.152,P<0.05),表2。

表2 比较MACE组和非MACE组患者血清外泌体miR-186相对表达量变化
2.5 血清外泌体miR-23b对STEMI患者行PCI后短期发生MACE的预测价值经ROC曲线分析发现,PCI后1 d内血清外泌体miR-23b预测STEMI患者行PCI后短期发生MACE的AUC最高,与其他3个时间点相比,差异有统计学意义(P<0.001),图3及表3。

图2 STEMI患者血清外泌体miR-23b表达变化趋势(注:与健康志愿者相比,*P<0.05;与STEMI患者PCI术前基线值相比,#P<0.05)

图3 血清外泌体miR-23b预测STEMI患者行PCI术后短期发生MACE的ROC曲线

表3 血清外泌体miR-23b对STEMI患者行PCI术后短期发生MACE的预测价值
2.6 多因素Logistic回归分析影响STEMI患者PCI后发生院内MACE的危险因素以MACE作为因变量(赋值MACE=1,非MACE=0),将上述存在差异的统计学变量纳入Logistic回归模型,经多因素Logistic回归分析,PCI后1 d内(≤24 h)血清外泌体miR-23b表达量升高是STEMI患者PCI后发生MACE的独立预测因素(P<0.05),表4。

表4 多因素Logistic回归分析影响STEMI患者PCI术后发生院内MACE的临床因素
3 讨论
随着人们生活方式改变和人口老龄化的影响,心血管疾病在我国的患病率不断上升,约2.9亿人受到心血管疾病的影响,包括STEMI在内的心血管疾病呈上升趋势,是我国死亡的主要原因[8]。STEMI是生理学基础为冠脉不稳定斑块破裂、糜烂基础上继发血栓形成所导致的冠脉血管持续、完全闭塞的急性心肌缺血坏死,有较高的致死率[9]。目前,急诊PCI是临床上治疗STEMI的主要血运重建策略[10],由于患者易感因素,如心肌损伤、炎症性疾病和血栓形成倾向等,STEMI患者在PCI后二次心血管事件的残留风险仍很高[11]。目前尚缺乏高度敏感和特异的方法来监测临床状况和评估急性冠脉综合征患者的预后。
循环的miRNAs被认为是早期预测心血管事件的潜在生物标志物。越来越多证据表明,特异性 miRNA表达可方便有效地提供反映再灌注后患者疾病进展的信息[12]。如众多心源性miRNAs(miR-1、miR-499、miR-208a等)被证实是急性心肌梗死的关键生物标志物[13]。此外,微囊包裹在外泌体或微泡内可能通过靶向不同类型的细胞,如内皮细胞和心肌细胞,促进心脏病理生理学变化[14]。本研究中发现STEMI患者入院时血清外泌体miR-23b相对表达量高于对照人群,说明STEMI患者在发病12 h内血清外泌体miR-23b相对表达量即出现普遍升高。He等[15]研究发现miR-23b作为特异性miRNA可能参与斑块破裂和内皮侵蚀,导致从无症状性硬化或稳定冠心病突然转变为急性心肌梗死。He等发现蒙古族人群中血清miR-23b表达量升高是心血管疾病发生的独立危险因素,可能与miR-23b引起的ATP结合盒转运蛋白家族a1减少导致心血管疾病高危人群总胆固醇的大量积累有关。miR-23b过表达增强了氧化型低密度脂蛋白(ox-LDL)诱导的THP-1源性巨噬细胞的炎症反应。miR-23b通过靶向A20调控核因子-kappa B(NF-κB)炎症通路,增加了巨噬细胞促炎细胞因子的分泌,加速动脉粥样硬化病变的进展,导致急性心肌梗死的发生。我们认为STEMI患者血清外泌体miR-23b水平升高可能是斑块脆弱性加重的潜在指标。
我们还关注了STEMI患者PCI后1周内miR-23b的动态变化。PCI后1 d内血清外泌体miR-23b水平骤然升高,随后逐渐降低,尤其是非MACE组患者,PCI后4~7 d时血清外泌体miR-23b相对表达量逐渐恢复至对照志愿者的水平。PCI后1 d内检测血清外泌体miR-23b相对表达量对MACE的预测效能最高,经多因素Logistic回归分析,PCI后1 d内(≤24 h)血清外泌体miR-23b表达量升高是STEMI患者PCI后发生MACE的独立预测因素。及时的冠脉再通和心肌再灌注可有效限制坏死范围和梗死面积。STEMI患者PCI前后血清外泌体miR-23b水平的变化表明,药物干预能及时抢救心肌组织,保护心脏功能,改善临床结果。因此,血清miR-23b可作为监测STEMI患者临床状况和评估预后的可靠生物标志物。巨噬细胞的活化和炎症被广泛发现是由miRNAs调节的,包括miR-125a-5p和miR-155等。miR-23b也被证明在参与动脉粥样硬化进程中有调节内皮功能障碍,加重炎症反应进程有关。红斑狼疮或类风湿性关节炎的患者中,miR-23b被发现下调,且抑制了由肿瘤坏死因子α诱导的NF-κB信号通路的激活和炎性细胞因子的表达。本研究中,miR-23b表达量升高能够良好预测MACE的发生风险可能与炎症因素相关。
总而言之,miR-23b对于STEMI患者PCI后发生院内MACE具有较好的预测价值,检测PCI后1 d内血清外泌体miR-23b可用于识别预后较差的高危患者,据此调整治疗方案,为STEMI患者的病情评估、治疗及预后提供了新的视角。
