甘露糖对乳癌细胞增殖及表柔比星化疗敏感度影响
2021-08-18衣俊羽王圆媛刘相萍聂卫红刘加秀王海波
衣俊羽 王圆媛 刘相萍 聂卫红 刘加秀 王海波
[摘要] 目的 探讨甘露糖对乳癌细胞增殖及表柔比星(EPI)化疗敏感性的影响。
方法 免疫印迹法测定乳癌细胞(BT-549、HCC1937、T-47D、MCF-7)和正常乳腺细胞(MCF-10A细胞)代谢甘露糖的关键蛋白磷酸甘露糖异构酶(MPI)的表达。将MCF-7和T-47D细胞随机分为对照组(含体积分数0.10胎牛血清的普通培养液)、甘露糖组(25 mmol/L甘露糖)、葡萄糖组(25 mmol/L葡萄糖)、EPI组(1 μmol/L EPI)、甘露糖联合EPI组(1 μmol/L EPI+25 mmol/L甘露糖)和葡萄糖联合EPI组(1 μmol/L EPI+25 mmol/L葡萄糖),各组分别加入含相应药物培养液,于有氧条件和乏氧条件下培养,采用噻唑蓝(MTT)比色法测定甘露糖及甘露糖联合EPI对细胞生长活性的影响,免疫印迹法检测对照组、甘露糖及葡萄糖组T-47D细胞凋亡相关蛋白Caspase-3、Caspase-8、Bax和Bcl-2的表达。
结果 MCF-10A、BT-549、HCC1937、T-47D和MCF-7细胞中MPI表达差异有统计学意义(F=392.680,P<0.05)。与MCF-10A细胞相比,T-47D细胞MPI表达量相对较低,MCF-7细胞表达相对较高,差异有统计学意义(t=25.449、32.857,P<0.05)。有氧条件下,甘露糖组T-47D细胞增殖率较对照组明显降低(t=33.338,P<0.05),MCF-7细胞增殖率与对照组比较差异无显著性(P>0.05);甘露糖联合EPI组T-47D细胞增殖率显著低于EPI单药组,差异有统计学意义(t=22.901,P<0.05);甘露糖联合EPI组与对照組相比MCF-7细胞增殖率差异无统计学意义(P>0.05)。乏氧条件下,甘露糖组T-47D细胞和MCF-7细胞增殖率较对照组显著降低(t=24.538、35.158,P<0.05),甘露糖联合EPI组T-47D和MCF-7细胞增殖率低于EPI单药组(t=37.986、54.622,P<0.05)。与空白对照组相比较,各加药组T-47D细胞Caspase-3、Caspase-8、Bax、Bcl-2蛋白表达差异无显著性(P>0.05)。
结论 甘露糖能抑制乳癌细胞增殖,并增加乳癌细胞对EPI敏感性,MPI表达较低的乳癌细胞对甘露糖更敏感。
[关键词] 甘露糖;乳房肿瘤;抗药性,肿瘤;甘露糖-6-磷酸异构酶;表柔比星
[中图分类号] R730.53
[文献标志码] A
[文章编号] 2096-5532(2021)03-0350-06
doi:10.11712/jms.2096-5532.2021.57.041
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20200903.0933.006.html;2020-09-03 15:52:24
EFFECT OF MANNOSE ON THE PROLIFERATION OF BREAST CANCER CELLS AND THEIR CHEMOSENSITIVITY TO EPIRUBICIN
YI Junyu, WANG Yuanyuan, LIU Xiangping, NIE Weihong, LIU Jiaxiu, WANG Haibo
(Breast Disease Center, The Affiliated Hospital of Qingdao University, Qingdao 266003, China)
[ABSTRACT]Objective To investigate the effect of mannose on the proliferation of breast cancer cells and their chemosensitivity to epirubicin (EPI).
Methods Western blotting was used to measure the expression of mannose phosphate isomerase (MPI), a key protein for mannose metabolism, in breast cancer cells (BT-549, HCC1937, T-47D, and MCF-7) and normal human breast epithelial cells (MCF-10A). MCF-7 and T-47D cells were randomly divided into control group (cultured in a common culture solution containing fetal bovine serum at a volume fraction of 0.10), mannose group (25 mmol/L mannose), glucose group (25 mmol/L glucose), EPI group (1 μmol/L EPI), mannose+EPI group (1 μmol/L EPI+25 mmol/L mannose), and glucose+EPI group (1 μmol/L EPI+25 mmol/L glucose), and the above groups were cultured under both aerobic and anaerobic conditions. MTT colorimetry was used to measure the effect of mannose or mannose combined with EPI on cell growth activity, and Western blotting was used to measure the expression of the apoptosis-related proteins Caspase-3, Caspase-8, Bax, and Bcl-2 in T-47D cells in the control group, the mannose group, and the glucose group.
Results There was a significant difference in the expression of MPI between MCF-10A, BT-549, HCC1937, T-47D, and MCF-7 cells (F=392.680,P<0.05). Compared with MCF-10A cells, breast cancer T-47D cells had significantly lower expression of MPI and MCF-7 cells had significantly higher expression of MPI (t=25.449,32.857;P<0.05). Under aerobic conditions, compared with the control group, the mannose group had a significant reduction in the proliferation rate of T-47D cells (t=33.338,P<0.05), while there was no significant difference in the proliferation rate of MCF-7 cells between the two groups (P>0.05); the mannose+EPI group had a significantly lower proliferation rate of T-47D cells than the EPI group (t=22.901,P<0.05), and there was no significant difference in the proliferation rate of MCF-7 cells between the mannose+EPI group and the control group (P>0.05). Under hy-poxic conditions, compared with the control group, the mannose group had significant reductions in the proliferation rates of T-47D and MCF-7 cells (t=24.538,35.158;P<0.05), and the mannose+EPI group had significantly lower proliferation rates of T-47D and MCF-7 cells than the EPI group (t=37.986,54.622;P<0.05). There were no significant differences in the protein expression of Caspase-3, Caspase-8, Bax, and Bcl-2 in T-47D cells between the blank control group and the drug treatment groups (P>0.05).
Conclusion Mannose can inhibit the proliferation of breast cancer cells and enhance their sensitivity to epirubicin. Breast cancer cells with lower expression of MPI are more sensitive to mannose.
[KEY WORDS]mannose; breast neoplasms; drug resistance, neoplasm; mannose-6-phosphate isomerase; epirubicin
沃伯格效應(Warburg效应)是肿瘤代谢重编程的重要标志之一[1],这种能量代谢异常也存在于乳癌中[2]。表柔比星(EPI)作为乳癌化疗中常用的一线蒽环类药物,具有很好的抗肿瘤效果[3],但由于乳癌具有高异质性,某些类型乳癌对此类药物并不敏感[4]。有研究结果证明,甘露糖能抑制黑色素瘤细胞增殖,增加其对顺铂类或阿霉素类化疗药物的敏感性[5]。本文拟探讨甘露糖在乳癌细胞中的作用,以及甘露糖是否对EPI具有增敏作用,旨在为乳癌的治疗提供新思路。
1 材料和方法
1.1 实验材料
RPIM-1640培养液、胎牛血清购于BI公司,甘露糖、葡萄糖、四甲基偶氮唑蓝(MTT)粉末、EPI均购于Solarbio公司(北京),二甲基亚砜(DMSO)及GAPDH、Tubin、Caspas3、Caspase-8、Bax、Bcl-2单克隆抗体均购于美国Sigma公司。磷酸甘露糖异构酶(MPI)单克隆抗体购于Proteintech公司,正常乳腺细胞MCF-10A和乳癌细胞株T-47D、BT-549、HCC1937、MCF-7均来自青岛大学附属医院医学研究中心。
1.2 实验方法
1.2.1 Western blot方法检测MPI蛋白表达水平
分别取对数生长期的MCF-10A、T-47D、BT-549、HCC1937和MCF-7细胞,加入RIPA裂解液裂解蛋白,超声处理2~3次,室温下、12 000 r/min离心10 min,吸取上清后用BCA法测量蛋白浓度。以每孔30 μg计算上样量, SDS-PAGE电泳后转膜至PVDF膜上,脱脂奶粉封闭1.5 h,分别加入MPI(1∶1 000)和GAPDH(1∶2 000)一抗于4 ℃摇床过夜,用PBST洗膜3次,加相应二抗(1∶10 000)室温孵育1 h,使用ECL显色,待显出条带后进行图像分析。用Image J软件分析条带灰度值。实验重复3次,取平均值。以目的蛋白与内参蛋白灰度值的比值表示MPI的表达。
1.2.2 MTT方法检测甘露糖对乳癌细胞增殖的影响 取对数生长期T-47D和MCF-7细胞,以2×107/L密度接种于24孔板,每孔加入100 μL细胞悬液,每组设置2个复孔,于37 ℃、含体积分数0.05 CO2的孵箱中培养24 h,细胞融合度达20%~30%时用于实验。为筛选甘露糖的实验浓度,将细胞随机分为对照组(加入含体积分数0.10胎牛血清的普通培养液)、甘露糖组(分别加入10、25、50 mmol/L甘露糖)和葡萄糖组(分别加入10、25、50 mmol/L葡萄糖),于120 h后每孔加入5 g/L的MTT溶液50 μL,置于孵箱中4 h后棄上清,再加入DMSO 500 μL,室温避光静置15 min,分装于96孔板中(每孔150 μL),应用酶标仪检测490 nm波长处吸光度(A)值。以单糖浓度为横坐标,以细胞增殖率为纵坐标,绘制浓度曲线,确定甘露糖最终临界浓度为25 mmol/L。为观察甘露糖作用,细胞随机分为对照组(加入含体积分数0.10胎牛血清的普通培养液)、甘露糖组(加入25 mmol/L甘露糖)和葡萄糖组(加入25 mmol/L葡萄糖),在37 ℃、含体积分数0.05 CO2活细胞工作站中观察120 h。采用MTT法检测各组细胞培养40、80和120 h细胞活性,并计算细胞增殖率。细胞增殖率=(A实验组-A空白)/(A对照组-A空白)×100%。
1.2.3 MTT方法检测甘露糖对EPI的作用 为筛选EPI实验浓度,取T-47D细胞分为对照组(加入含体积分数0.10胎牛血清的普通培养液)、EPI组(分别加入0.1、0.5、1.0、5.0、10.0 μmol/L EPI),每孔加500 μL培养液,培养120 h后应用MTT法检测细胞活性。以时间为横坐标,以吸光度(A)为纵坐标,绘制EPI IC50浓度曲线,计算EPI IC50值。为了观察甘露糖联合EPI对细胞作用,取MCF-7和T-47D细胞随机设为对照组(加入含体积分数0.10胎牛血清的普通培养液)、甘露糖组(加入25 mmol/L甘露糖)、葡萄糖组(加入25 mmol/L葡萄糖)、EPI组(加入1 μmol/L EPI)、甘露糖联合EPI组(加入1 μmol/L EPI+25 mmol/L甘露糖)和葡萄糖联合EPI组(加入1 μmol/L EPI+25 mmol/L葡萄糖),根据1.2.2方法检测490 nm波长处的吸光度(A)值,并计算细胞增殖率。
1.2.4 MTT法检测乏氧条件下甘露糖及甘露糖联合EPI对乳癌细胞的作用 取MCF-7和T-47D细胞随机设为对照组(加入含体积分数0.10胎牛血清的普通培养液)、甘露糖组(加入25 mmol/L甘露糖)、葡萄糖组(加入25 mmol/L葡萄糖)、EPI组(加入1 μmol/L EPI)、甘露糖联合EPI组(加入1 μmol/L EPI+25 mmol/L甘露糖)和葡萄糖联合EPI组(加入1 μmol/L EPI+25 mmol/L葡萄糖),每孔加入培养液体积为500 μL。于37 ℃、含体积分数0.01 O2、体积分数0.05 CO2(剩余体积以N2填充)的乏氧箱中继续培养120 h,采用MTT方法检测细胞活性并计算细胞增殖率。
1.2.5 Western blot方法检测甘露糖对细胞凋亡蛋白表达的影响 取对数生长期T-47D细胞,以2×107/L的密度接种于24孔板,随机分为对照组(含体积分数0.10胎牛血清的普通培养液)、甘露糖组(25 mmol/L甘露糖)、葡萄糖组(25 mmol/L葡萄糖),各组分别加入含相应药物培养液500 μL,培养120 h后收集蛋白,取30 μg上样进行电泳,封闭后分别加入Caspase-8(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶1 000)、Caspase-3(1∶1 000)、β-actin(1∶2 000)、Tubulin(1∶2 000)和GAPDH(1∶2 000),其余步骤同1.2.1。用Image J软件分析各蛋白条带灰度值。实验重复3次,取平均值。以目的蛋白与内参蛋白灰度值的比值表示Caspase-3、Caspase-8、Bax、Bcl-2蛋白的表达。
1.3 统计学分析
应用SPSS 21.0软件进行统计学处理,计量资料结果以±s表示,多组数据比较采用析因设计的方差分析,组间两两比较采用LSD法。以P<0.05为差异有统计学意义。
2 结 果
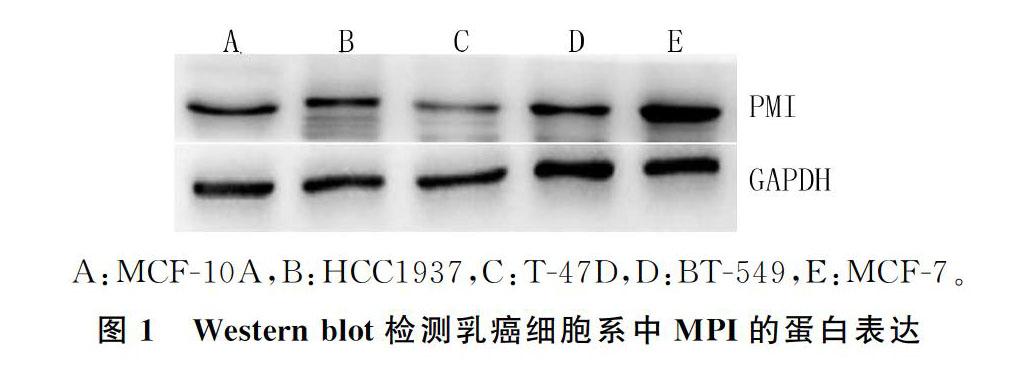
2.1 各乳癌细胞株中MPI表达情况
MCF-10A、HCC1937、T-47D、BT-549和MCF-7细胞MPI表达量分别为0.74±0.04、0.63±0.01、0.38±0.02、0.41±0.05、1.44±0.06(n=6),各组比较差异有统计学意义(F=392.680,P<0.05)。与正常乳腺细胞MCF-10A相比,T-47D细胞MPI表达量相对较低,MCF-7细胞表达相对较高,差异有显著性(t=25.449、32.857,P<0.05)。见图1。后续实验选择MCF-7和T-47D细胞作为研究细胞。
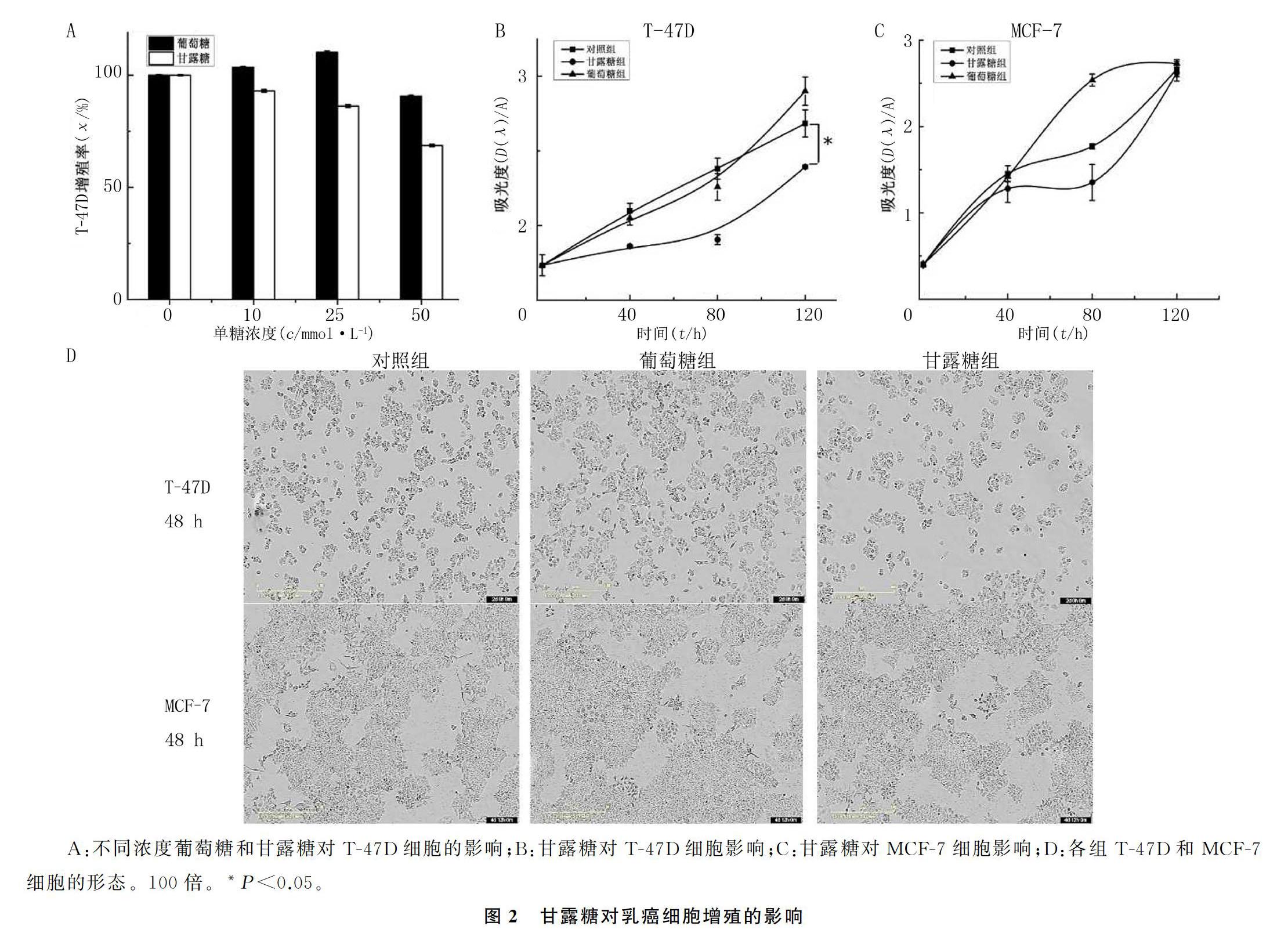
2.2 甘露糖对T-47D和MCF-7细胞增殖的影响
对照组、甘露糖组(10、25、50 mmol/L)、葡萄糖组(10、25、50 mmol/L)T-47D增殖率比较差异有显著性(F=20.194,P<0.05)。见图2A。在不影响细胞渗透压的情况下,选用25 mmol/L作为各种单糖实验浓度。MTT法检测各组处理120 h T-47D和MCF-7细胞增殖率见表1。析因设计方差分析显示,时间与甘露糖对T-47D和MCF-7的影响之间存在交互作用(F=25.201、54.618,P<0.05)。与对照组相比,甘露糖组T-47D细胞增殖率明显降低,差异有统计学意义(t=33.192, P<0.05),甘露糖组MCF-7增殖率差异无统计学意义(t=5.804,P>0.05)。见图2B、C、D。
2.3 甘露糖联合EPI对T-47D细胞增殖的影响
对照组、EPI组(0.1、0.5、1.0、5.0、10.0 μmol/L)T-47D细胞的增殖率见图3A。 EPI IC50浓度为1 μmol/L,因此选取1 μmol/L作为EPI实验浓度。甘露糖联合EPI作用不同时间T-47D和MCF-7细胞增殖率见图3B、C。析因设计方差分析显示,时间与甘露糖联合EPI对T-47D和MCF-7影响之间存在交互作用(F=12.636、232.438,P<0.05)。与EPI组相比,甘露糖联合EPI组T-47D增殖率相对较低(t=22.901,P<0.05),两组MCF-7细胞增殖率比较差异无统计学意义(P>0.05)。见表1。
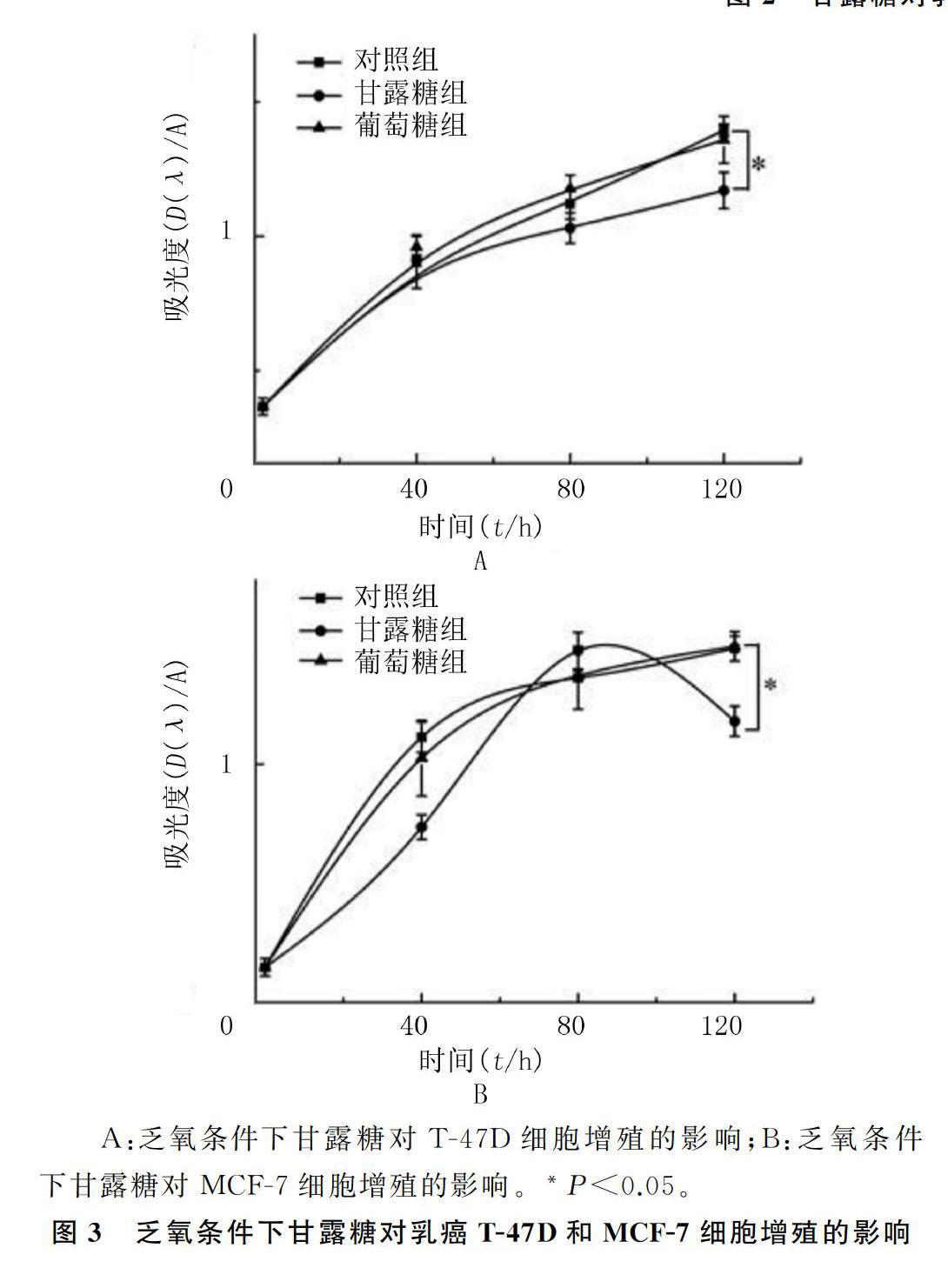
2.4 乏氧条件下甘露糖及甘露糖联合EPI对乳癌细胞增殖的影响
析因设计方差分析显示,时间与甘露糖对T-47D和MCF-7细胞增殖率影响之间存在交互作用(F=5.970、38.610,P<0.05)。见图3。与对照组相比,甘露糖组T-47D和MCF-7细胞增殖率明显降低,差异有统计学意义(t=24.538、35.158,P<0.05);与EPI组相比较,甘露糖+EPI组T-47D和MCF-7细胞增殖率显著降低,差异有统计学意义(t=37.986、54.622,P<0.05)。见表1。
2.5 甘露糖对T-47D细胞凋亡蛋白作用
与对照组相比,甘露糖组及葡萄糖组T-47D细胞凋亡蛋白Caspase-3、Caspase-8、Bax、Bcl-2表达差异无显著性(P>0.05)。见图4、表2。
3 讨 论
甘露糖是生活中常见己醛醣之一[6],具有广泛的临床应用价值。目前,甘露糖补充剂是Ib型糖基化先天性疾病的有效治疗方式之一[7],而且甘露糖已被证明可以在体外抑制红细胞的糖酵解,有望成为血糖检测血液样本中有效的葡萄糖防腐剂[8]。此外有研究表明,甘露糖衍生物如2-DG等具有抑制乳癌细胞的作用[9]。EPI在临床上多与2种或3种化疗药物联合应用[10],可能增加其他药物的毒副作用。因此,找到一种既可以增加乳癌细胞对EPI的敏感性,同时又能减轻其所带来的毒副作用的化疗增敏剂迫在眉睫。甘露糖安全、无毒副作用,对人体有保护或营养作用,并且具有一定程度的抗肿瘤作用。这些特点为甘露糖成为乳癌治疗中理想的化疗增敏剂提供了应用基础。
已有研究表明,甘露糖能抑制黑色素瘤细胞增殖并增加肿瘤细胞对顺铂类和阿霉素类化疗药物的敏感性[3]。最新研究发现,甘露糖在体内外对肺癌细胞增殖和迁移具有时间和剂量依赖性的抑制作用[11]。本文研究结果显示,有氧条件下,甘露糖组T-47D细胞增殖率显著低于对照組,表明甘露糖可以抑制乳癌细胞增殖,甘露糖联合EPI组T-47D细胞增殖率显著低于EPI单药组,提示甘露糖与EPI联用可以显著促进乳癌细胞凋亡;而MCF-7细胞则对甘露糖并不敏感。本文Western blot检测结果显示,T-47D和MCF-7细胞中MPI的表达差异有显著性。有研究表明,MPI的缺失会通过甘露糖-6-磷酸大量累积而阻碍Warburg效应,进而阻断糖酵解途径,同时刺激抑癌基因p53的活化,并进一步维持p53的稳定[12]。有研究显示,肿瘤细胞对甘露糖的易感性与MPI的表达水平呈负相关[3]。本研究结果表明,低表达MPI的T-47D细胞对甘露糖更易感,高表达MPI的MCF-7细胞对甘露糖并不敏感。本文研究结果与上述文献结论基本一致。表明MPI表达与乳癌细胞对甘露糖的易感性密切相关。
本文研究结果表明,乏氧条件下甘露糖组及甘露糖联合EPI组T-47D和MCF-7细胞增殖率均显著低于对照组和EPI单药组,说明乏氧条件下甘露糖可明显抑制MCF-7和T-47D细胞增殖并增加其对EPI的敏感性。相较于正常有氧条件,乏氧因素可以增加甘露糖对乳癌细胞的抑制作用。有研究发现,低氧诱导因子(HIF)-1通过上调糖酵解中一系列进行物质及能量储备活动的相关基因表达,间接地促进肿瘤细胞有氧糖酵解的发生[13]。乳癌细胞中HIF-1α和前梯度蛋白2(AGR2)的表达水平密切相关[14-15]。甘露糖的抑癌作用与HIF介导的生物学信号通路之间的联系有待验证。
本文研究还探讨了甘露糖抑癌作用与常见线粒体凋亡通路[16-17]的关系,结果表明甘露糖组T-47D细胞线粒体凋亡通路常见蛋白Caspase-3、Caspase-8、Bax、Bcl-2表达与对照组和葡萄糖组比较差异无显著性,提示甘露糖抑制乳癌细胞增殖与线粒体凋亡通路无关。有研究表明,甘露糖与化疗药物联用后可使结肠癌细胞中促凋亡蛋白NOXA水平升高,而抗细胞凋亡蛋白Bcl-XL和Mcl-1水平降低,从而促进肿瘤细胞的凋亡[3]。而甘露糖增加乳癌细胞对EPI敏感性机制有待进一步研究证实。最近研究表明,甘露糖通过ERK/GSK-3β/β-catenin/SNAIL通路抑制肺癌细胞的增殖和转移[11]。下一步将验证此通路与甘露糖抑制乳癌细胞增殖作用的联系。
综上所述,甘露糖具有抑制乳癌细胞增殖和迁移以及增加化疗药物敏感性等作用,但其机制尚不明确。甘露糖和MPI竞争性抑制剂有望成为乳癌治疗中理想的化疗增敏剂。
[参考文献]
[1]KIM J, DEBERARDINIS R J. Mechanisms and implications of metabolic heterogeneity in cancer[J]. Cell Metabolism, 2019,30(3):434-446.
[2]KOPPENOL W H, BOUNDS P L, DANG C V. Otto Warburgs contributions to current concepts of cancer metabolism[J]. Nature Reviews.Cancer, 2011,11(5):325-337.
[3]王铁军,耿慧,祝永刚,等. 乳腺癌化疗现状及相关研究进展[J]. 现代生物医学进展, 2013,13(22):4398-4400.
[4]崔婷婷,李红,张倩,等. 乳腺癌肿瘤代谢异质性与p53基因表达和淋巴结转移相关性的研究[J]. 现代肿瘤医学, 2019,27(15):2670-2673.
[5]GONZALEZ P S, OPREY J, CARDACI S, et al. Mannose impairs tumour growth and enhances chemotherapy[J]. Nature, 2018,563(7733):719-723.
[6]TAGUCHI T, MIWA I, MIZUTANI T, et al. Determination of D-mannose in plasma by hplc[J]. Clinical Chemistry, 2003,49(1):181-183.
[7]WESTPHAL V, KJAERGAARD S, DAVIS J A, et al. Genetic and metabolic analysis of the first adult with congenital disorder of glycosylation type Ib: long-term outcome and effects of mannose supplementation[J]. Molecular Genetics and Metabolism, 2001,73(1):77-85.
[8]NAKASHIMA K, TAKEI H, NASU Y, et al. D-mannose as a preservative of glucose in blood samples[J]. Clinical Chemistry, 1987,33(5):708-710.
[9]申越,賀丽,李华,等. 2-脱氧葡萄糖对乳腺癌MCF7/ErbB2细胞增殖迁移和侵袭的影响[J]. 西部医学, 2018,30(11):1564-1569.
[10]HASAN M, LEAK R K, STRATFORD R E, et al. Drug conjugates-an emerging approach to treat breast cancer[J]. Pharmacology Research & Perspectives, 2018,6(4):e00417.
[11]LUO Q S, LI B, LI G. Mannose suppresses the proliferation and metastasis of lung cancer by targeting the ERK/GSK-3β/β-catenin/SNAIL axis[J]. OncoTargets and Therapy, 2020,13:2771-2781.
[12]SHTRAIZENT N, DEROSSI C, NAYAR S, et al. MPI depletion enhances O-GlcNAcylation of p53 and suppresses the Warburg effect[J]. eLife, 2017,6:e22477.
[13]周扬梅,肖嵘,吴元强,等. 缺氧诱导因子HIF-1在肿瘤Warburg效应中作用机制的研究进展[J]. 现代生物医学进展, 2012,12(33):6588-6590.
[14]邱依然,刘文佳,余岳,等. AGR2在乳腺癌中的表达及其功能的生物信息学初步分析[J]. 中国肿瘤生物治疗杂志, 2020,27(3):302-308.
[15]JIA Y Y, GUO Y T, JIN Q, et al. A SUMOylation-dependent HIF-1α/CLDN6 negative feedback mitigates hypoxia-induced breast cancer metastasis[J]. Journal of Experimental & Clinical Cancer Research: CR, 2020,39(1):42.
[16]ODONOVAN N, CROWN J, STUNELL H, et al. Caspase 3 in breast cancer[J]. Clinical Cancer Research, 2003,9(2):738-742.
[17]AZIMIAN H, DAYYANI M, TOOSSI M T B, et al. Bax/Bcl-2 expression ratio in prediction of response to breast cancer radiotherapy[J]. Iranian Journal of Basic Medical Sciences, 2018,21(3):325-332.
(本文编辑 黄建乡)
