雌激素受体阳性乳癌lncRNA的差异性表达研究
2021-08-18弭苗苗姜慧慧魏晓楠刘杰辛钰孙成铭
弭苗苗 姜慧慧 魏晓楠 刘杰 辛钰 孙成铭


[摘要] 目的 基于生物信息學技术,筛选与雌激素受体(ER)阳性乳癌相关的长链非编码RNA(lncRNA),并初步探讨其与病人预后的关系。
方法 通过基因芯片技术,对4对手术切除的ER阳性乳癌组织及其癌旁正常组织进行lncRNA和mRNA的表达谱分析,并对差异表达的mRNA进行GO功能注释、KEGG通路富集分析及疾病富集分析;应用qRT-PCR方法对差异表达的lncRNA在40对ER阳性乳癌组织及癌旁组织中进行验证,同时在ER阳性乳癌细胞株MCF-7及正常乳腺上皮细胞MCF-10A做进一步验证;最后通过TCGA数据库对lncRNA在ER阳性乳癌组织中的表达水平进行分组,使用Kaplan-Meier生存曲线分析其表达量与预后的关系。
结果 基因芯片技术分析显示,在ER阳性乳癌组织及其癌旁正常组织共筛选出具有差异性表达的mRNA 3 949个、lncRNA 4 050个。选取其中差异表达最显著的7个lncRNA在组织中做进一步验证,发现LINC01614(t=10.380,P<0.01)、AC044784.1(t=3.490,P<0.01)、CTD-2510F5.4(t=3.235,P<0.01)在乳癌组织高表达;细胞学验证结果显示,LINC01614(t=3.714,P<0.05)、AC044784.1(t=5.827,P<0.01)、CTD-2510F5.4(t=4.415,P<0.05)在乳癌细胞株中同样高表达。TCGA数据库预后分析显示,纳入的791例ER阳性乳癌病人中,LINC01614高表达者预后相对更差(χ2=7.50,P<0.01)。
结论 LINC01614在ER阳性乳癌中高表达可能与乳癌的发生、发展及预后相关,可能成为乳癌治疗新的作用靶点。
[关键词] 乳房肿瘤;RNA,长链非编码;寡核苷酸序列分析;计算生物学;受体,雌激素;预后
[中图分类号] R737.9;R394-33
[文献标志码] A
[文章编号] 2096-5532(2021)03-0333-06
doi:10.11712/jms.2096-5532.2021.57.123
[开放科学(资源服务)标识码(OSID)]
[网络出版] https://kns.cnki.net/kcms/detail/37.1517.R.20210628.1618.005.html;2021-06-29 09:41:39
DIFFERENTIAL EXPRESSION OF LONG NON-CODING RNAS IN ESTROGEN RECEPTOR-POSITIVE BREAST CANCER
MI Miaomiao, JIANG Huihui, WEI Xiaonan,LIU Jie, XIN Yu, SUN Chengming
(Center for Laboratory Diagnosis, Yantai Yuhuangding Hospital Affiliated to Qingdao University, Yantai 264000, China)
[ABSTRACT]Objective To screen out the long non-coding RNAs (lncRNAs) associated with estrogen receptor (ER)-positive breast cancer based on bioinformatics technology, and to investigate their association with patient prognosis.
Methods The gene microarray technique was used to analyze the expression profiles of lncRNAs and mRNAs in four pairs of surgically resected ER-positive breast cancer tissue samples and adjacent tissue samples, and GO functional annotation, KEGG pathway enrichment analysis, and disease enrichment analysis were performed for differentially expressed mRNAs. The qRT-PCR method was used to verify the differentially expressed lncRNAs in 40 pairs of ER-positive breast cancer tissue samples and adjacent tissue samples, and further verification was performed in the ER-positive breast cancer cell line MCF-7 and the normal breast epithelial cell line MCF-10A. The Cancer Genome Atlas (TCGA) database was used for grouping based on the expression level of lncRNAs in ER-positive breast cancer tissue, and the Kaplan-Meier survival curve was used to investigate the association of expression level with prognosis.
Results The gene microarray analysis showed that a total of 3 949 differentially expressed mRNAs and 4 050 differentially expressed lncRNAs were screened out between ER-positive breast cancer tissue and adjacent tissue. Further verification of the 7 lncRNAs with strongest differential expression showed that LINC01614 (t=10.380,P<0.01), AC044784.1 (t=3.490,P<0.01), and CTD-2510F5.4 (t=3.235,P<0.01) were highly expressed in breast cancer tissue, and cytological verification showed that LINC01614 (t=3.714,P<0.05), AC044784.1 (t=5.827,P<0.01), and CTD-2510F5.4 (t=4.415,P<0.05) were also highly expressed in the breast cancer cell line. The prognostic analysis based on TCGA database showed that among the 791 patients with ER-positive breast cancer, there was significant difference in the patients with high expression of LINC01614 tended to have poor prognosis (χ2=7.50,P<0.01).
Conclusion High expression of LINC01614 in ER-positive breast cancer may be associated with
the development, progression, and prognosis of breast cancer, and therefore, it may become a new target for targeted breast cancer therapy.
[KEY WORDS]breast neoplasms; RNA, long noncoding; oligonucleotide array sequence analysis; computational biology; receptors, estrogen; prognosis
乳癌是目前导致女性癌症死亡的主要原因之一[1-2]。根据雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体(HER2)的表达,乳癌被分为不同的亚型[3],其中ER阳性乳癌约占75%。长链非编码RNA(lncRNA)是一种转录本长度> 200个核苷酸的非编码RNA[4-5]。已有多项研究结果表明,lncRNA在多种癌症的发展和进程中起着重要的作用[6-8]。但目前关于ER阳性乳癌中lncRNA的生物学作用和功能却鲜见报道。本研究通过基因芯片技术与生物信息学分析相结合方法,筛选影响ER阳性乳癌预后的lncRNA,并初步探讨其可能的作用机制,以期为ER阳性乳癌的诊断、治疗提供参考。 现将结果报告如下。
1 材料和方法
1.1 样本来源
2019年12月—2020年10月,选择在青岛大学附属烟台毓璜顶医院乳腺外科确诊并行乳癌切除术病人40例,均为女性,年龄33~70岁,平均(57.0±8.7)岁。符合以下纳入标准:①术前快速穿刺病理结果为浸润性乳癌;②术前均未接受放疗、化疗等针对肿瘤的治疗;③术中切除乳癌组织病理免疫组化结果示ER阳性。排除标准:①既往有其他恶性肿瘤病史病人;②病理资料不完善者;③具有免疫系统疾病或高血压等全身疾病等病史病人。术中留取200~300 mg乳癌组织和距病灶边缘≥5 cm的癌旁正常组织,放入冻存管后置于液氮中保存。本研究经医院伦理委员会审批通过。
1.2 基因芯片表达谱的构建及差异基因的筛选
在40例ER阳性乳癌标本中选取4对癌组织及其癌旁正常组织标本,应用CapitalBio Technology Human LncRNA Arrayv4,4×80 K基因芯片(北京博奥晶典生物技术有限公司提供),分别检测lncRNA及mRNA的差异性表达;4例均为女性、绝经后、单侧发病乳癌病人,术后病理为浸润性导管癌Ⅱ级,免疫组化结果提示ER阳性率>80%、Ki-67阳性率≥14%,临床确诊为Luminal B型乳癌。使用Trizol方法(Invitrogen,USA)从4对样本中提取总RNA,应用NucleoSpin RNA clean-up试剂盒(MACHEREY-NAGEL,德国)进行纯化,用Nanodrop定量检测纯化后总RNA的浓度及纯度,并用琼脂糖凝胶电泳检测其完整性。使用First Strand Enzyme Mix合成First strand cDNA,再用Second Strand Enzyme Mix将其转化为Second Strand cDNA,通过CbcScriptⅡ酶进行反转录并进行纯化,最后以Random Primer为引物,用Klenow Fragment酶合成cDNA互补链并掺入带有荧光基团的dNTP,再次纯化后定量标记产物用于芯片杂交,标记过程采用晶芯生物芯片通用标记试剂盒。用Agilent Feature Extraction(v10.7)软件对杂交图片进行分析并提取数据,然后使用Agilent GeneSpring软件對数据进行归一化和差异分析,以差异倍数FC≥2、P<0.05为显著差异表达的lncRNA及mRNA的筛选标准。lncRNA及mRNA的参考数据库主要为Ensemble数据库。
1.3 差异聚类分析
通过对4对乳癌病人的癌组织及其癌旁正常组织进行基因芯片检测,对具有差异表达的lncRNA及mRNA进行监督聚类分析,以展示不同组织样本中所测基因的表达情况;通过监督聚类分析反映样本和基因间的相似性,观察各组织样本的表达模式相关性及离群样本的存在情况。
1.4 基因注释富集分析
对于通过基因芯片技术检测到的mRNA中差异表达基因分别进行GO、KEGG通路富集分析及疾病注释富集分析。GO富集分析又分为细胞学组件、生物学途径、分子功能3个部分,对筛选出的具有差异表达的mRNA通过富集分析,预测其在乳癌疾病发生、发展中可能发挥的作用途径。
1.5 lncRNA与mRNA的共表达分析
共表达分析是以相关性为基础,从基因表达层面寻找表达谱相似的lncRNA-mRNA关系对。其方法为以各个探针在各个样品中的标准化后信号值作为数据源进行两两相关性计算和假设验证,采用Pearson相关性分析计算相关系数(r)和P值。筛选标准为:r>0.99或<-0.99,且P<0.05。
1.6 qRT-PCR方法验证ER阳性乳癌组织及癌旁组织中lncRNA的表达
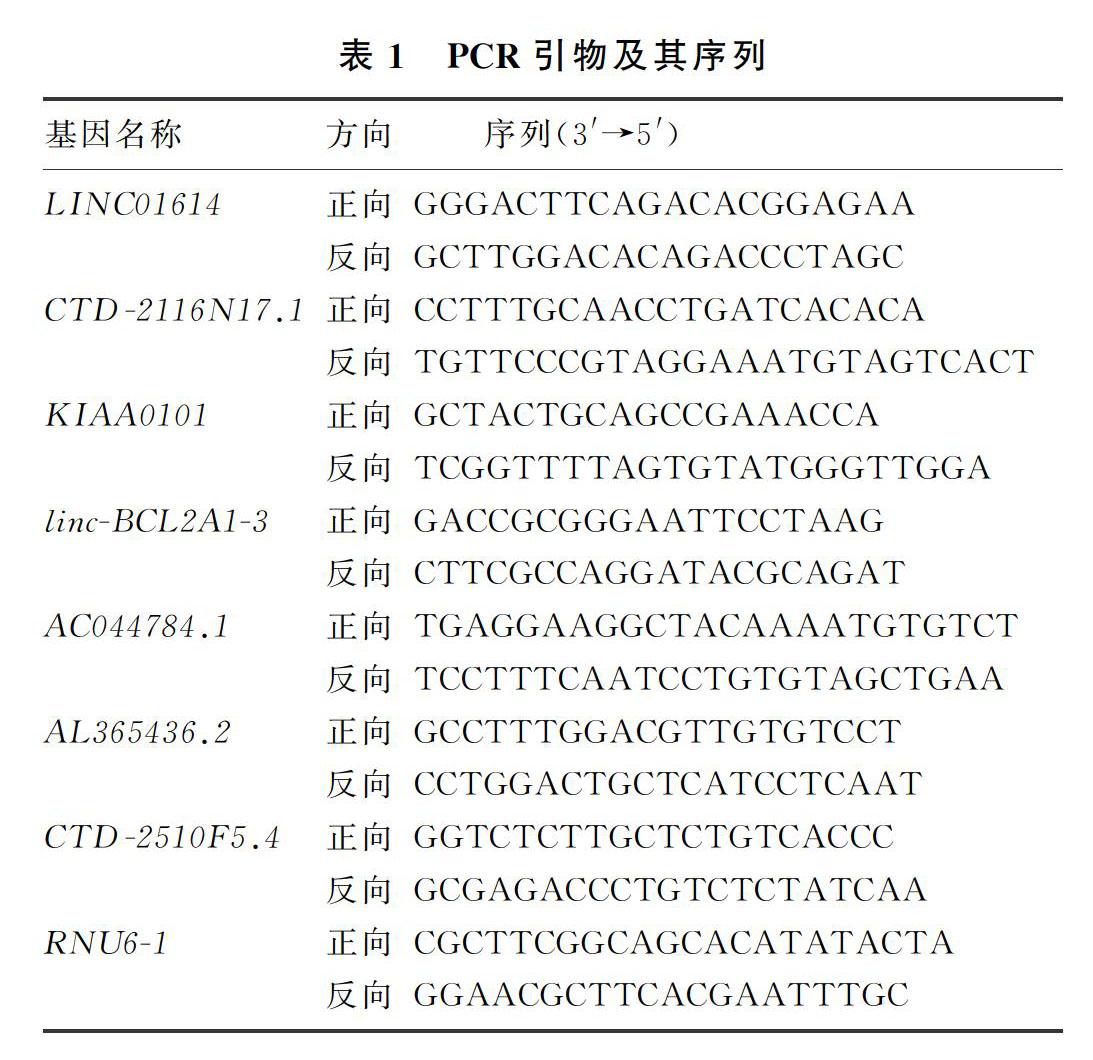
为验证基因芯片结果的可靠性,在收集的40对ER阳性乳癌癌组织和癌旁正常组织(包括进行芯片检测的4对组织),选择芯片结果中表达差异倍数最大的7个lncRNA应用qRT-PCR方法进行验证。通过Trizol法提取组织的总RNA,按照说明书方法使用HiScriptⅢ 1st Strand cDNA Synthesis Kit(+gDNA wiper)试剂盒将从组织中提取的总RNA反转录成cDNA,然后使用ChamQ UniversalSYBR qPCR Master Mix进行qRT-PCR,内参照基因为U6。反应完成后,应用溶解曲线确定引物特异性,使用2-ΔΔCt法计算lncRNA的相对表达量。其中PCR引物由Thermo Fisher公司合成,其序列见表1。
1.7 qRT-PCR验证ER阳性乳癌细胞株MCF-7中lncRNA的表达
乳癌细胞株MCF-7(由青岛大学附属烟台毓璜顶医院中心实验室馈赠)培养在含体积分数0.10胎牛血清DMEM培养基中,正常乳腺上皮细胞MCF-10A(购于赛百慷(上海)生物技术股份有限公司)培养在专用完全培养基中,并分别加入10 g/L青链霉素双抗。细胞培养瓶置于含体积分数0.05 CO2的37 ℃培养箱中。应用TRIZOL法提取MCF-7及MCF-10A的总RNA,逆转录后应用qRT-PCR方法检测LINC01614、AC044784.1、CTD-2510F5.4等lncRNA在细胞中的表达水平。
1.8 lncRNA表达与乳癌疾病预后关系分析
通过TCGA在GDC数据库中下载相关数据,筛选出ER阳性的乳癌病人共791例,根据病人的lncRNA的表达水平进行分组,以平均值为界分为高表达组和低表达组;通过R语言编辑器进行转换包“survival”;对所选择的lncRNA行Kaplan-Meier曲线分析,与疾病预后的关系使用long-rank检验进行分析。
1.9 统计学方法
应用GraphPad Prism 8软件进行统计学分析。计量资料结果以±s形式表示,数据间比较采用t检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 ER阳性乳癌组织中mRNA以及lncRNA的表达
通过基因芯片技术在4对ER阳性乳癌组织及癌旁正常组织中共筛选出3 949个具有差异表达的mRNA,其中,在癌组织中差异表达上调的mRNA有2 448个,差异表达下调的有1 501个,上调最明显及下调最明显的mRNA为CST2和CSF3,FC值分别为70.3和-14.4。用同样的方法在癌组织中共筛选出4 050个具有差异表达的lncRNA,其中有1 589个lncRNA差异性高表达,而显著性低表达lncRNA有2 461个。将差异表达的mRNA以及lncRNA标准化数据分别制作成聚类图(图1)。按差异倍数排序,选取前7位差异表达的lncRNA进行验证。见表2。
2.2 mRNA的功能分析
通过GO、KEGG及疾病富集通路分析,选取排名前30个最明显富集的通路来进一步预测具有差异表达的mRNA的功能。GO细胞学组件分析显示,具有差异表达的mRNA多分布在核小体、DNA包装复合体、蛋白质-DNA复合体、细胞外基质、细胞外膜、细胞质膜等(图2A);GO生物学功能分析表明,差异表达mRNA生物学過程主要在细胞黏附、生物黏附、核小体装配、单细胞黏附、DNA包装、染色体聚集等富集明显(图2B);GO分子功能分析显示,具有差异表达的mRNA可能涉及的致病机制及通路极其丰富,如蛋白质异二聚体活性、糖胺聚糖结合、蛋白质二聚体活性、细胞黏附分子结合、MHC Ⅱ类受体活性等(图2C)。KEGG富集通路分析显示,mRNA主要通过T细胞激活、整合素信号通路、血液凝固、纤溶酶原级联激活、FAS信号通路、半胱氨酸的生物学合成等在乳癌疾病的发生、发展中发挥作用(图3A);疾病富集通路分析显示,在ER阳性乳癌中具有差异表达的mRNA主要在免疫系统疾病、过敏及自身免疫疾病、埃-当二氏综合征、骨骼肌疾病、成骨不全病、原发性免疫缺陷病中明显富集(图3B)。
2.3 差异表达的lncRNA与mRNA的相关性
通过对差异表达的lncRNA及mRNA进行共表达分析,共筛选出关联度最大的前1 000个关系对,用Cytoscape软件绘制其网络图,见图3C。对网络图分析显示,WDR55、CEP85、OR5L2、GRIK2等mRNA和众多具有差异表达的lncRNA存在显著相关性。
2.4 qRT-PCR验证
基于基因芯片筛选具有差异表达的lncRNA,选择了差异表达最大的前7个,应用qRT-PCR方法对40例ER阳性乳癌组织及癌旁正常组织进行进一步验证,结果显示LINC01614(t=10.380,P<0.01)、AC044784.1(t=3.490,P<0.01)、CTD-2510F5.4(t=3.235,P<0.01)共3个lncRNA在癌组织中表达较癌旁正常组织上调,与本研究芯片结果一致;CTD-2116N17.1、KIAA0101、linc-BCL2A1-3、AL365436.2 lncRNA虽然在乳癌组织中表达上调,但差异无统计学意义(P>0.05)。见表3。将上述具有差异性高表达的3个基因在ER阳性乳癌细胞株MCF-7及正常乳腺上皮细胞MCF-10A中验证,结果显示LINC01614(t=3.714,P<0.05)、AC044784.1(t=5.827,P<0.01)、CTD-2510F5.4(t=4.415,P<0.05)在乳癌細胞株MCF-7中同样具有显著性高表达。见表4。
2.5 lncRNA与ER阳性乳癌预后的关系
根据Kaplan-Meier生存曲线法,在纳入791例ER阳性乳癌病人中,将LINC01614、AC044784.1、CTD-2510F5.4在ER阳性乳癌病人的表达水平与疾病的总存活率进行相关性分析。研究结果显示,LINC01614表达水平的高低与疾病的预后生存显著相关(χ2=7.50,P<0.01),LINC01614表达水平低的病人较LINC01614表达水平高者具有更长的无病生存期(图4)。
3 讨 论
本文研究通过基因芯片技术,选取4例较Luminal A型乳癌预后更差、恶性程度更高的Luminal B型乳癌组织及其癌旁正常组织,筛选ER阳性乳癌具有差异表达的mRNA及lncRNA,结果显示,上调及下调最明显的mRNA为CST2和CSF3。已有研究通过对6对乳癌的癌组织及癌旁组织进行转录组的高通量测序,证实CST2基因在乳癌组织中高表达,并推测可能与ECM-受体相互作用信号相关[9-10],但其具体作用机制尚有待进一步研究证实。CHEN等[11]对MCF-7乳癌细胞株进行成骨细胞培养基(OCM)及未分化成骨细胞条件培养基对照培养,然后用细胞因子抗体阵列进行筛选,结果显示OCM处理的MCF-7细胞株中CSF3表达显著性上调,且OCM和乳癌细胞的迁移相关,推测CSF3可能与乳癌的远处骨转移有关。
对于本文组织验证所选取的7个lncRNA,后续通过对TCGA数据库中乳癌数据分析显示,它们均在乳癌组织中具有差异性高表达,与本文芯片结果相吻合。有研究者通过TCGA数据库对837个浸润性乳癌组织及105个正常组织的lncRNA基因谱进行分析,结果显示LINC01614在PR阳性、ER阳性和HER2阳性乳癌高表达,而在三阴性乳癌中呈现低表达,即在Luminal B/HER2阳性亚型乳癌中具有高表达;并通过生物信息学和通路分析发现,LINC01614可能通过TGFβ和FAK信号的调控在乳癌疾病中发挥作用[12]。本研究基因芯片检测结果同样提示,LINC01614在ER阳性乳癌组织中具有差异性高表达,并且后续在ER阳性乳癌组织及细胞株中得到验证;LINC01614可能成为预测ER阳性乳癌病人整体生存期的预后标志物,并在临床中对判断预后和预测乳癌的治疗效果可能存在价值。另外有研究指出,KIAA0101在乳癌中起着中心体数目调节剂的作用,敲低该基因可通过促进乳癌中p53/Sp1复合物的形成来抑制细胞增殖和细胞周期的进程[13],并推测该基因可能与雌激素的表达相关[14-17]。本文基因芯片技术检测的研究结果也证实,KIAA0101在ER阳性乳癌中同样具有高表达;后续组织验证结果提示该lncRNA在癌组织中虽有高表达,但差异无统计学意义。究其原因,可能为组织标本个体差异性大,导致结果出现偏差。
综上所述,本文证实LINC01614、AC044784.1、CTD-2510F5.4在ER阳性乳癌组织及细胞中具有显著性高表达。而LINC01614在ER阳性乳癌组织中的高表达可能与预后不良有关,其具体的细胞功能及作用机制需要进一步研究。这些在ER阳性乳癌组织中差异表达的lncRNA可能作为新型的生物标记物,为疾病的诊断及治疗提供新的方向。
[参考文献]
[1]KOLAK A, KAMISKA M, SYGIT K, et al. Primary and secondary prevention of breast cancer[J]. Annals of Agricultural and Environmental Medicine, 2017,24(4):549-553.
[2]CHEN W, ZHENG R, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA: A Cancer Journal for Clinicians, 2016,66(2):115-132.
[3]雷正武,龙佳丰,徐钰,等. 不同分子分型乳腺癌Ki67、P53的表达及临床病理特点研究[J]. 现代医药卫生, 2021,37(1):12-14,18.
[4]ANDERSSON R, GEBHARD C, MIGUEL-ESCALADA I, et al. An atlas of active enhancers across human cell types and tissues[J]. Nature, 2014,507(7493):455-461.
[5]CHAN J J, TAY Y. Noncoding RNA: RNA regulatory networks in cancer[J]. International Journal of Molecular Sciences, 2018,19(5):1310.
[6]PENG W X, KOIRALA P, MO Y Y. LncRNA-mediated re-
gulation of cell signaling in cancer[J]. Oncogene, 2017,36(41):5661-5667.
[7]BHAN A, SOLEIMANI M, MANDAL S S. Long noncoding RNA and cancer: a new paradigm[J]. Cancer Research, 2017,77(15):3965-3981.
[8]LI J, MENG H, BAI Y, et al. Regulation of lncRNA and its role in cancer metastasis[J]. Oncology Research, 2016,23(5):205-217.
[9]周星彤,沈松杰,孫强. 中国乳腺癌筛查现状及进展[J]. 中国医学前沿杂志(电子版), 2020,12(3):6-11.
[10]BAO Y L, WANG L, SHI L, et al. Transcriptome profiling revealed multiple genes and ECM-receptor interaction pathways that may be associated with breast cancer[J]. Cellular & Molecular Biology Letters, 2019,24:38.
[11]CHEN X J, LU J, JI Y H, et al. Cytokines in osteoblast-conditioned medium promote the migration of breast cancer cells[J]. Tumour Biology, 2014,35(1):791-798.
[12]VISHNUBALAJI R, SHAATH H, ELKORD E, et al. Long non-coding RNA (lncRNA) transcriptional landscape in breast cancer identifies LINC01614 as non-favorable prognostic biomarker regulated by TGFβ and focal adhesion kinase (FAK) signaling[J]. Cell Death Discovery, 2019,5:109.
[13]LV W, SU B H, LI Y Y, et al. KIAA0101 inhibition suppresses cell proliferation and cell cycle progression by promoting the interaction between p53 and Sp1 in breast cancer[J]. Biochemical and Biophysical Research Communications, 2018,503(2):600-606.
[14]MILLER W R. Clinical, pathological, proliferative and mole-
cular responses associated with neoadjuvant aromatase inhibitor treatment in breast cancer[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2010,118(4/5):273-276.
[15]IWANAMI N, HIGUCHI T, SASANO Y, et al. WDR55 is a nucleolar modulator of ribosomal RNA synthesis, cell cycle progression, and teleost organ development[J]. PLoS Gene-
tics, 2008,4(8):e1000171.
[16]LIU Y, KIM J, PHILIP R, et al. Direct interaction between CEP85 and STIL mediates PLK4-driven directed cell migration[J]. Journal of Cell Science, 2020,133(8): jcs238352.
[17]YOUN J Y, DUNHAM W H, HONG S J, et al. High-density proximity mapping reveals the subcellular organization of mRNA-associated granules and bodies[J]. Molecular Cell, 2018,69(3):517-532.e11.
(本文编辑 黄建乡)
