白介素-13、白介素-1受体拮抗剂和环氧合酶-2在炎症性肠病患者血清中的表达及临床意义
2021-08-18张现明杨锦平
张现明 杨锦平
深圳市宝安区中心医院输血科,广东深圳 518102
炎症性肠病(inflammatory bowel disease,IBD)是一组比较常见的慢性非特异性炎症疾病,包括克罗恩病(Crohn disease,CD)及溃疡性结肠炎(ulcerative colitis,UC)[1],目前 IBD 患病者主要集中在欧美各国患病率可高达40/10万[2];我国IBD患病率呈逐渐增加趋势可达3.44/10万[3]。IBD患者由于长期迁延不愈,容易并发多种并发症甚至并发结直肠癌(Colorectal cancer,COAD)[4];IBD尚缺乏临床的诊断金标准,主要是结合临床表现、消化道内窥镜和病理活检进行综合性临床诊断,操作复杂且费用比较昂贵[5];而各种IBD相关血清学标志物检测具有廉价、无创、方便和快速等优点,能为IBD的临床诊疗和预后评价提供了良好临床数据依据[6];本研究经过预先筛查发现,白介素(Interleukin,IL)-13、白介素 -1受体拮抗剂(Interleukin-1 receptor antagonist,IL-1Ra)和环氧合酶 -2(Cyclooxygenase-2,COX-2)在IBD患者中存在高表达,本研究通过回顾性研究IL-13、IL-1Ra和COX-2在活动期IBD患者外周血中的表达,旨在探讨这三者在IBD发生和发展中的作用及其临床意义。
1 资料与方法
1.1 一般资料
选择2018年3月至2019年3月在我院治疗的124例均处于活动期的IBD患者为实验组,其中,男82例,女42例,年龄22~76岁,平均(38.7±12.7)岁。纳入标准:①病史、临床症状、影像学、结肠镜检查及病理等确诊;②符合2018年北京全国非感染性肠道学术会议制定的《IBD诊断与治疗的共识意见》的诊断标准[7];③患者各类检查资料及病案均完整;④能配合研究者。排除标准:①合并严重的心脏、肺脏、肝脏及肾脏疾病者;②患者合并自身免疫性疾病;③患者合并恶性肿瘤;④不能配合本项目全程研究者;⑤妊娠期妇女;⑥2个月内使用过免疫抑制剂、糖皮质激素和生物制剂等;试验组的其中CD 60例为A组和UC 64例为B组,CD参照CD简化内镜(SES-CD)评分标准[8],将A组分别为18例轻度活动期为组A1、26例中度活动期为A2组和16例重度活动期为A3组;参照UC参照改良Truelove和Witts疾病严重程度评分标准[9],把B组分别为21例轻度活动期为组B1、25例中度活动期为B2组和18例重度活动期为B3组;同期选择在我院进行体检的100例均行肠镜检查,均为健康者为对照组,其中,男66例,女34例,年龄22~76岁,平均(38.6±12.8)岁。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 方法
检测原理:均采用酶联免疫吸附测定法(Enzyme-Linked ImmunoSorbent Assay,ELISA)法检测各组受检者的血清IL-13、IL-1Ra和COX-2,详其操作详细步骤均严格按照说明书。试剂:IL-13检测试剂盒由北京百奥莱博科技有限公司提供,IL-1Ra检测试剂盒由上海康朗生物科技有限公司提供,COX-2检测试剂盒由上海将来实业股份有限公司提供。
1.3 观察指标
①观察并比较试验组和对照组患者之间的IL-13、IL-1Ra和COX-2差异;②观察并比较分析CD及UC患者之间的IL-13、IL-1Ra和COX-2差异;③观察并比较分析CD各亚型及UC各亚型患者之间的IL-13、IL-1Ra和COX-2差异。
1.4 统计学方法
采用SPSS 23.0统计分析软件进行临床试验数据进行分析研究,计量资料采用()表示,计数资料采用[n(%)]表示,计量资料多组间比较采用F检验,多组间两两比较所用统计学方法为LSD-t检验,相关性分析采用Spearman分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组的IL-13、IL-1Ra和COX-2表达比较
实验组的IL-13、IL-1Ra和COX-2表达显著高于对照组,差异有统计学意义(P<0.05),结果见表 1。IL-13、IL-1Ra、COX-2及 IL-13、IL-1Ra和COX-2联合检测阳性率分别为:45.16%(56/124)、62.10%(77/124)、54.84%(68/124)及 91.19%(114/124),血清IL-13、IL-1Ra和COX-2联合检测对于IBD的诊断效能较单独检测高。
表1 两组的IL-13、IL-1Ra和COX-2表达比较()
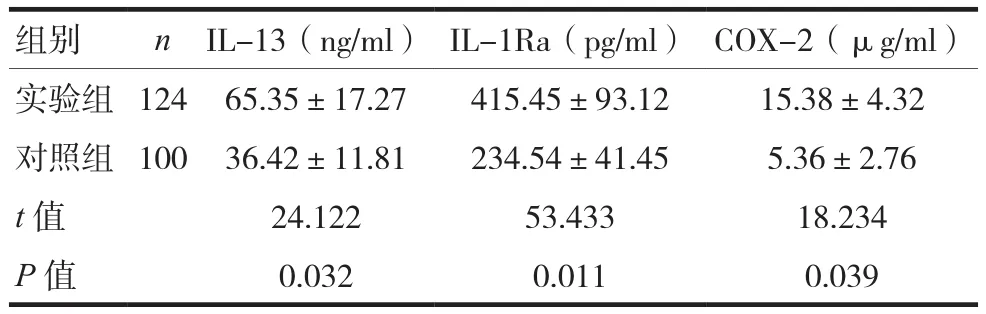
表1 两组的IL-13、IL-1Ra和COX-2表达比较()
组别 n IL-13(ng/ml) IL-1Ra(pg/ml) COX-2(μg/ml)实验组 124 65.35±17.27 415.45±93.12 15.38±4.32对照组 100 36.42±11.81 234.54±41.45 5.36±2.76 t值 24.122 53.433 18.234 P值 0.032 0.011 0.039
2.2 各组IL-13、IL-1Ra和COX-2表达比较
B组的IL-13、IL-1Ra和COX-2表达跟A组比较,差异无统计学意义(P>0.05),见表2;A组 中 A1、A2和 A3患 者 血 清 IL-13、IL-1Ra和COX-2水平比较,差异有统计学意义(P<0.05),B组中 B1、B2和 B3患者血清 IL-13、IL-1Ra和COX-2水平比较,差异有统计学意义(P<0.05),见表3;IL-13、IL-1Ra和COX-2表达水平与UC的改良Mayo评分呈正相关(R2分别为0.78、0.85和0.82,均P< 0.05),见散点图图 1~ 3;IL-13、IL-1Ra和COX-2表达水平与CD的CDAI评分呈正相关(R2分别为 0.76、0.84和 0.81,均P< 0.05),见散点图图4~6。

图4 IL=13表达水平与CD的CDAI评分相关
表2 A、B两组IL-13、IL-1Ra和COX-2表达比较()

表2 A、B两组IL-13、IL-1Ra和COX-2表达比较()
组别 n IL-13(pg/ml) IL-1Ra(pg/ml) COX-2(ng/ml)A 组 60 66.45±18.72 414.45±94.13 15.45±4.43 B 组 64 64.31±17.78 415.76±96.25 12.31±4.98 t值 1.345 0.452 3.764 P值 0.523 0.651 0.356
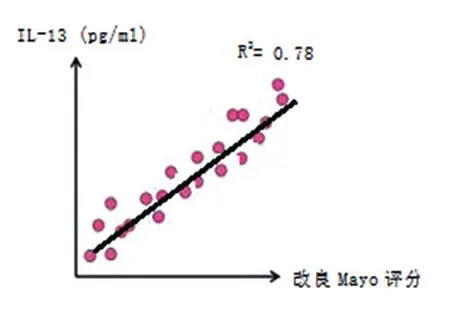
图1 IL=13表达水平与UC的改良Mayo评分相关呈正相关
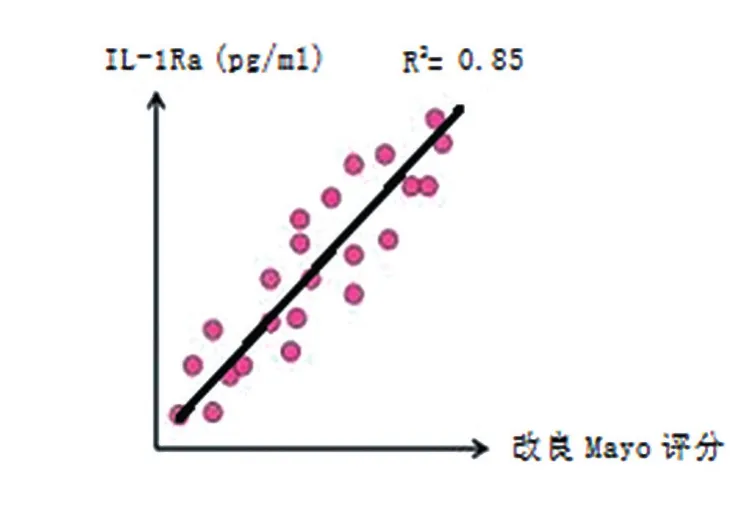
图2 IL=1Ra表达水平与UC的改良Mayo评分相关
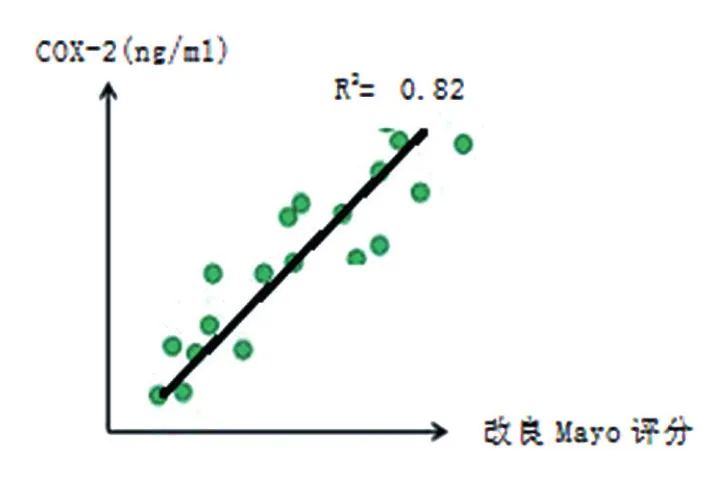
图3 COX-2表达水平与UC的改良Mayo评分相关
表3 各组中的IL-13、IL-1Ra和COX-2表达比较()

表3 各组中的IL-13、IL-1Ra和COX-2表达比较()
注:与A1组比较△P<0.05;与A3比较☆P<0.05;与B1组比较◆P<0.05;与B3组比较,◇P<0.05
组别 n IL-13(pg/ml) IL-1Ra(pg/ml) COX-2(ng/ml)A1 18 85.63±22.27△ 501.45±112.34△ 25.36±6.43△A2 26 66.56±18.43☆ 414.45±82.45☆ 13.45±7.25☆A3 26 44.69±13.75★ 316.58±73.57★ 7.55±3.62★B1 21 85.21±10.36▲ 511.82±111.75▲ 24.30±7.42▲B2 25 64.14±12.3◇ 419.51±83.74◇ 13.62±3.72◇B3 18 40.19±16.61◆ 300.71±73.88◆ 7.18±2.44◆FA1、A2、A3组间比较值 38.421 58.323 16.323 PA1、A2、A3组间比较值 0.023 0.006 0.044 FB1、B2、B3组间比较值 34.722 54.832 16.786 PB1、B2、B3组间比较值 0.026 0.009 0.042

图5 IL=1Ra表达水平与CD的CDAI评分相关
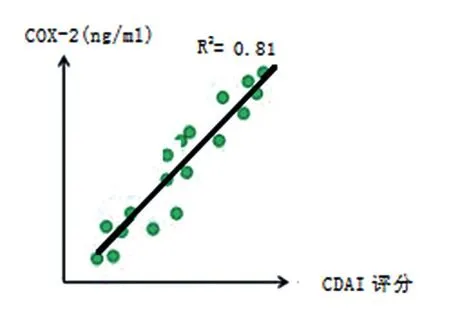
图6 COX-2表达水平与CD的CDAI评分相关
3 讨论
目前对IBD主要包括CD和UC,基发病率呈逐年上升的趋势[10];IBD发病是由多因素相互作用所致[11];IBD病变主要局限于结肠、直肠和回肠黏膜和黏膜下层,病程多表现为活动期和缓解期交替的慢性经过,容易并发多种并发症如结直肠癌;IBD多采用联合体格检查、影像学、实验室检查与组织活检等技术综合评定,结肠镜检查或是病理学检查对于IBD的临床诊断与鉴别诊断均具有不可替代的重要的临床作用[12]。结肠镜检查或是病理学检查费用昂贵且操作复杂侵入性,存在潜在的损伤及副作用风险,患者接受性比较差[13];随着各种IBD相关血清学检测手段不断的发展,为IBD的诊断、鉴别诊断、疗效评估和预后判断提供了帮助[14]。
本研究结果显示,实验组的IL-13、IL-1Ra和COX-2均高于健康体检的对照组,此外,血清IL-13、IL-1Ra和COX-2联合检测对于IBD的诊断效能较单独检测高;IL-1是重要的前炎症因子,相关的研究表明IL-1在炎症性肠道组织及和肠黏膜中的表达明显增强,IL-1Ra与IL-1的动态平衡与炎症反应的发生密切相关,IL-1Ra水平低下增加诱导IBD的易感性,IL-1Ra与IL-1动态平衡被打破后可导致IBD炎症反应,其主要的发生的原机制,IL-1Ra是IL-1拮抗剂,通过与IL-1受体的竞争性结合而影响信号转导,减弱IL-1相关的炎症效应细胞炎症作用,IL-1Ra是机体内重要的致炎免疫调节因子[15]。COX-2以同源二聚体或异源二聚体的形式存在于内质网膜上和核膜上,具有环氧化酶和过氧化氢酶的活性的双功能酶,在正常情况之下很难被检测出来处于静息状态,在机体受到创伤、感染或癌症等病理情况下,被的生长因子、内毒素、炎症介子和细胞因子等刺激及诱导,其表达可以快速增加可高达50倍以上,COX-2在肿瘤或者炎症的发生发展中起到非常重要的作用[16],本研究结果证实在IBD疾病的活动期COX-2呈显著上升状态,COX-2在IBD高表达是肠黏膜损伤愈合过程中的一种保护性预防反应,主要是增强机体对肠黏膜细胞保护能力,促进损伤的肠组织血流量,促进损伤的肠组织的上皮细胞增生及修复能力,通过COX-2的环氧化活性和过氧化活性的作用下,依次转变为前列腺素中间代谢产物PGG2和PGH2,使肠管组织毛细血管和微静脉通透性增加,使IBD的炎症反应放大或持久化[17];IL-13属于β细胞因子家族,主要参与机体的体液免疫反应,是由Th2细胞分泌的既能调节炎症因子又能激发免疫应答反应的高能多效性细胞因子[18],IL-13可诱导单核细胞分化,可即时响应感染和组织损伤而迅速产生,增强其MHCⅡ类分子的表达;通过刺激急性期反应、造血和免疫反应促进宿主防御,抑制单核细胞分泌促炎性递质和下调有细胞毒性的单核细胞功能,控制炎症反应,目前IL-13仍被作为是炎症急性反应时相的可靠的标志物之一[19];研究结果显示,CD患者和UC患者血清 IL-13、IL-1Ra和COX-2水平比较无统计学差异,表明血清IL-13、IL-1Ra和COX-2水平与IBD的CD、UC发生发展有关,但与IBD的各类疾病类型无关,是由于CD、UC的IBD疾病发生过程中,大量的促炎性因子会刺激相关的抗炎性因子(IL-13)及相关的调节物质(IL-1Ra和COX-2)补偿性的增多,拮抗肠道炎性。本研究中,IBD患者的IL-13、IL-1Ra和COX-2检测值与IBD患者活动性具有相关性和一致性,IL-13、IL-1Ra和COX-2与UC及CD疾病活动度呈正相关,这充分证明IL-13、IL-1Ra和COX-2能够参与UC及CD的发生发展,提示UC及CD存在炎症反应状态之下,在发病过程中抗炎性因子及相关的调节物质补偿性的大量表达,血清学联合检测能够增加UC及CD诊断的准确性。我们进一步证实临床症状分级越高,随UC及CD严重程度的不断演变,IL-13、IL-1Ra和COX-2表达水平随着病情的加重而升高,IL-13、IL-1Ra和COX-2是评估UC及CD严重程度敏感性和特异性的指标,能够评估活动期UC及CD的病情严重程度,可作为临床评估病情的重要指标。本研究结果不足与缺陷,凭借血清IL-13、IL-1Ra和COX-2浓度水平,无法早期诊断IBD,也无法鉴别诊断UC及CD之间的分型,对未来的改进方案,血清IL-13、IL-1Ra和COX-2三者联合其他更多的非侵入性指标检测,以便从临床上试图寻找非侵入性指标高效的诊断IBD及鉴别UC及CD之间的分型。
综上所述,IBD患者血清IL-13、IL-1Ra和COX-2水平明显升高,且与UC和CD活动性有关。IL-13、IL-1Ra和COX-2的表达和UC及CD的活性密切相关,可作为判断UC及CD活性的指标。
