LED红光照射对牙龈成纤维细胞抗炎反应的影响
2021-08-15刘旭文陈泽庆黄诗捷卢志成刘木清
刘旭文,陈泽庆,黄诗捷,卢志成,刘木清
(1.复旦大学光源与照明工程系,上海 200433;2.复旦大学先进照明技术教育部工程研究中心,上海 200433; 3.复旦大学工程与应用技术研究院,上海 200433)
引言
发光二极管 (Light Emitting Diode,LED)具备高效、稳定、环保等优点,广泛应用于照明、显示等领域。其安全高效、波长范围广、光谱纯、光谱半波带宽窄的优势,也使其在医学领域的应用日渐广泛,已涵盖皮肤医学、生物节律、口腔医学、生物医学诊断及医学照明等应用场景[1-3]。
牙周病是指发生于牙龈、牙周膜等牙周支持组织的慢性炎症性疾病,牙周病病因复杂,但致病关键是菌斑微生物及其产物长期作用于牙周支持组织,诱发机体的免疫应答反应,引起牙周病的优势菌包括牙龈卟啉单胞菌、福赛斯坦纳菌、伴放线菌嗜血菌等[4]。人牙龈成纤维细胞(human gingival fibroblasts,HGFs)在细菌病原的刺激下会分泌前列腺素(prostaglandin E2,PGE2)、IL-6、IL-8等炎性介质来参与机体炎症免疫反应,脂多糖(lipopolysaccharide,LPS)是牙龈卟啉单胞菌的主要成分,因此作为体外模拟牙周炎实验的高效诱导因子被广泛采用[5]。
牙周病治疗的关键在于去除定植于牙根面上的菌斑及细菌产物,清除病变的牙周组织,阻止疾病的进展,促进牙周组织的再生。牙周病治疗的第一步是通过机械方法去除牙石、菌斑等刺激源,治疗方法包括龈上洁治术和龈下刮治根面平整术,但口腔内部存在器械难以达到的部位,刮治难以彻底。常需通过口服或局部应用抗生素来实现对牙菌斑的控制,易引发不良反应和耐药性[6]。
Dungel等[7]研究发现632 nm的LED红光照射具有促进细胞增殖、减轻炎症及促进伤口愈合的作用。Komerik等[8]研究发现625 nm的LED红光照射可减少炎症反应并诱导牙周组织中的细胞增殖机制。Almeida-Lopes等[9]对牙龈成纤维细胞的增殖进行研究,发现相同能量密度、不同输出功率下,红光比其他可见光能诱导更高的细胞增殖。Li等[10]发现630 nm的LED光照可以减轻免疫细胞的炎症反应。Ohsugi等[11]发现光照能够抑制与骨细胞、成纤维细胞、人类牙周韧带细胞和内皮细胞炎症相关的基因表达,每种目标细胞的合适照射功率都不同。本文主要研究在光照剂量为18 J/cm2的情况下,不同光强度的630 nm红光照射对牙龈成纤维细胞的抗炎反应的影响,并对实验结果进行分析。
1 实验设计与方法
1.1 LED光照系统
光照系统由触控屏、信号控制器、LED驱动器和LED光源组成,触控屏与用户交互光照参数和开关指令,信号控制器反馈光源状态,处理用户指令,并控制LED驱动器驱动LED光源。光照系统使用信号控制器能调节控制电压和PWM信号以控制LED驱动器输出的工作频率、占空比和峰值电流,进而实现光照强度的调节。信号控制器的电压调节范围为0~2.5 V,调节精度0.01 V,对应LED峰值电流值0~2 A;PWM信号频率范围0~20 K,调节精度0.01 kHz,占空比调节范围0~100%,调节精度1%,对应LED光源工作频率和占空比。为了达到细胞光照实验所需的均匀度,使用了DIALux软件对LED光源进行了光学仿真,确定了能达到足够均匀度的LED阵列图案,光照系统可以在其工作范围内(距离光源25 cm,直径20 cm的矩形平面)提供90%的均匀度。本次实验采用的光照系统如图1(a)所示,LED光源的峰值波长为630 nm,光源光功率分布图如图1(b)所示。
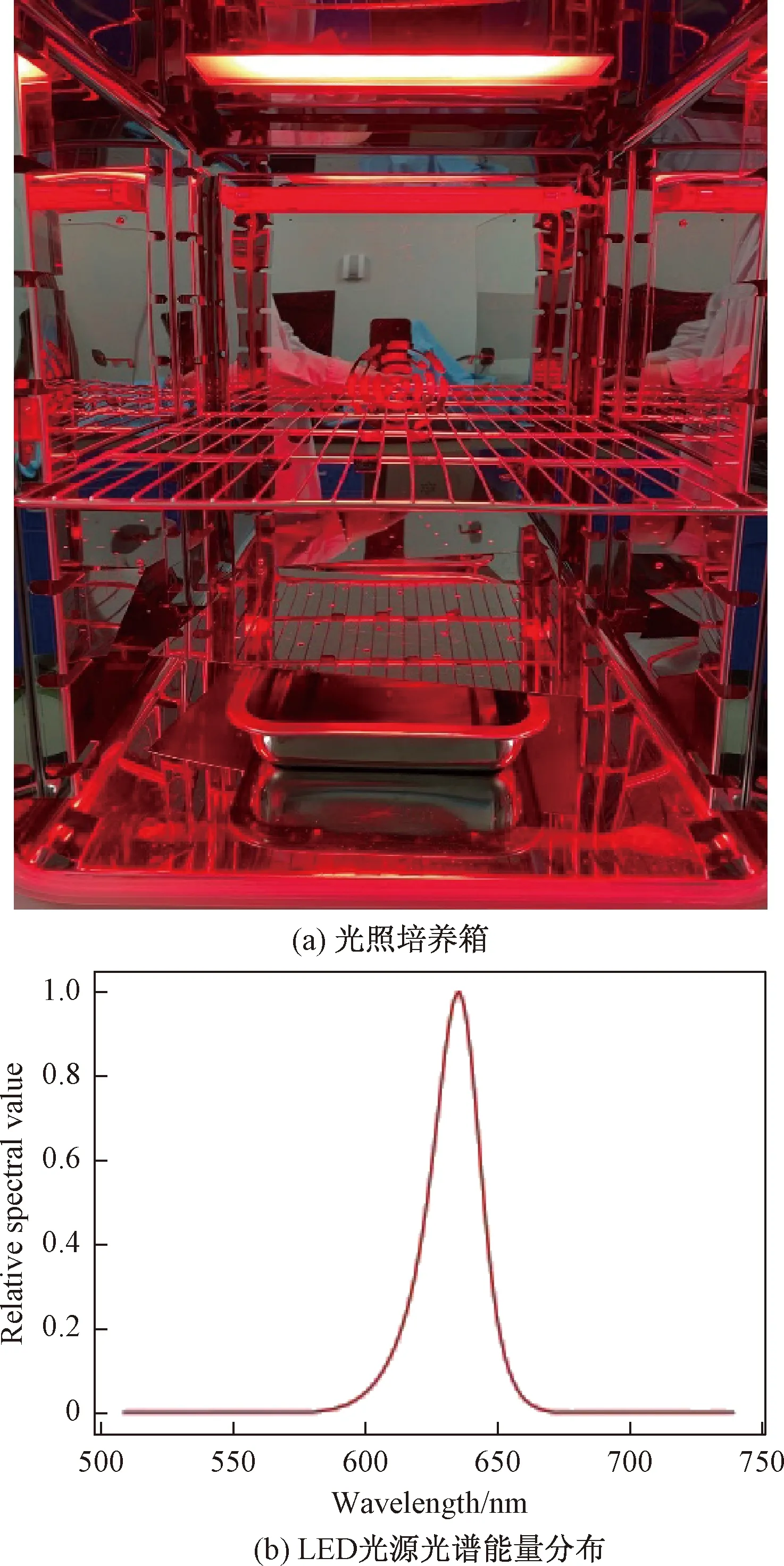
图1 LED光照系统Fig.1 LED lighting system
1.2 实验设计
实验分组:本实验根据光照强度不同和细胞是否加脂多糖刺激分为6个小组,分别为:1)对照组,细胞不受脂多糖刺激,也不受红光照射;2)脂多糖(LPS)组,细胞受脂多糖刺激,但不受红光照射;3)2 mW/cm2组,细胞受脂多糖刺激,同时受光剂量为18 J/cm2、光强为2 mW/cm2的红光照射;4)5 mW/cm2组,细胞受脂多糖刺激,同时受光剂量为18 J/cm2、光强为5 mW/cm2的红光照射;5)10 mW/cm2组,细胞受脂多糖刺激,同时受光剂量为18 J/cm2、光强为10 mW/cm2的红光照射;6)20 mW/cm2组,细胞受脂多糖刺激,同时受光剂量为18 J/cm2、光强为20 mW/cm2的红光照射。
实验流程:1)将铺好细胞的96孔板放置在37 ℃、5% CO2、90%相对湿度的细胞培养箱中培养;2)24 h后,吸除孔中旧培养基,往脂多糖组、4个光照组分别加入150 μL含有浓度为16 μg/mL脂多糖(Invivogen,美国)的新鲜培养基,往空白对照组加入150 μL不含有脂多糖的新鲜培养基,然后放入细胞培养箱;3)调好光照培养箱的光照强度,将需要光照的96孔板放入光照培养箱进行光照,光照完后立刻放回细胞培养箱;4)24 h后,开始检测细胞活性、活性氧、线粒体膜电位、上清液中PGE2的浓度。
1.3 细胞培养
细胞复苏:取在-80 ℃冰箱中冻存的牙龈成纤维细胞,于37 ℃水浴中迅速解冻,然后用移液枪将细胞转移至离心管中,放入离心机(L2-6K,可成)以1 000 R/min的转速离心5 min,移除上清液,用含10%胎牛血清(Gibco,美国)和1%双抗(HyClone,美国)的MEM(1X)培养基(Gibco,meiguo1)进行重悬,然后培养在25 cm2的细胞培养瓶中,并放入5% CO2、37 ℃、90%相对湿度的细胞培养箱(启前QQ-80A-II,中国)中培养。
细胞传代:待在荧光显微镜(Olympus BX53,日本)下观察到贴壁细胞融合至80%左右开始进行细胞传代,去除旧的细胞培养基,用PBS缓冲液(Solarbio,中国)冲洗两遍,然后用2 mL胰蛋白酶(Gibco,美国)对细胞进行消化至脱落,然后加入4 mL培养基终止消化,放入离心机以1 000 R/min的转速离心5 min,弃去上清液,加入1 mL培养基进行吹打重悬,然后按1∶3的比例将细胞铺至新的培养瓶中进行培养。
细胞铺板:等新培养瓶中的细胞融合至80%左右,去除旧的细胞培养基,用PBS缓冲液冲洗两遍,再用2 mL胰蛋白酶对细胞进行消化至脱落,然后加入4 mL培养基终止消化,放入离心机以1 000 R/min的转速离心5 min,弃去上清液,加入1 mL培养基进行吹打重悬,然后按照30 μL细胞重悬液与1 mL细胞培养基的比例进行细胞稀释,再用排枪往96孔板中接种150 μL的稀释好的细胞重悬液,使每个孔中的细胞密度适中、分布均匀,然后将铺好细胞的96孔板放入细胞培育箱中,准备下一步光照实验。

表1 实验条件和分组
1.4 CCK-8检测细胞活性
从37 ℃细胞培养箱中取出细胞培养板,使用排枪将旧培养基移除,然后每个孔中加入110 μL现配的含CCK-8(Dojindo,日本)的培养基(CCK-8与培养基的比例为1∶10),然后放入细胞培养箱中培养2 h,最后用酶标仪(Thermo Scientific,美国)测定各个孔在450 nm处的吸光度,即可得出该孔的细胞活性。
1.5 细胞内ROS检测
使用DCFH-DA探针(南京建成,中国)检测细胞内活性氧,将DCFH-DA探针按照1∶2000的比例加入无血清培养液中,然后往96孔板的每个孔中加入100 μL稀释好的DCFH-DA,将96孔板放入37 ℃的细胞培养箱避光孵育45 min后,吸除上清液,并用无血清培养液清洗两次,并放置于发射波长为500 nm的荧光显微镜下观察,拍好图片,使用ImagJ软件进行分析。
1.6 线粒体膜电位检测
使用带有JC-1荧光探针(碧云天,中国)的试剂盒检测细胞内的线粒体膜电位,吸除96孔板的小孔中的旧培养基,往每个孔中加入100 μL的JC-1染色工作液,并放入37 ℃的细胞培养箱孵育20 min,孵育结束后,吸出上清液,用JC-1染色缓冲液洗涤2次,并放置于发射波长为500 nm和580 nm的荧光显微镜下观察。
1.7 PGE2检测
酶联免疫吸附法检测细胞上清液中前列腺素E2的浓度,使用酶联免疫试剂盒(R&D System,美国)进行检测,用PGE2抗原包被在酶标板上,使牙龈成纤维细胞上清液中的PGE2与包被的PGE2竞争生物素标记的抗PGE2单抗上的结合位点,使游离的成分被洗去;然后加入辣根过氧化物酶标记的亲和素,生物素与亲和素特异性结合而形成免疫复合物,使游离的成分被洗去,然后加入底物溶液,底物溶液在辣根过氧化物酶的催化下会变成蓝色,加入终止溶液后变成黄色,用酶标仪在发射波长为450 nm处测OD值,通过绘制标准曲线计算出牙龈成纤维细胞上清液中的PGE2浓度。
1.8 统计学分析
所有实验均需重复三次,实验数据使用SPSS进行方差分析(ANOVA),若P<0.05,则表示有显著性差异。
2 实验结果与讨论
2.1 脂多糖对细胞活性的影响
脂多糖(LPS)是牙龈卟啉单胞菌外膜的主要成分,在本实验中被用来刺激牙龈成纤维细胞,使细胞产生炎症反应。Sismey-Durrant等在含0.1、1.0和10.0 μg/mL牙龈卟啉单胞菌脂多糖的无血清培养基中培养牙龈成纤维细胞,发现LPS浓度越高,细胞产生的PGE2水平越高[12]。荆冉等发现1 μg/mL的脂多糖对人周膜成纤维细胞活性的抑制效果不明显 (P>0.05),但10 μg/mL的脂多糖可以显著的抑制细胞活性(P<0.05)[13]。为防止LPS浓度过高会对细胞活性产生影响,对细胞造成损伤,所以先探究不同浓度的脂多糖对牙龈成纤维细胞活性的影响。先配好含有浓度分别为0、4、8、16、32、64、128 μg/mL脂多糖的培养基,然后将培养基分别加入到含有牙龈成纤维细胞的96孔板中,再把96孔板放入细胞培养箱培养24 h,最后使用CCK-8试剂盒检测在含有不同浓度脂多糖的培养基中培养24 h后的细胞活性。从图2中我们可以看出,当培养基中的脂多糖浓度小于16 μg/mL时,脂多糖对牙龈成纤维细胞的活性影响较小,4、8、16 μg/mL组的牙龈成纤维细胞活性与对照组(0 μg/mL)的细胞活性没有显著性差异;当培养基中脂多糖浓度在32 μg/mL以上时,脂多糖对牙龈成纤维细胞活性的影响较大,32、64、128 μg/mL组的牙龈成纤维细胞活性与对照组(0 μg/mL)的细胞活性之间有显著性差异。所以,我们选择16 μg/mL的脂多糖浓度进行下一步实验。

图2 不同浓度脂多糖对牙龈成纤维细胞活性的影响(P<0.05)Fig.2 Effects of different concentrations of lipopolysaccharide on the activity of gingival fibroblasts
2.2 不同强度光照对细胞分泌PGE2的影响
PGE2是人体细胞中重要的炎症介质,在牙周病患者的唾液中的含量明显高于正常人[14]。PGE2主要是由受到细菌分泌的脂多糖刺激后的牙龈成纤维细胞产生,前列腺素E2浓度增加会引起牙龈炎和牙槽骨吸收[15,16]。在本实验中,使用浓度为16 μg/mL的牙龈卟啉单胞菌脂多糖刺激牙龈成纤维细胞,使细胞产生炎症反应,然后对产生炎症的细胞进行光照处理,光照剂量均为18 J/cm2,根据光强度的不同,将实验组分为2 mW/cm2、5 mW/cm2、10 mW/cm2、20 mW/cm2,并设有control组(细胞不受脂多糖刺激,也进行光照)和LPS组(细胞只受脂多糖刺激,不进行光照)进行对照,根据图3结果,我们可以发现脂多糖刺激下的牙龈成纤维细胞产生了更多的PGE2,说明脂多糖使细胞产生了明显的炎症反应;4个光照组相比于LPS组,PGE2的浓度显著下降,说明18 J/cm2的红光照射可以抑制炎症细胞分泌PGE2,即可以促进牙龈成纤维细胞产生抗炎反应;5 mW/cm2组的PGE2浓度显著低于2 mW/cm2、10 mW/cm2、20 mW/cm2组,说明在光照剂量相同情况下,强度为5 mW/cm2的光对牙龈成纤维细胞炎症的治疗效果最好。
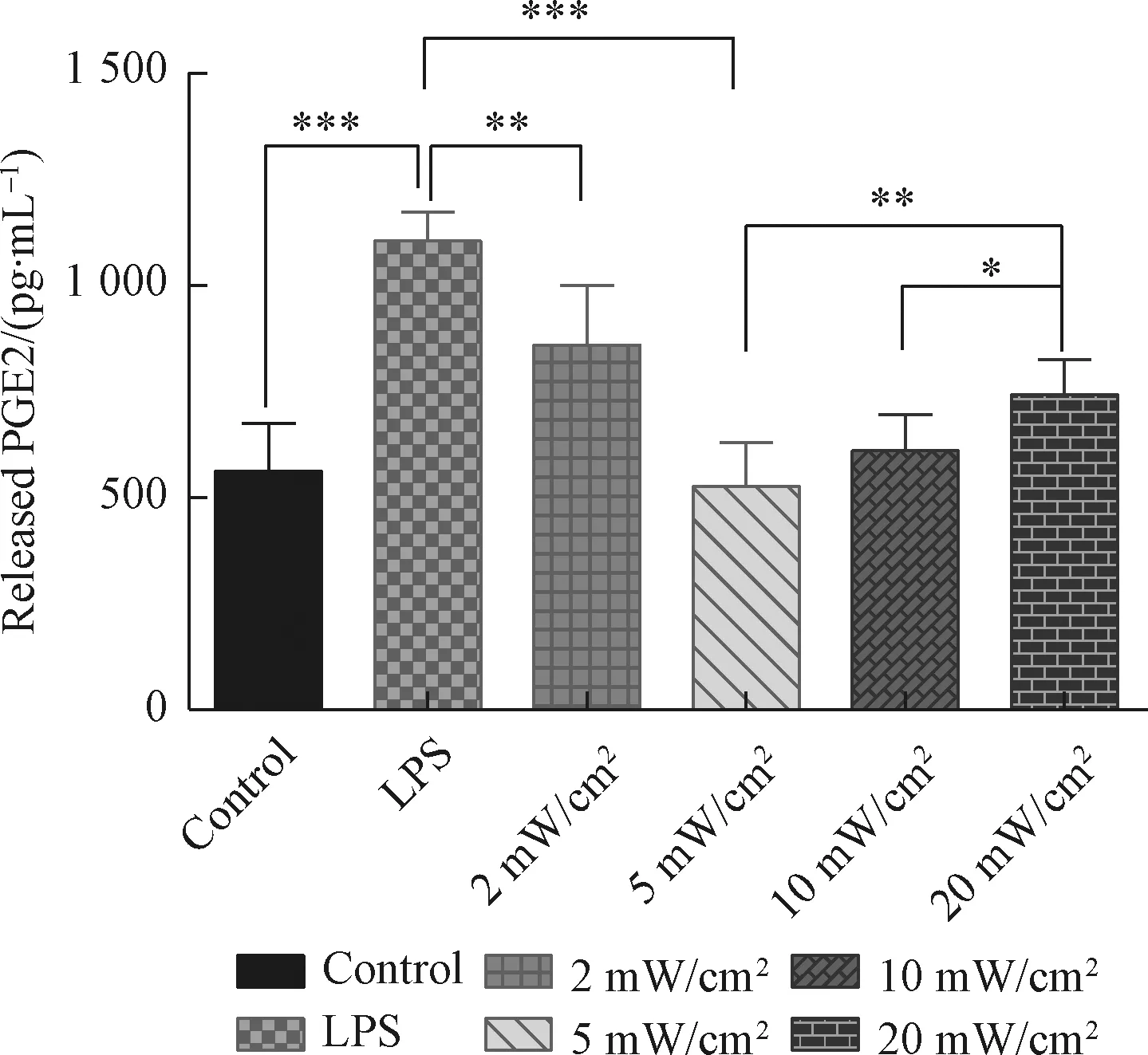
图3 不同光照强度对细胞分泌PGE2的影响 (*P<0.05,**P<0.01,***P<0.001)Fig.3 The effect of different light intensity on PGE2 secretion by cells
2.3 不同强度光照对细胞活性的影响
吴艳、Zaccara IM、Soares DM等发现一定能量的LED红光照射可以使牙周膜干细胞、人牙髓干细胞、人牙周韧带干细胞增殖[17-19]。前面,我们发现630 nm红光照射可以抑制炎症细胞内PGE2的产生,使受LPS刺激后的牙龈成纤维细胞的炎症减轻,为了研究这是否与红光可以促进细胞增殖相关。接下来我们探究不同实验条件对牙龈成纤维细胞活性的影响。首先将牙龈成纤维细胞均匀的铺在96孔板内,然后将细胞分成6组,按相应的实验条件处理细胞,将所有处理后的细胞放入细胞培养箱,24 h后使用CCK-8试剂盒检测每组细胞的活性。如图4所示,6个组的细胞活性之间没有显著性差异,说明在本实验中光照条件和脂多糖处理均对牙龈成纤维细胞的活性没有明显影响,也证明了红光照射抑制细胞炎症与改变细胞活性无关。

图4 不同实验条件下的细胞活性Fig.4 The cell viability under different experimental conditions
2.4 不同强度光照对细胞ROS水平的影响
Orihuela-Campos等[20]、Tsutsumi等[21]、李坤阳等[22]发现白藜芦醇、L-抗坏血酸2-磷酸镁盐、姜黄素等作用于人牙龈成纤维细胞,能够有效抑制ROS产生,从而抑制细胞炎症反应,但很少有人研究LED红光对炎症细胞内ROS水平的影响。因此,我们探究在相同光剂量18 J/cm2,不同光照条件下,细胞内ROS产生的情况。实验结果如图5所示,图5(a)为荧光显微镜下细胞内活性氧的荧光图,图5(b)为使用ImagJ软件对荧光图进行分析的结果,可以发现16 μg/mL的脂多糖刺激牙龈成纤维细胞后,细胞内的ROS水平上升,这与李莹等[23]、吴忠敏等[24]的研究结果一致。我们还可以发现LED红光照射可以抑制炎症细胞内活性氧的产生,LPS组细胞内活性氧水平显著高于2 mW/cm2、5 mW/cm2、10 mW/cm2、20 mW/cm2组细胞内活性氧水平,且当光强为5 mW/cm2时,红光照射对炎症细胞内活性氧产生的抑制效果最佳,这与LED红光抑制炎症细胞内PGE2的产生的结果相对应,也说明LED红光抑制细胞炎症有可能是通过抑制ROS产生传导的,这与Lim等[25]所研究的结果与推论一致。
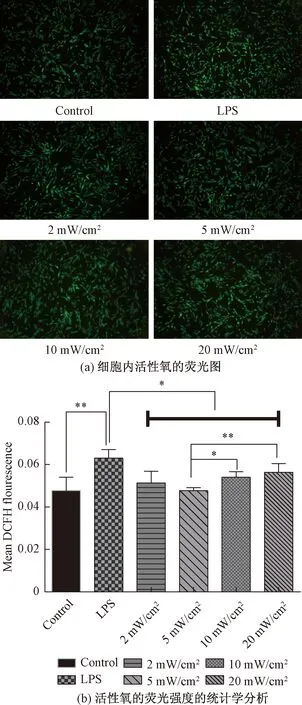
图5 不同实验条件下细胞内ROS水平(*P<0.05, **P<0.01)Fig.5 IntracelluLar ROS levels under different experimental conditions
2.5 不同强度光照对细胞MMP的影响
线粒体是ROS生产的主要场所,特别是受损伤的线粒体会释放出大量的ROS,高水平的ROS会损坏线粒体膜,导致线粒体膜电位下降[26]。正常线粒体膜电位是维持线粒体功能的前提,线粒体膜电位下降,会使线粒体功能障碍,这是细胞凋亡的早期标记性事件[27,28]。ROS是正常细胞代谢的产物,而过量的ROS会产生细胞毒性,使牙龈成纤维细胞的线粒体膜电位下降,诱导细胞凋亡[29]。在本实验中,脂多糖刺激牙龈成纤维细胞,使牙龈成纤维细胞内的ROS水平上升,LED红光照射使炎症细胞内ROS水平下降。为了探究炎症细胞的线粒体膜电位是否受到影响从而导致细胞凋亡,我们对牙龈成纤维细胞的线粒体膜电位进行检测。检测结果如图6(a)所示,当线粒体膜电位高时,JC-1主要以红色荧光聚合物形式存在;当线粒体膜电位低时,JC-1主要以绿色的荧光单体形式存在。图6(b)是使用ImagJ软件对线粒体膜电位荧光率进行统计学分析的结果,可以发现受脂多糖和光照刺激的细胞线粒体膜电位相对于空白对照组没有下降,线粒体功能正常,没有出现细胞凋亡的早期标志。这也可以说明使用LED红光照射可以抑制牙龈成纤维细胞炎症,且不会导致牙龈成纤维细胞的线粒体膜电位下降,也不会导致细胞凋亡。

图6 不同实验条件下细胞线粒体膜电位Fig.6 Cell MMP under different experimental conditions
3 结论
我们通过实验证明了630 nm LED红光照射可以抑制牙龈成纤维细胞的炎症反应,实验数据表明,波长为630 nm、光剂量为18 J/cm2、不同光强度(2 mW/cm2、5 mW/cm2、10 mW/cm2、20 mW/cm2)的红光LED照射均可以降低受脂多糖刺激而产生炎症反应的牙龈成纤维细胞上清液中PGE2的浓度;且在相同光照剂量条件下(18 J/cm2),5 mW/cm2的红光照射对牙龈成纤维细胞的炎症抑制效果最佳。此外我们还发现红光照射抑制牙龈成纤维细胞炎症与降低细胞内ROS水平有关,与影响细胞活性无关;且LED红光照射治疗细胞炎症的方法不会对细胞的线粒体膜电位造成影响,也不会引发细胞凋亡。本文仅针对LED红光对体外培养的牙龈成纤维细胞抗炎反应的研究得出初步结论,至于LED红光是否可以在体外抑制口腔炎症,还需进一步的研究。
