原发性颅内动脉瘤患者预后的影响因素调查与分析
2021-08-15高群张敏
高群 张敏
原发性颅内动脉瘤是由脑动脉/局部血管发生异常病理生理变化,致使脑血管壁病态瘤样突起而形成,属于临床较为常见的脑血管疾病之一,发病率高达10%~20%[1]。动脉瘤破裂后是导致蛛网膜下腔出血的主要原因,常表现为突发性头痛剧烈、颈项强直或部分神经功能损害症状,严重者可出现意识障碍、昏迷甚至死亡,属于一种危害性极强的晚发性疾病[2]。手术是其主要治疗手段,但术后仍然存在较高复发风险,预后不良,严重影响患者生存质量[3]。可见早期识别、评估、诊断和预防术后患者潜在风险因素与危险症状,对提高康复质量,改善患者预后与健康结局具有积极意义[4]。为此,本文将对原发性颅内动脉瘤患者预后的影响因素进行分析,为临床提出针对性改善措施,保障患者预后和转归提供参考性依据。
1 对象与方法
1.1 调查对象
选取2017年1月—2019年12月医院收治的颅内动脉瘤患者219例作为调查对象,将其中预后良好的201例患者作为对照组,预后较差及死亡的18例患者作为病例组。纳入条件:经磁共振血管成像、数字减影血管造影及计算机断层扫描造影确诊为原发性颅内动脉瘤;均无手术禁忌证;年龄>18岁且认知功能正常;无既往精神疾病史或心理障碍等;住院后均行血管内治疗,包括支架辅助栓塞或单纯支架置入术;均自愿参与研究且签署知情同意书。排除标准:合并其他心、肝、肾等严重器官质性病变;患者存在凝血功能障碍;有明显的认知障碍者;入院时已伴有其他症状或处于感染潜伏期者;合并其他恶性肿瘤、急性感染或免疫系统疾病者。
1.2 调查内容及方法
查阅我院电子病例档案,收集患者的一般资料,如年龄、性别、吸烟史、住院时间、高血压、手术时机、手术方式、术中并发症、术后并发症、动脉瘤大小(<5 mm、5~15 mm、>15 mm)、动脉瘤部位(大脑前、大脑后、后交通、前交通、颈内、后循环)、栓塞情况(完全栓塞、部分栓塞)、瘤颈情况(宽颈、窄颈)、Hunt-hess分级(Ⅰ级表示轻微症状、Ⅱ级表现头痛或神经麻痹症状、Ⅲ级表示意识模糊颅内出血、Ⅳ级病情危急)[5]及CT Fisher分级(1级表示CT未见出血、2级表示CT发现弥漫性出血,未形成血块、3级表示CT发现较厚血块且垂直面厚度>1mm、4级表示颅内血肿或脑室内积血)[6]等。
1.3 预后评价标准[7]
采用改良版Rankin评分量表对患者预后进行分级评判,0分表示为没有任何不适症状;1分表示有不适症状但无缺失表现,能够正常活动;2分表示有轻度残疾,生活能够自理 ;3分表示中度残疾,能够行走;4分表示中重度残疾,无法自主活动;5分表示重度残疾,绝对卧床需照护;6分表示死亡。
1.4 统计学处理
采用SPSS 21.0统计学软件进行数据处理。单因素分析中,计数资料组间构成比较采用χ2检验。影响颅内动脉瘤患者预后的多因素分析,采用Logistic回归模型分析。检验水准α=0.05,以P<0.05为差异具有统计学意义。
2 结果
2.1 影响颅内动脉瘤患者预后的单因素分析
单因素分析显示 ,两组患者年龄、性别、手术方式、瘤颈情况比较差异无统计学意义(P>0.05);两组高血压、手术时机、术后并发症、动脉瘤大小、栓塞情况、Hunt-hess分级及CT Fisher分级比较,差异具有统计学意义(P<0.05)。见表1。
2.2 影响颅内动脉瘤患者预后的多因素分析
以颅内动脉瘤预后是否较差为因变量,以单因素分析中有统计学意义的因素为自变量,进行多因素Logistic 回归分析。结果显示,高血压、术后并发症、Hunt-hess分级及CT Fisher分级均为影响颅内动脉瘤患者预后的危险因素(P<0.05)。见表2。
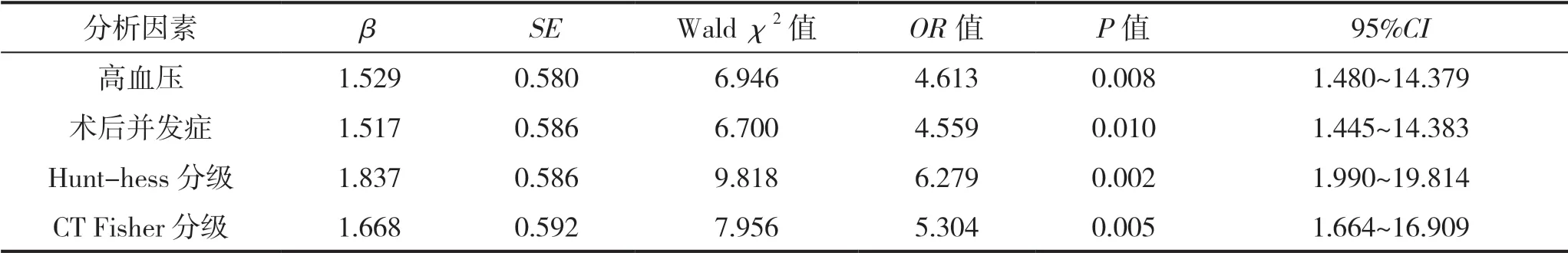
表2 影响颅内动脉瘤患者预后的多因素分析
3 讨论
颅内动脉瘤患者会因动脉血管壁增厚、血管狭窄而引发颅内缺血/出血、血液循环不畅等不良情况,甚至引起穿刺点出血、应激性溃疡、脑血管痉挛、脑梗死及脑积水等并发症发生[8]。大量临床证实[9],颅内动脉瘤合并糖尿病患者白细胞的吞噬能力较弱,患者抵抗力下降,总体预后情况普遍较差。另有研究表明[10],患者术后瘤体或瘤颈部分极易出现再通、残颈或残腔扩大等现象,术后复发率较高。近年来血管内治疗介入术虽有很大进步和发展,但对介入治疗破裂患者预后的影响因素仍不明确,因此对血管内治疗破裂颅内动脉瘤患者预后的影响因素分析具有重要意义。本研究经调查结果显示,90例患者中,预后良好72例,预后较差16例,死亡2例,分别占比为80%、17.78%、2.22%,此结果与既往文献相符[11]。多因素分析结果显示:高血压、术后并发症、Hunt-hess分级及CT Fisher分级均为影响颅内动脉瘤预后的独立危险因素(P<0.05)。
3.1 高血压对颅内动脉瘤患者预后影响
有研究表明[12],颅内出血后48 h内,患者瘤体再破裂风险为10%左右,病死率高达5.5%。高血压作为影响颅内动脉瘤患者预后的独立危险因素,会增加患者心血管疾病的发生风险,引起患者颅内血管壁损伤及血流动力学改变,造成动脉血管管壁囊扩张和动脉瘤破裂,影响预后发展。有研究证实[13],高血压与动脉瘤破裂风险呈正相关,与血流动力学变化有直接关系。
3.2 术后并发症对颅内动脉瘤患者预后影响
本研究显示,脑积水、脑梗死等术后并发症是影响患者预后的独立危险因素。术后并发症是颅内动脉瘤合并糖尿病患者术后难以避免的问题,其中脑梗死和脑积水等严重并发症是导致患者致残、致死的主要原因。有研究指出[14],脑梗死是直接导致患者脑部供血区域血流量减少的主要原因,对脑组织造成不可逆损伤,影响预后发展。因此,应尽早清除蛛网膜下腔积血及其降解产物,早期足量足疗程使用尼莫地平,防止脑梗死的发生。据有关研究表明[15],急性梗阻性脑积水是动脉瘤患者术后最为常见的急性并发症,其发生率可高达15%~85%。因此,应做到早期处理急性脑积水,及时采取分流管置入术,也可持续腰大池引流或脑室穿刺引流,防止病情恶化以改善预后情况。
3.3 Hunt-hess分级对颅内动脉瘤患者预后影响
Hunt-hess分级是评价患者病情严重程度和预后的重要临床指标,能够反应出患者临床症状及意识状况,对手术时机选择具有重要作用。有研究证实[16],术前Hunt-hess分级与患者预后有着密切相关,分级越高则预后越差。本研究结果显示,Hunt-hess分级是影响颅内动脉瘤合并糖尿病患者预后的独立危险因素,与既往研究相符[17]。分析原因主要是Hunt-hess分级是依据患者意识水平对急剧局灶性神经系统阳性体征进行识别,能准确预测和判断患者病情严重程度和预后发展,级别显示越高则预示其预后越差。针对Ⅰ级轻微症状患者可在实施镇静和通便基础上采取卧床措施,减少探视次数,避免咳嗽、打喷嚏及情绪激动等因素诱发再出血;针对Ⅱ级头痛或神经麻痹症状可在防止出血基础上,评估头痛部位、性质及程度,向患者解释头痛原因,消除紧张情绪,必要时可遵医嘱使用镇静剂;Ⅲ级患者意识模糊颅内出血,应密切监视患者生命体征变化及瞳孔大小、形态及对光的反应灵敏度,优先考虑颅内再出血或脑疝形成可能性;Ⅳ级病情危急患者应立即进行气管切开给予呼吸机辅助呼吸,重点监测血氧饱和度的变化,防止缺氧加重脑损伤,并及时监测血气分析纠正水电解质紊乱。
3.4 CT Fisher分级对颅内动脉瘤患者预后影响
CT Fisher分级主要是依据动脉瘤破裂出血后在CT上衡量出血量的重要指标,是预测脑血管痉挛的预后因素。多项研究均证实[18],CT Fisher分级是影响患者预后的重要性指标,分级越高则表明预后越差。有学者通过对患者1年内的随访发现[19],CT Fisher分级对其预后影响最大,能够准确识别术后病情发展及严重程度。本研究也证实,CT Fisher分级是影响患者预后的独立危险因素。分析原因可能是随着CT Fisher分级增高,患者颅内出血量也会急剧上升,出血破入脑室后会造成脑血管痉挛、脑梗死及脑积水等严重并发症,影响预后情况。因此对于症状性未破裂动脉瘤或CT Fisher分级较低的患者,应首先考虑血管内栓塞治疗;而对CT Fisher分级较高者可采取综合性治疗,优先考虑患者的死亡风险,对出血过多或脑血管痉挛严重者可在术后早期行腰大池引流术或腰椎穿刺置换脑脊液。
综上所述,影响颅内动脉瘤合并糖尿病患者预后的因素较多,分析发现高血压、术后并发症、Hunt-hess分级及CT Fisher分级均为影响颅内动脉瘤合并糖尿病患者预后的独立危险因素。针对上述因素应加强对相关因素的排查和分析,并辅以针对性干预措施,提高手术治疗效果和改善预后。
