矮牵牛梅林愈伤组织诱导与植株再生
2021-08-14张洁郑益平杨成龙林觅林智敏
张洁 郑益平 杨成龙 林觅 林智敏


摘 要:为建立矮牵牛梅林的高频再生体系,以叶器官为材料,研究不同生长调节剂配比、叶片不同部位和不同形态愈伤对不定芽再生的影响。结果表明:6BA和NAA及其配比极显著影响矮牵牛梅林不定芽再生率,其中NAA 0.3 mg·L-1 极显著促进了矮牵牛梅林不定芽的再生,6BA和NAA浓度超过1.0 mg·L-1和0.5 mg·L-1时,刺激玻璃化的发生。叶片不同部位极显著影响不定芽的再生,芽分化率由高到低依次是叶柄>带主叶脉>不带主叶脉,愈伤组织形态决定芽分化能力和质量,叶柄直接分化丛芽是梅林再生的优良外植体,分化率达98.3%。芽诱导最佳培养基为MS+6BA 1.0 mg·L-1+NAA 0.3 mg·L-1,其产生不定芽无玻璃化且分化率高,为68.3%。叶片愈伤组织诱导最佳培养基为MS+6BA 1. 0 mg· L-1+NAA 0. 3 mg·L-1,其不定芽分化率为68.3%且未产生玻璃化苗;最佳生根培养基为1/2 MS培养基,生根率达100.0%;继代增殖培养最佳培养基为MS+6BA 0.5 mg·L-1+NAA 0.1 mg·L-1,丛生芽多且大小均匀。
关键词:矮牵牛梅林;组织培养;愈伤;植株再生
中圖分类号:S 682.2 文献标志码:A 文章编号:0253-2301(2021)05-0022-06
DOI: 10.13651/j.cnki.fjnykj.2021.05.005
Callus Induction and Plant Regeneration of Petunia Hybrida Meilin
ZHANG Jie, ZHENG Yi-ping, YANG Cheng-long, LIN Mi, LIN Zhi-min*
(Biotechnology Institute, Fujian Academy of Agricultural Sciences, Fuzhou, Fujian 350003, China)
Abstracts: In order to establish a high frequency regeneration system of Petunia hybrida Meilin, the effects of different ratios of growth regulators, different parts of leaves and different forms of callus on the regeneration of adventitious buds were studied. The results showed that 6BA, NAA and their ratios had significant effects on the regeneration rate of adventitious buds of Petunia hybrida. Among which,
0.3 mg·L-1 NAA significantly promoted the regeneration of adventitious buds of Meilin. When the concentration of 6BA and NAA respectively exceeded 1.0 mg·L-1 and 0.5
mg·L-1, the occurrence of vitrification was stimulated. Different parts of leaves significantly affected the regeneration of adventitious buds. The bud differentiation rate from high to low was petiole, with main vein, and without main vein. The ability and quality of bud differentiation were determined by the shape of callus. The direct differentiation of cluster buds from petioles was an excellent explant for the regeneration of Meilin, with the differentiation rate of 98.3%. The optimal medium for the induction of bud was MS+6BA 1.0 mg·L-1+NAA 0.3 mg·L-1, the adventitious buds were produced without vitrification and the differentiation rate was high, reaching 68.3%. The optimal medium for the induction of leaf callus was MS+6BA 1.0 mg·L-1+NAA 0.3 mg·L-1, and the differentiation rate of adventitious bud was 68.3% without vitrification. The best rooting medium was 1/2 MS medium, in which the rooting rate could reach 100.0%. The optimal medium for the multiplication culture was MS+6BA 0.5 mg·L-1+NAA 0.1 mg·L-1, and the cluster buds were
abundant and uniform in size.
Key words: Petunia hybrida Meilin;Tissue culture;Callus;Plant regeneration
矮牵牛Petunia hybrida为茄科碧冬茄属,一年或多年生草本花卉。1985年Horsch等[1]首次获得矮牵牛转基因植株,此后基因工程技术在矮牵牛的应用不断展开[2-4],矮牵牛也因其生活周期短,遗传背景清晰且易于进行根癌农杆菌介导,逐渐成为花卉转基因的模式植物[5]。植物再生系统的建立是进行基因工程研究的实验基础,目前国内外对矮牵牛植株再生的研究较为深入,但矮牵牛再生方式受基因型限制,不同学者得出的结论也不尽相同[6-9]。矮牵牛梅林作为早花抗病品种而在城市园林绿化中应用广泛,吕晋慧等[10]以10个矮牵牛品种为材料建立再生体系,发现梅林系列叶盘再生率极低,仅为41.33%和9.65%,同时在前期的观察发现梅林再生过程中极易玻璃化,且后期无法改良。因此针对这些问题,本试验以矮牵牛梅林为材料,研究其愈伤组织的诱导和植株再生体系的建立,为进一步开展矮牵牛基因工程研究做好准备工作,也为其他观赏植物的基因功能鉴定提供技术支撑。
1 材料与方法
1.1 试验材料
矮牵牛梅林由东北林业大学园林学院实验室提供。
1.2 试验方法
1.2.1 不同激素组合对叶片愈伤诱导及芽分化的影响 以矮牵牛叶器官为外植体,切成0.8 cm×0.8 cm块状,近轴面朝上,接种在MS附加不同浓度6BA(0.5~2.0 mg·L-1)和NAA(0.1~0.5 mg·L-1)的培养基中进行愈伤诱导和不定芽分化。每个处理接种20块,3次重复,观察记录愈伤和不定芽情况,并于35 d 后统计愈伤组织诱导率和不定芽分化率。
1.2.2 不同部位外植体对诱导丛生芽的影响 以不同部位叶片为外植体,即切去叶缘分为不带主叶脉(上部叶)、带主叶脉(中下部叶)、叶柄3个部分,近轴面朝上,接种在
MS+6BA 1.0 mg·L-1+NAA 0.3 mg·L-1的培养基中。每个处理接种20块,3次重复,观察记录出芽率、出芽数(块)和出芽时间。
1.2.3 继代增殖培养 将诱导获得的芽从其基部切下,接种在MS附加不同浓度6BA(0.5~1.0 mg· L-1 )和NAA(0.01~0.3 mg·L-1 )的培养基中,每个处理接种20块,3次重复,观察其生长情况。
1.2.4 生根培养 将单芽接种于MS和1/2MS附加NAA 0~0.1 mg· L-1 和 6BA 0~0.2 mg· L-1的培养基中,每个处理10个芽体,3次重复,观察生根率及其生长情况。
培养条件:以Sigma的MS或1/2MS为基本培养基,琼脂 6 g· L-1,pH 5.8。温度为(25±2)℃,光照强度1500~2000 lx,光照时间为16 h·d-1。
1.3 数据统计与分析
试验数据采用DPS软件进行方差分析与多重比较(Duncan′s法)。
计算方法如下:
愈伤组织诱导率(%)=愈伤块数/总块数×100;
不定芽分化率(%)=分化不定芽块数/总块数×100;
出芽数(块)=总出芽数量/出芽塊数;
生根率(%)=生根芽/总芽数×100。
2 结果与分析
2.1 不同激素组合对叶片愈伤诱导及芽分化的影响
将矮牵牛叶片接种在MS附加6BA和NAA的培养基中,进行愈伤组织和不定芽的诱导。接种7 d后,叶片开始膨大卷曲,伤口处开始出现愈伤组织,其生长状况见表1。由表1可知,矮牵牛叶片在培养基中均可诱导出愈伤组织,6BA浓度过高会使愈伤组织水渍化,浓度过低则无法形成具有分化能力的颗粒状胚性愈伤;当6BA浓度超过1.0 mg·L-1和NAA浓度超过0.5 mg·L-1时不定芽出现玻璃化现象。同时,方差分析表明6BA和NAA及其配比极显著影响矮牵牛不定芽再生率,其中NAA 0.3 mg·L-1 极显著促进了矮牵牛梅林不定芽的再生,当叶片接种在MS+
6BA 1.0 mg·L-1+NAA 0.3 mg·L-1培养基中,其产生不定芽无玻璃化现象且分化率高,为68.3%。叶片愈伤组织诱导及芽分化情况见图1。
2.2 不同部位外植体对诱导丛生芽的影响
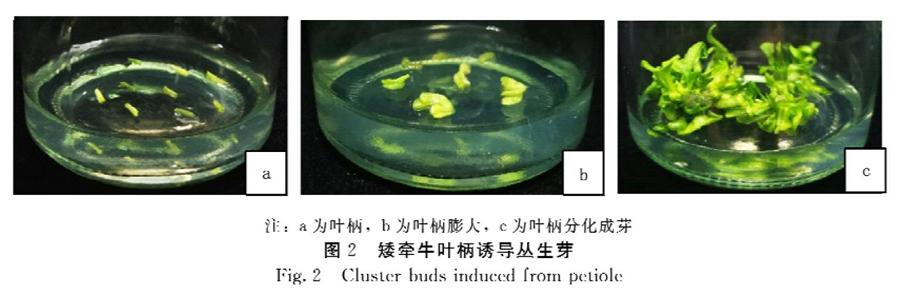
从激素筛选试验中发现,不定芽常在主脉切口处大量发生,因此将叶片分为叶柄、带主脉、不带主脉置于MS+6BA 1.0 mg·L-1+NAA 0.3 mg·L-1的培养基中进行不同部位分别诱导,其生长状况见表2。不带主叶脉的叶片先诱导出愈伤组织,之后少量分化成单芽;带主脉叶片在主脉处形成愈伤组织或直接分化成芽;而叶柄在培养过程中则没有明显的愈伤组织形成,器官直接再生成丛芽(图2)。不同外植体诱导的出芽率及出芽数差异达极显著,由高到低依次是叶柄>带主叶脉>不带主叶脉,不带主叶脉的叶片较难诱导出芽,出芽率仅为13.3%,而带主脉叶片出芽率达76.7%;叶柄出芽率达98.3%,每块出芽数可达6.9块,且出芽最早,是适宜的遗传转化材料。
2.3 继代增殖培养
将诱导获得的芽从其基部切下,接种于附加NAA和6BA的MS和1/2 MS培养基中,通过芽生芽途径进行增殖,接种后5~7 d,基部膨大长出一些细小的丛生芽,15 d左右小芽长大,变成一簇丛生芽。继代增殖过程中6BA浓度超过 0.5 mg·L-1则容易形成愈伤而不分化丛芽;添加NAA则有利于壮苗,浓度为0.1 mg·L-1时丛生芽多且大小均匀;MS+6BA 0.5 mg·L-1+NAA 0.1 mg·L-1利于芽的继代增殖(表3)。同样,把未分化出芽的愈伤切下,遵循激素浓度递减原则进行继代培养,观察愈伤组织发现,沙瓤状愈伤分化率极低,或是分化出玻璃化苗(图3a、3b),只有致密凸起的颗粒化愈伤组织才可获得较高的增殖系数(图3c、3d)。
2.4 生根培养
将生长健壮(高度超过2 cm)的不定芽,接种在MS和1/2 MS附加NAA 0~0.1 mg·L-1和6BA 0~0.2 mg·L-1培养基诱导生根。从表4可以看出,MS和1/2 MS附加6BA均不利于根的诱导,无法产生根系,而附加NAA 0.1 mg·L-1对MS培养基条件下根的数量有促进作用,对1/2 MS条件下根的数量无影响,且根较细长;不定芽在不添加激素的MS或1/2 MS的培养基上都能产生根,但1/2 MS的效果比MS要好,根萌发早且粗长,生根率达100.0%(图4) 。
3 讨论与结论
矮牵牛作为花卉遗传转化的模式植物,其植株再生体系的建立已被广泛研究。然而受基因型的影响,不同品种再生能力差异很大。本研究结果表明,矮牵牛梅林叶盘出愈率高,但分化能力不强,这与吕晋慧等[10]研究一致。愈伤状态决定了愈伤分化的能力,当6BA浓度在0.5 mg·L-1时容易出现无效的沙瓤状愈伤组织,当6BA浓度在1.0 mg·L-1以上时,才能产生致密凸起的颗粒状愈伤组织,且NAA对这种愈伤组织的形成有促进作用,其中0.3 mg·L-1 NAA极显著促进了梅林不定芽的再生,当叶片接种在MS+6BA 1.0 mg·L-1+NAA 0.3 mg·L-1的培养基中,其不定芽分化率为68.3%。
值得注意的是,与其他品种不同,梅林在组织培养过程中极易出现玻璃化苗,当6BA浓度高于1.0 mg·L-1或NAA浓度高于0.5 mg·L-1时均会产生玻璃化苗,且后期无法改良。李柯[11]研究也发现矮牵牛朝阳对6BA、NAA敏感,容易出现玻璃化,以添加6BA 0.5 mg·L-1最有利于朝阳再生。而漫波红色[12]、美声、黄金[10]、重瓣矮牵牛[13]、MD(Mitchell Diploid)[14]等品种对6BA耐受能力较强,6BA 2~3 mg·L-1为最适浓度。不同品种矮牵牛玻璃化的易感度可能受基因型和生长调节剂的双重影响。
同一植物不同部位再生能力不同,矮牵牛茎尖、茎段、叶片及花蕾等作为外植体均可诱导出芽,其中叶片的再生能力较强[15-20]。本研究以梅林叶器官的不同部位为材料,发现其分化能力存在很大差异。叶柄以器官直接再生途径分化为丛芽,出芽率达98.3%,12 d完成芽分化;不带主叶脉的叶片先诱导出愈伤组织,之后少量分化成單芽,出芽率仅为13.3%;带主脉叶片在主脉处形成愈伤组织或直接分化成芽,属于中间形态。目前,矮牵牛的遗传转化常通过叶盘法诱导叶块产生愈伤组织进而分化成芽的形式建立转化体系[21-23]。曹尚杰等[24]以梅林叶盘为材料通过愈伤分化成芽的方式获得7个阳性植株。然而,经历脱分化-再分化的愈伤途径再生完整植株,存在分化时间长、容易发生遗传突变等问题[25-26],直接诱导丛生芽的方式更适合作为遗传转化基因功能鉴定的方法[11]。本研究结果表明,矮牵牛梅林叶柄通过器官直接再生途径获得丛生芽时间短、分生力强、操作简单, 且产生变异率和嵌合体的概率相对较低,是理想的遗传转化材料。陶妹英等[27]研究也表明矮牵牛器官直接再生途径比愈伤组织途径获得不定芽时间短,且不定芽生长状况好,根系生长快。
综上,以矮牵牛梅林叶器官为外植体建立再生体系,最佳的芽诱导培养基为MS+1.0 mg·L-16BA+0.3 mg·L-1 NAA,芽分化率由高到低依次是叶柄>带主叶脉>不带主叶脉,叶柄以器官直接再生途径分化成丛生芽,其出芽早,出芽率达98.3%,是适宜的遗传转化材料;MS+6BA 0.5 mg·L-1+ NAA 0.1 mg·L-1 适合继代增殖培养;1/2MS培养基进行生根诱导,诱导率达100.0%。因此,该品种适合作为转基因材料,能够为进一步基因工程改良矮牵牛以及花卉植物基因功能鉴定提供良好的基础。
参考文献:
[1]HORSCH R B,FRY J E,HOFFMANN N L,et al. A simple and general method for transferring genes into plant[J].Science,1985,227:1229-1231.
[2]MEYER P,HEIDMANN I,FORKMANN G,et al.A new petunia flower colour generated by transformation of a mutant with a maize gene[J].Nature,1987,330:677-678.
[3]DAVIES K M,BLOOR S J,SPILLER G B,et al.Production of yellow colour in flowers:redirection of flavonoid biosynthesis in Petunia[J].The Plant Journal,1998,13(2):259-266.
[4]GUBRIUM E K,CLARK D G,BARRETT J E,et al.Horticultural performance of transgenic ethylene-insensitive petunias[J].J Am Soc Hortic Sci,2000,125:277-281.
[5]代色平,包满珠.矮牵牛育种研究进展[J].植物学通报,2004,21(4):385-391.
[6]何弦.分子育种技术创制高香型矮牵牛的初步研究[D].福州:福建农林大学,2019.
[7]王梦茹.矮牵牛愈伤组织诱导及原生质体分离培养[D].上海:上海交通大学,2018.
[8]梁冰,杨爱馥,樊锐锋,等.矮牵牛(Petunia hybrida Vilm)组织培养技术研究[J].东北农业大学学报,2006,37(4):478-483.
[9]权宏,齐莹,施和平.紫色大花矮牵牛组织培养与植株再生[J].亚热带植物科学,2004,33(1):51-52.
[10]吕晋慧,王玄,王媛,等.不同基因型矮牵牛高频再生体系建立的研究[J].山西农业大学学报(自然科学版),2011,31(2):97-102.
[11]李柯.利用组织培养改良矮牵牛(Petunia hybrida Vilm.)倍性的研究[D].重庆:西南大学,2008.
[12]董亚茹,王照红,杜建勋,等.矮牵牛漫波红色再生及遗传转化体系的初步建立[J] .山东农业科学,2016,48(3):14-17.
[13]江爱明, 刘恒超, 贾志强,等.大花重瓣矮牵牛植株再生条件的研究[J].郧阳师范高等专科学校学报,2011,31(3):88-89.
[14]王会平. 矮牵牛PhTCP2基因的克隆、表达分析及超量表达研究[D].重庆:西南大学,2013.
[15]佟凤琴,栾岚,胡春霞.矮牵牛的组织培养及快速繁殖的研究[J].辽宁师专学报,2001,3(4):90-91.
[16]瞿素萍.矮牵牛的组织培养研究[J].西南农业大学学报,2001,23(5):447-448.
[17]曲彦婷,吕品,陈菲.矮牵牛快繁技术研究[J].国土与自然资源研究,2003(3):92-93.
[18]張颖,罗凤霞,曾会明,等.3个香型矮牵牛品种的组织培养再生体系[J].沈阳农业大学学报,2005,36(4):424-427.
[19]金晓玲,胡莹,李冰华.矮牵牛茎段植株再生体系的建立[J].中南林业科技大学学报,2007,27(5):71-73.
[20]武术杰,李邱华.矮牵牛Tidal Wave品种遗传转化受体再生体系的建立[J].东北林业大学学报,2007,35(4):14-15.
[21]杨慧.农杆菌介导TvNHX1基因转化矮牵牛及其对NaCl胁迫的响应[D]. 哈尔滨:哈尔滨师范大学,2014.
[22]王红波.矮牵牛组织培养体系的建立和ACO基因cDNA的克隆[D].长沙:中南林业科技大学,2010.
[23]褚云霞.不同DFR基因转化矮牵牛研究[D].上海:上海交通大学,2013.
[24]曹尚杰,焦孟月,张彦妮,等.矮牵牛‘梅林遗传转化体系的建立[J]. 西北林学院学报,2018,33(5):123-129.
[25]宁国贵,白三平,包满珠.矮牵牛细胞的长期离体培养及再生植株的ISSR分析[J].中国农业科学,2007,40(7):1479-1485.
[26]焦孟月.6个矮牵牛品种抗旱性评价及PSARK-IPT基因转化矮牵牛研究[D].哈尔滨:东北林业大学,2017.
[27]陶妹英,贾彩红,徐碧玉.直接诱导不定芽的矮牵牛再生体系的建立[J].农业生物技术科学,2006,22(6):62-65.
(责任编辑:林玲娜)
收稿日期:2021-04-24
作者简介:张洁,女,1983年生,硕士,助理研究员,主要从事园艺植物研究。
通信作者:林智敏,男,1976年生,博士,副研究员,主要从事分子生物学研究(E-mail:lzmfaas@sina.com)。
基金项目:福建省农业科学院自由探索科技创新项目(ZYTS2021006)。
